Лізин
Лізин відіграє важливу роль у всмоктуванні та використанні білка, харчовому балансі, поліпшенні функції нервової системи, посиленні функції імунної системи, профілактиці остеопорозу та інших системах (Behr-Roussel et al., 2000).
Пов’язані терміни:
- Амінокислота
- Фермент
- Пептид
- Білок
- ДНК
- Аргінін
- Гістон
- Гістон Н3
- Ацетилювання
- Метилювання
Завантажити у форматі PDF
Про цю сторінку
Мутації гістонових лізин-метилтрансфераз та деметилаз
Сара Вейріх, Альберт Єльч, в Енциклопедії раку (третє видання), 2019
Анотація
Метилювання лізину є важливою посттрансляційною модифікацією білків гістону та негістону з ключовою роллю в канцерогенезі. Нещодавно у різних пухлинах були виявлені повторювані соматичні мутації білків лізинметилтрансфераз (ПКМТ) та лізиндеметилаз (КДМ). Ці мутації можуть спричинити втрату функції та посилення функції, коли мутація змінює критичні ферментативні властивості або взаємодію з регуляторними білками. Тут ми описуємо роль вибраних ПКМТ та КДМ у раку, зосереджуючи увагу на наслідках мутацій соматичного раку. Дослідження впливу мутацій соматичного раку допомагає зрозуміти роль ПКМТ та КДМ у канцерогенезі та розробити індивідуальну терапію раку.
Вірус простого герпесу
Марет Россі, доктор медичних наук Бредлі Джейкобс, MPH, ABOIM, з інтегративної медицини (четверте видання), 2018
Харчування
Лізин та аргінін
Лізин - незамінна амінокислота, яка в природі не виробляється організмом. Багато клінічних випробувань повідомляють, що багаті лізином дієти та добавки лізину зменшують частоту рецидивів, тяжкість та період загоєння інфекцій вірусом простого герпесу. І навпаки, аргінін виявляється антагоністом лізину. Гріффіт та ін. у дослідженні in vitro продемонстрували, що вірус простого герпесу використовує аргінін для реплікації. 25 Міллер та ін. спостерігали, що лізин конкурує з аргініном за кишкову абсорбцію, транспорт до клітин та реабсорбцію в ниркових канальцях, і він розкладає аргінін, активуючи аргіназу. 26,27 Отже, рекомендується уникати продуктів, багатих на аргінін, таких як горіхи, зернові, шоколад та рафінований цукор, а також збільшене споживання лізинової дієти з м’яса, риби та молочних продуктів. 28 Співвідношення аргініну та лізину у вибраних продуктах харчування представлено нижче 30 (див. Таблицю 20.2 щодо дієтичних міркувань при зараженні вірусом простого герпесу).
Синтез амінокислот ☆
Лізин
Синтез лізину починається з конденсації сепаральдегіду аспартату та пірувату з утворенням циклічного проміжного продукту, який відновлюється НАДФН з утворенням тетрагідродіпіколіната ( Малюнок 5, другий рядок). В кишковій паличці тетрагідродипіколінат сукцинілюється сукциніл-КоА, азот додається глутаматзалежним трансамінуванням, а блокуюча група видаляється з отриманням LL-діамінопімелату. Епімераза перетворює LL-діамінопімелат в мезо-діамінопімелат, який декарбоксилюється, утворюючи лізин. У деяких організмах тетрагідродіпіколінат перетворюється безпосередньо в мезо-діамінопімелат, а у грампозитивних організмів блокуючим агентом є ацетильна група. Єдина відома трансаміназа - це також четвертий фермент синтезу аргініну. Делеція гена цього ферменту не впливає на ріст, що передбачає надлишкові ферменти для реакції трансаміназ.
Регулювання синтезу лізину є складним, що є доцільним, враховуючи кількість важливих проміжних сполук, які синтезуються. Лізин кінетично контролює аспартокіназу III і першу реакцію синтезу лізину - конденсацію пірувату з аспарагіновим семіальдегідом. Гени лізинспецифічного шляху не пов'язані між собою. ArgP активує транскрипцію п’яти з дев’яти ферментів, які перетворюють аспартат в лізин, а лізин запобігає цій активації. LysR в комплексі з діамінопімелатом активує транскрипцію діамінопімелатдекарбоксилази, яка є останнім ферментом шляху. Диамінопімелатне голодування регулює перший здійснений етап синтезу лізину за невідомим механізмом.
Рак, імунологія та запалення та інфекційні хвороби
5.08.2.6.1 Лізиндеметилази
Метилові сліди лізину видаляються сімейством ферментів лізиндеметилази (KDM) залежно від послідовності. KDM поділяються на дві підродини: лізин-специфічні деметилази (LSD1/KDM1) та Jumonji C (JmjC) -домен-містять деметилази (KDMs2–7). Лізин-специфічна деметилазна родина ферментів залежить від флавіну, тоді як ферменти, що містять домен JmjC, залежать від Fe (II) та 2-оксоглутарата. Як повідомляється, домен Jumonji, що містить 6 (JmjD6), має активність деметилювання аргініну; однак ця діяльність підлягає суперечливим повідомленням. 7 В даний час три інгібітори KDM1 проходять клінічні випробування ( Таблиця 1 ).
Таблиця 1. Короткий зміст схвалених епігенетичних регуляторів та клінічних випробувань
| Беліностат | HDAC/пан-HDAC | Затверджено | Периферична Т-клітинна лімфома |
| Панобіностат | HDAC/пан-HDAC | Затверджено | Множинна мієлома |
| Прациностат | HDAC/клас I, II, IV | Затверджено | AML, Т-клітинна лімфома |
| Ромідепсин | HDACS, залежний від HDAC/Zn | Затверджено | Шкірна Т-клітинна лімфома |
| Вориностат | HDAC/пан-HDAC | Затверджено | Шкірна Т-клітинна лімфома |
| Ентіностат | HDAC/клас I, III | Фаза II/III | Множинні ракові захворювання |
| Гівіностат | HDAC/клас I, II | Фаза II | |
| Моцетиностат | HDAC/пан-HDAC | Фаза II | Лімфома, лейкемія |
| Квізіностат | HDAC/пан-HDAC | Фаза II | Лейкемія, MLL, лімфома, солідні злоякісні пухлини |
| Ресміностат | HDAC | Фаза II | HCC |
| Тацединалін | HDAC/HDAC1, HDAC2 | Фаза II | Множинна мієлома |
| Таземестат | HMT/EZH2 | Фаза II | Лімфома, солідні пухлини |
| Вальпроєва кислота | HDAC/пан-HDAC | Фаза II | Множинні ракові захворювання |
| ACY-1215 | HDAC/HDAC6 | Фаза I/II | Множинна мієлома |
| AR-42 | HDAC/пан-HDAC | Фаза I/II | MLL, лімфома, лейкемія |
| ORY-1001 | KDM/KDM1A | Фаза I/II | AML |
| OTX015 | Бромодомен/BET | Фаза I/II | Гліобластома |
| Транілципромін | KDM/KDM1A | Фаза I/II | AML |
| ABBV-075 | Бромодомен | Фаза I | Розширені ракові захворювання |
| Абексиностат | HDAC/пан-HDAC | Фаза I | В-клітинна лімфома |
| БЕЙ-1238097 | Бромодомен/BET | Фаза I | Новоутворення |
| BMS-986158 | Бромодомен/BET | Фаза I | Солідні пухлини |
| CPI-0610 | Бромодомен/BET | Фаза I | Лімфома |
| CPI-1205 | HMT/EZH2 | Фаза I | В-клітинна лімфома |
| CUDC-907 | HDAC/клас I, IIB | Фаза I | Лімфома, множинна мієлома, солідні пухлини |
| GSK525762 | Бромодомен/BDR4 | Фаза 1 | Гематологічна злоякісність, карцинома середньої лінії NUT |
| GSK2816126 | HMT/EZH2 | Фаза I | В-клітинна лімфома, фолікулярна лімфома |
| GSK2879552 | KDM/KDM1A | Фаза I | AML |
| Піноместастат | HMT/DOT1L | Фаза I | Лейкемія |
| ТЕН-010 | Бромодомен/BET | Фаза I | ОМЛ та солідні пухлини |
ФЕРМЕНТАЦІЯ (ПРОМИСЛОВА) | Виробництво амінокислот
Виробництво l-лізину
Лізин являє собою найбільш швидкозростаючий сегмент амінокислот. Основна частина споживаних у світі злаків відчуває дефіцит амінокислоти l-лізину. Це важливий інгредієнт для росту тварин і є важливою частиною мільярдної галузі виробництва кормів для тварин. Добавки лізину перетворюють злаки на збалансований корм або корм для тварин, включаючи птицю, свиней та іншу худобу. Окрім кормів для тварин, лізин використовується у фармацевтиці, дієтичних добавках та косметиці. За підрахунками, світовий ринок л-лізину зріс майже в 20 разів за останні 20 років, і кілька компаній, таких як Ajinomoto Co. Inc. та Archer Daniels Midland Co., наразі розширюють свої потужності завдяки значним інвестиціям у Бразилію, Китай та Сполучені Штати.
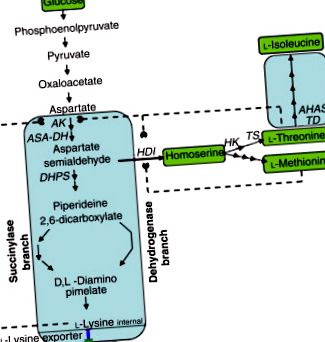
Малюнок 2. Біосинтетичний шлях до l-лізину, l -треоніну та l-ізолейцину в C. glutamicum. АК, аспартат-кінази; ASA-DH, аспартат-семіальдегіддегідрогеназа; HDI, гомосериндегідрогеназа; HK, гомосеринкіназа; TS, треонінсинтетаза; TD, треоніндегідратаза; AHAS, синтаза ацетогідроксикислоти.
Багато роботи було проведено над ауксотрофними та регуляторними мутантами штамів, що надмірно продукують глутамат, для виробництва лізину. Шляхом генетичного видалення гомосериндегідрогенази (HDI) штам Corynebacterium дикого типу, що продукує глутамат, був перетворений у мутант, що продукує лізин, який не може рости, якщо до середовища не додати метіонін та треонін. До тих пір, поки добавка треоніну зберігається низькою, внутрішньоклітинна концентрація треоніну обмежує, а інгібування АК зворотним зв'язком обходить, що призводить до виведення понад 70 г л-1 лізину з культуральними рідинами. У деяких штамах додавання метіоніну та ізолейцину до середовища призвело до збільшення перевиробництва лізину. Вибір стійкості до S-2-аміноетилцистеїну (AEC; тіалізин) блокує пригнічення зворотного зв'язку АК. Інші антиметаболіти, корисні для дерегуляції АК, включають суміш α-кетобутирата та аспартату гідроксамату. Ауксотрофія лейцину може збільшити вироблення лізину. Відомо, що титри l-лізину сягають 170 г l -1 .
Виведення лізину C. glutamicum відбувається шляхом активного транспорту, що досягає концентрації в зовнішньому середовищі декількох 100 мМ. Катіон лізину повинен виділятися проти градієнта мембранного потенціалу (зовні позитивний), а виведення опосередковується носієм. Система залежить від рушійної сили електрона, а не аденозинтрифосфату.
Реконструкція штаму на основі генома була використана для поліпшення швидкості продукування лізину C. glutamicum шляхом порівняння високопродуктивного штаму (швидкість продукування трохи менше 2 г л −1 год -1) та штаму дикого типу. Порівняння 16 генів з продуктивного штаму, що кодують ферменти шляху від глюкози до лізину, виявило мутації в п'яти генах. Введення трьох з цих мутацій (hom, lysC та pyc, що кодують HDI, AK та піруват-карбоксилазу, відповідно) у дикий тип створило новий штам, який продукував 80 gl −1 за 27 год зі швидкістю 3 gl −1 h −1. Додаткове збільшення (на 15%) продукції l-лізину спостерігалося при введенні мутації гена 6-фосфоглюконатдегідрогенази (gnd). Ферментативний аналіз показав, що мутантний фермент був менш чутливим, ніж фермент дикого типу, до алостеричного інгібування внутрішньоклітинними метаболітами. Аналіз метаболічного потоку на основі ізотопів продемонстрував, що мутація gnd призвела до 8% збільшення потоку вуглецю через пентозофосфатний шлях під час виробництва l-лізину. Нарешті, ввівши мутацію mqo (малат: хінон-оксидоредуктаза), можна було збільшити як швидкість продукування, так і титр l-лізину до 95 г л −1 за допомогою періодичної культури.
За допомогою системної метаболічної інженерії 12 визначених геномних змін у генах, що кодують центральні метаболічні ферменти, перенаправляли основні потоки вуглецю, як бажано, на оптимальне використання l-лізинового шляху, передбачене силіко-моделюванням. Спроектований штам C. glutamicum зміг продукувати лізин з високим виходом 0,55 г на грам глюкози, титром 120 г L −1 лізину та продуктивністю 4,0 г л −1 год −1 у періодичній культурі.
Нові епігенетичні методи лікування - бромодоменні ліганди
Девід С. Хевінгс,. Стюарт Дж. Конвей, у Епігенетичній терапії раку, 2015
Відомо, що ацетилювання лізину відіграє важливу роль у процесах, пов’язаних з раком. Отже, існує великий інтерес до розробки інгібіторів ферментів, які додають ацетильну групу до атома ε-азоту лізину, ацетилтрансферази лізину/гістону та ферментів, що виводять ці групи, лізин/гістонових деацетилаз. Бромодомени - це білкові модулі, які зв'язуються ("розпізнають") N-ε-ацетил-1-лізин (ацетил-лізин) і полегшують складання багатопротеїнових каркасів, опосередковуючи взаємодію між білками та білками. Лише порівняно недавно бромодомени розглядалися як терапевтично важливі мішені, однак подальший прогрес у розвитку лікарсько-подібних лігандів бромодомену був стрімким. Тут описані досягнення у розвитку BET (бромодоменних та екстратермінальних) бромодоменних лігандів та їх застосування в біологічних системах, що мають значення для раку. Крім того, обговорюється прогрес у ідентифікації не-BET лігандів бромодомену.
Кофактори
7.19.4.2.1 Біосинтез LTQ
Схема 7. Механізм біосинтезу LTQ.
Синтетичні методи VI - ферментативні та напівферментативні
7.12.2.1 л -ААО
l - Лізин-оксидаза (EC 1.4.3.14) каталізує окислення ω-аміногрупи l-лізину. Цей фермент був використаний в одноферментній двоферментній системі для синтезу кількох неприродних циклічних амінокислот із відповідних лінійних попередників. Для перетворення діамінокислоти спочатку використовували 15 л -лізиноксидазу (альтернативно, на цьому етапі також можна було використовувати l - або d -AAO) 1 у відповідну α-кето амінокислоту 2, який зазнав спонтанної циклізації in situ до імінокислоти 3 (Малюнок 2). Додавання другого ферменту, а саме N-метил-1-амінокислоти дегідрогенази (NMAADH), призвело до зменшення іміну для отримання циклічної амінокислоти 4 з хорошим виходом і з чудовою оптичною чистотою. Загальний процес дерацемізації також проводився з використанням рацемічних аналогів 1 як вихідний матеріал у поєднанні з d -AAO та NMAADH.
Малюнок 2. Застосування l-лізин оксидази в комбінації з N-метиламінокислотою дегідрогеназою для перетворення (R)-1 в циклічну амінокислоту (R)-4.
Фермент лізинциклодеаміназа, який каталізує окислювальну циклізацію l-лізину до l-піпеколевої кислоти, був ідентифікований у кластері генів рапаміцину. Клонування гена та подальша надмірна експресія та очищення ферменту (рис. 3) дали біокаталізатор, який зміг перетворити l-лізин 5 в l -піпеколеву кислоту 6. Однак фермент виявляв значно меншу активність щодо l -орнітину, ніж l-лізин (13 мМ -1 хв -1), а d-лізин не був активним. Механізм ферменту досліджували шляхом вивчення потреб ферменту в кофакторі та маркування ізотопного субстрату. 16
Малюнок 3. Перетворення l-лізину 5 в l-піпеколеву кислоту 6 з використанням лізинциклодеамінази, отриманої від Streptomyces hygroscopicus.
- Liver Fluke - огляд тем ScienceDirect
- Кефір - огляд тем ScienceDirect
- Твердий кал - огляд тем ScienceDirect
- Полікістоз печінки - огляд тем ScienceDirect
- Резистентність до інсуліну - огляд тем ScienceDirect