Кетогенна дієта знижує амілоїд бета 40 і 42 на мишачій моделі хвороби Альцгеймера
Анотація
Передумови
Хвороба Альцгеймера (БА) - це прогресуючий нейродегенеративний розлад, який вражає переважно людей похилого віку. Дослідження як на людях, так і на тваринних моделях пов’язують споживання холестерину та насичених жирів із відкладенням амілоїд-β (Aβ) та розвитком БА. Проте ці дослідження не вивчали дієти з високим вмістом жиру в поєднанні зі зниженим споживанням вуглеводів. Тут ми перевірили вплив дієти з високим вмістом насичених жирів/низьким вмістом вуглеводів на трансгенній моделі миші AD.
Результати
Починаючи з тримісячного віку, дві групи самок-трансгенних мишей, що мали мутацію APP в Лондоні (APP/V717I), годували або стандартною дієтою (SD), складеною з високим вмістом вуглеводів/низьким вмістом жиру, або кетогенною дієтою (KD ), що складається з чау з дуже низьким вмістом вуглеводів/насичених жирів протягом 43 днів. Тварини, яких годували KD, демонстрували сильно підвищений рівень кетонових тіл у сироватці крові, як вимірювали β-гідроксибутиратом (3,85 ± 2,6 мМ), порівняно з тваринами, що годували SD (0,29 ± 0,06 мМ). Крім того, тварини, яких годували КД, втрачали масу тіла (СД 22,2 ± 0,6 г проти КД 17,5 ± 1,4 г, р = 0,0067). На відміну від попередніх досліджень, короткий режим харчування КД суттєво знизив загальний рівень Aβ у мозку приблизно на 25%. Незважаючи на зміну рівня кетонів, маси тіла та рівня Аβ, дієта КД не змінила поведінкових заходів.
Висновок
Попередні дослідження припускали, що дієти, багаті холестерином та насиченими жирами, збільшували відкладення Аβ та ризик розвитку АД. Тут ми демонструємо, що дієта, багата на насичені жири та з низьким вмістом вуглеводів, насправді може знизити рівень Aβ. Отже, дієтичні стратегії, спрямовані на зниження рівня Аβ, повинні враховувати взаємодію харчових компонентів та результати метаболізму, зокрема, рівні вуглеводів, загальну калорійність та наявність кетонових тіл.
Передумови
Розвиток AD та накопичення Aβ пов'язані з дієтичними факторами. Дієти, багаті на насичені жири, неодноразово брали участь у епідеміологічних дослідженнях [5–8], хоча їх було важко відтворити [9]. Крім того, кілька експериментів на моделях мишей підтверджують зв'язок між дієтами, багатими на ліпіди, та AD. За допомогою трансгенних моделей мишей АД декілька груп повідомили, що дієти з високим вмістом жиру або дієти з додаванням холестерину підвищують рівень та відкладення пептиду Aβ [10–14]. Однак ці дослідження не вивчали вплив дієт, багатих ліпідами, в поєднанні з низьким споживанням вуглеводів.
Відомо, що дієти, що містять дуже низький вміст вуглеводів і високий вміст жиру, викликають печінкову продукцію кетонових тіл (β-гідроксибутират, ацетоацетат та ацетон) і їх часто називають кетогенними дієтами (КД). Кетогенні дієти в деяких аспектах імітують голодування і були розроблені для використання у людей для лікування епілепсії на основі довгих записів спостережень, що голодування зменшує напади (огляд див. [15]). Експериментальний КД обмежений у калоріях і має фіксований склад і, таким чином, відрізняється від дієти з низьким вмістом вуглеводів, що використовується для схуднення, яка зазвичай ad lib і змінний за складом. Незважаючи на ці відмінності, дієти з низьким вмістом вуглеводів також можуть бути ефективними для запобігання судом і можуть працювати за подібними механізмами, як КД [16]. Точний механізм протисудомних властивостей цих дієт досі невідомий. Низький вміст вуглеводів в обох дієтах індукує багато метаболічних змін, які можуть бути захисними, такі як підвищений рівень циркулюючого кетону в організмі, підвищене окислення жирів, зміна білкового обміну та зміни експресії генів [17, 18].
Результати
У цьому дослідженні експериментально перевірено ефекти КД, що складається з надзвичайно низького вмісту вуглеводів і дуже високого вмісту насичених жирів на трансгенній моделі миші з АД. Миші експресують ген APP людини, що містить мутацію APP "Лондон" (APP/V717I), керовану твій-1 промотор гена. Трансгенні миші APP/V717I виробляють значний рівень розчинного Aβ у мозку вже у віці 3 місяців та демонструють значне відкладення нальоту до 12–14 місяців. Тварини демонструють дефіцит поведінки на ранніх стадіях і представляють модель раннього розвитку сімейного АД [19].
Годували шістнадцять самок мишей APP/V717I ad libitum на стандартній дієті (СД), що складається з чау з високим вмістом вуглеводів/низьким вмістом жиру (чау-муракон-G: 35% вуглеводів, 21% білків, 4,5% жиру, 39,5% води, клітковини та золи). Переважною жирною кислотою в Muracon-G є лінолева кислота (18: 2), і вона становить 1,4% ваги чаю. У тримісячному віці половина групи (8 тварин) була переведена на кетогенну дієту (КД), що включала чау з дуже низьким вмістом вуглеводів/жиру, тоді як решта 8 тварин залишалися на СД. В обох випадках тварини мали вільний доступ до чау постійно, і споживання не було експериментально обмеженим. Для KD ми використовували Bio-Serv Inc. F3666 чау: 0,76% вуглеводів, 8% білків, 79% жиру, 12% води, клітковини та золи. F3666 - це кетогенна чау, що складається із свинячого жиру, жирного масла, декстрози, казеїну, клітковини, кукурудзяної олії, мінеральної суміші та вітамінної суміші. F3666 багатий насиченими жирами. Більше 29% чау F3666 складається з насичених жирів за вагою: 2,4% міристинової кислоти (C14: 0), 18,9% пальмітинової кислоти (C16: 0) та 8,4% стеарину (C18: 0) (див. Таблицю 1) . Тварин, яких годували чау F3666, називають групою KD. Мишей, які залишились на чау-муракон-G, називають групою SD.
КД дієта і схуднення
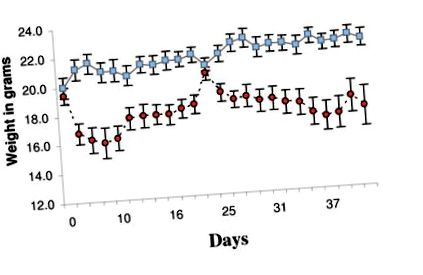
Протягом перших 7 днів багато тварин із групи KD неохоче їли нову чау і втрачали вагу (рис. 1). Для поліпшення споживання та пом'якшення втрати ваги SD чау змішували з KD чау у співвідношенні 1: 3, починаючи з 16 дня до 20 дня. Протягом семи днів, наступних за днем 20, кількість чау SD зменшували до кількох крошок, посипаних KD чау. Після 28-го дня тварин повертали лише в KD chow. Змішана чау відновила вагу тіла групи KD приблизно до рівня групи SD, приблизно до 20 грам (рис. 1). Коли тварин годували виключно KD-чау, вага тіла знову падав, але, як правило, стабілізувався приблизно на 18 грам (рис. 1). На завершення експерименту середні ваги були значно різними (SD 22,2 ± 0,6 г проти KD 17,5 ± 1,4 г, p = 0,0067).
Середня вага в грамах кожної групи під час експерименту. Сині квадрати представляють групу стандартних дієт (СД). Червоні кола представляють групу кетогенної дієти (КД). Смужки помилок представляють стандартну помилку середнього значення. Дні означають час у днях від початку зміни дієти. Тварини на КД схудли. Для пом'якшення втрати ваги та поліпшення годування невелику кількість чау-чаю SD змішували з KD-чау протягом другого тижня, а потім видаляли на третій тиждень, див. Методи.
Дієта KD підвищує рівень β-гідроксибутирату в сироватці крові
Щоб виміряти ефективність чау-індукції для індукції кетогенного стану, щотижня брали проби крові та досліджували рівень β-гідроксибутирату (BHB). Через вісім днів після заміни чау-тварини в групі KD мали значно підвищений рівень BHB порівняно з групою SD (SD 0,26 ± 0,023 мМ проти KD 8,94 + 1,8 мМ, p Рисунок 2
Когнітивне тестування
Через 38 днів на дієті тварин тестували на дефіцит поведінки за допомогою тестів розпізнавання об’єктів, як описано раніше [20], див. Методи. Незважаючи на різницю в чау, рівні BHB та втраті ваги, різниці в поведінкових показниках між групами не виявлено (Таблиця 2).
Рівні Aβ
У віці чотирьох місяців миші APP/V717I не мають Aβ-позитивних бляшок, і весь Aβ присутній у розчинній фракції [19]. Отже, через 43 дні після зміни дієти в обох групах тварин вимірювали рівні розчинного Aβ у мозку. Гомогенат мозку був виділений, як описано раніше [20], див. Методи. По одній півкулі від кожної тварини аналізували рівні Aβ 40 і 42 за допомогою набору високої чутливості ELISA Amyloid Aβ40 або Aβ42 (The Genetics Company, Цюріх, Швейцарія). Було виявлено, що рівні як розчинних Aβ 40, так і 42 є значно нижчими в групі, яка отримує KD (рис. 3). У випадках сімейного БА надлишок Aβ42 виробляється відносно Aβ40, збільшуючи тим самим відношення Aβ 42/40. Ми дослідили відношення A42 до Aβ40 і не виявили різниці між групами (SD 0,51 ± 0,024 проти KD 0,56 ± 0,026, p = 0,2872), припускаючи, що дієта не змінювала місця розщеплення на АРР, а натомість сприяла загальному зниженню Aβ-вид.
Кетогенна дієта знижує Aβ40 і Aβ42. Рівні Aβ як нг/г тканини мозку. Група стандартної дієти (SD) позначена синім кольором, кетогенна дієта (KD) - червоним кольором, смужки похибки - стандартна помилка середнього значення. SD чау Aβ40 1,72 ± 0,12 нг/г проти KD чау Aβ40 1,28 ± 0,09 нг/г, p = 0,012. SD чау Aβ42 0,88 ± 0,05 нг/г проти KD чау Aβ42 0,71 ± 0,0,4 нг/г, p = 0,016.
Загальний рівень білка досліджували, щоб визначити, чи може загальне зниження білка мозку в групі КД пояснити зниження рівня Аβ. Однак рівні білка, виміряні як мг/мл гомогенату мозку, не відрізнялись між двома групами (SD 0,56 ± 0,035 мг/мл проти KD 0,51 ± 0,017 мг/мл, p = 0,213). Оскільки більшість (хоча і не всі) тварин з групи KD втратили вагу, можна було очікувати, що тварини з найбільшою втратою ваги мають найнижчі рівні Aβ. Однак рівні Aβ40 або Aβ42 не корелювали зі зміною ваги у всіх групах (Aβ40 r = 0,16, p = 0,20; Aβ42 r = 0,05, p = 0,49) або лише в групі KD (Aβ40 r
Обговорення
Це дослідження продемонструвало несподіваний результат, що коротке лікування дієтою з низьким вмістом вуглеводів/високим вмістом насичених жирів зменшило загальний рівень Aβ на мишачій моделі хвороби Альцгеймера. Попередні дослідження припускали, що дієти, багаті насиченими жирами або холестерином, збільшують як вироблення, так і відкладення Aβ на мишачих моделях AD, що призводить до припущення, що дієти, багаті ліпідами, є фактором AD [10, 12–14]. Однак ці дієти не були дієтами з низьким вмістом вуглеводів. У дієтах з високим вмістом холестерину холестерин додавали в раціон без зменшення інших компонентів [10, 14]. У дослідженнях дієт з високим вмістом жирів вміст вуглеводів все ще був відносно високим. Наприклад, Хо та ін. використовували дієту з 60% жиру, 20% вуглеводів, 20% білка. Цей раціон був достатньо багатим на вуглеводи, щоб спричинити значне збільшення маси тіла у тварин [11].
Відомо, що взаємодія різних макроелементів, зокрема жирів та вуглеводів, впливає на метаболічний стан тварини. Наприклад, Марсет-Бальєрі та ін. досліджували, чи достатньо жиру в харчуванні, щоб перевести енергетичний баланс у бік накопичення жиру. Проте щурів годували ad libitum дієти з високим вмістом жирів (50%), позбавлені вуглеводів, не збільшували споживання енергії та не набирали ожиріння в організмі, тоді як тварини, що харчувались дієтами з високим вмістом жиру (30%) у присутності вуглеводів (56%), збільшували споживання енергії та набирали жир в організмі [21]. Такі дослідження підтверджують думку, що при одночасному споживанні жиру та вуглеводів вуглеводи стимулюють секрецію інсуліну і тим самим сприяють накопиченню жиру (нещодавній огляд див. [22]). Тому під час вивчення впливу харчових жирів на біологічні процеси важливо враховувати профіль макроелементів раціону.
У цьому дослідженні трансгенних тварин годували ad libitum дієта з дуже високим вмістом жиру (79%), яка була практично позбавлена вуглеводів (0,76%). KD призвів до вироблення кетонового тіла, втрати ваги та зниження рівня Aβ. Отже, дані, представлені тут, дозволяють припустити, що це не жири в раціоні, які підвищують рівень Aβ, а, можливо, рівні загальних калорій, вуглеводів або метаболічного стану тварини.
Це дослідження демонструє, що, всупереч очікуванням, трансгенних мишей годували ab libitum дієта з дуже низьким вмістом вуглеводів/високим вмістом насичених жирів демонструє зниження рівня Аβ лише після 43 днів зміни дієти. Група KD демонструвала низький рівень як Aβ40, так і більш амілоїдного Aβ42, що свідчить про те, що дієта KD не змінювала або підвищувала ефективність місць розщеплення в межах APP. Натомість дані свідчать про режим KD або зменшення обробки APP, або посилення деградації видів Aβ. Більшість тварин, яким вводили кетогенну дієту, втрачали масу тіла, а також виявляли знижений рівень Aβ. Однак зниження рівня Aβ, можливо, не було обумовлено загальним зниженням вмісту білка. Загальний рівень білка в мозку не відрізнявся між групами, а рівень β не корелював із втратою ваги. Цікаво, що, незважаючи на зміну дієти, втрату ваги та рівень β, змін у когнітивних показниках не спостерігалось (табл. 2). Це спостереження погоджується із загальним висновком про те, що дієти з використанням КД не шкідливі для мишей [23]. Крім того, висновок про те, що зниження Aβ не покращило когнітивні показники, може бути зумовлений помірним зниженням рівнів за цих умов і може знадобитися більш тривале лікування.
Дієта KD була розроблена для імітації реакції голоду у тварин без зниження калорій до шкідливого рівня [15]. Таким чином, КД схожий на режими обмеження калорій (CR), які застосовувались у багатьох видів для зміни старіння та підвищення деяких форм стресостійкості. CR зазвичай зменшує калорії на 30–40% порівняно з ad libitum годує тварин і має численні позитивні ефекти на здоров’я тварин [24]. У цьому дослідженні ми не намагалися обмежити калорії будь-яким способом, і тварини мали вільний доступ до кетогенної чау постійно, а споживання було самообмеженим. Однак, оскільки тварини спочатку не бажали їсти KD чау, і ми спостерігали втрату ваги в групі KD, ми не можемо виключити можливість того, що ефекти зниження Aβ були обумовлені CR.
Проте CR та KD можуть працювати за допомогою подібних механізмів. KD добре відомі, що зменшують передачу сигналів інсуліну та імітують голодування, збільшуючи тим самим окислення жирних кислот та сприяючи катаболічному стану [17]. Подібним чином, CR добре відомо, що він знижує рівень інсуліну та IGF у сироватці крові, і більша частина користі від CR може бути результатом цього зменшення сигналізації інсуліну/IGF (огляд див. [25]). Наприклад, зниження інсулінових/IGF-подібних сигналів пригнічує синтез білка і сприяє деградації білка, що може призвести до очищення деградаційно-чутливих білків, таких як амілоїдні пептиди.
Збільшення доказів свідчить про роль інсуліну/IGF-1 у регуляції АРР та модуляції рівня Аβ. Рецептори як для інсуліну, так і для IGF-1 сильно виражені в мозку, особливо в гіпокампі та корі, де вони можуть впливати на навчання та пам'ять [26]. Сигналізація інсуліну в мозку збільшує позаклітинний рівень Aβ, сприяючи секреції [27] та інгібуючи деградацію ферментом, що розкладає інсулін [28]. Ця думка також отримала останнім часом підтримку у людей. Фішель та ін. продемонстрував, що індукована гіперінсулінемія у здорових людей похилого віку підвищує рівні Aβ як у сироватці крові, так і в спинномозковій рідині, припускаючи, що інсулін відіграє важливу роль у підвищенні рівня Aβ, особливо за умов, таких як діабет II типу [29].
Така інтерпретація узгоджується з нещодавніми дослідженнями, що демонструють схожі ефекти на зниження рівня β на низьковуглеводний режим калорійного обмеження (CR) у мишей, що виражають "шведську" форму APP (миші Tg2576). У цих тварин виявлено нижчий рівень Aβ 40 і 42 у тварин, які годували на 30% менше вуглеводів, ніж ad libitum годували тварин. Ефект зниження β, можливо, був зумовлений підвищеною α-секретазою та активністю ферменту, що розщеплює інсулін, у тварин CR [30].
В якості альтернативи, інші фізіологічні зміни можуть знизити рівень Aβ у цьому дослідженні. Високий рівень кетонових тіл, можливо, сприяв збільшенню білкового обігу. Показано, що кетонові тіла, додані до культури клітин, призводять до посиленого окислення білків, схильних до окислювальних пошкоджень. Наявність пошкодженого білка викликає протеоліз нормально довгоживучих білків через опосередковану шапероном аутофагію [31]. Такий механізм може діяти у тварин, яких годують кетогенною чау і піддають впливу високих рівнів кетонових тіл. Деяка підтримка цієї моделі випливає із спостереження, що підвищений рівень кетонового тіла краще корелював із зниженням видів Aβ, ніж втрата ваги. Крім того, кетонові тіла можуть служити ефективним субстратом для обміну нейронів. Попередні дослідження показали, що гостре підвищення кетонових тіл може поліпшити когнітивні показники у деяких осіб з легким та середнім типом АД [32].
Висновок
У міру старіння населення розвиненого світу, як передбачається, рівень захворюваності на АД різко зросте і створить величезне навантаження на послуги охорони здоров'я [2]. Дієтичне втручання є відносно безпечним та легкодоступним методом боротьби з АД. Проте ключові дієтичні зв'язки залишаються незрозумілими. Значна частина попередніх робіт була зосереджена на ролі дієт з високим вмістом жиру або високим рівнем холестерину та їх внеску в розвиток БА. Однак дані свідчать про те, що первинний генетичний фактор ризику пізнього настання АД, алель epsilon4 аполіпопротеїну Е, може бути обраний проти популяцій з тривалим історичним впливом на сільське господарство [33]. Крім того, продукти, багаті вуглеводами, є відносно недавніми доповненнями до раціону людини і, ймовірно, будуть більш еволюційно невідповідними, ніж дієти з високим вмістом жиру [34]. Отже, недавній еволюційний перехід до дієти з високим вмістом вуглеводів (HC) може зіграти важливу роль у розвитку БА. Загальновідомі дієти з HC сприяють стимулюванню передачі інсуліну та призводять до пригнічення ліпідного обміну [22]. Таким чином, такі дієти можуть призвести до невідповідного ліпідного середовища в нейронах, неправильного розщеплення АРР і, як наслідок, інгібування клітинної торгівлі, і в кінцевому рахунку збільшити ризик розвитку БА (для огляду див. [35]).
Методи
Тварини
Збір крові та аналіз
Кров відбирали у знеболених мишей або з очноямкового сплетення, або через пункцію серця. Рівні β-гідроксибутирату вимірювали спектрофотометрично за допомогою набору β-гідроксибутиратів з рідким кольором Stanbio (Stanbio Inc., Boerne, Texas).
Новий тест на розпізнавання об’єктів
- Аналіз спектрів експресії піРНК на безалкогольній жировій хворобі печінки на миші, індукованій
- Керівництво з харчування хвороби Альцгеймера для клініцистів
- Аутоімунна палеодієта (AIP) Цілюще харчування для людей з аутоімунною хворобою
- 10 основних правил, яких ви повинні дотримуватися під час кетогенної дієти! BioKeto
- Дієта аутоімунних захворювань