Закономірності та предиктори схуднення після гастректомії при раку
Джеремі Л. Девіс
1 відділення хірургії, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Люк В. Селбі
1 відділення хірургії, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Джоан Ф. Чоу
2 Відділ біостатистики та епідеміології, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Марк Шаттнер
3 Медичний факультет, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Девід Х. Ілсон
3 Медичний факультет, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Марінела Капану
2 Відділ біостатистики та епідеміології, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Мюррей Ф. Бреннан
1 відділення хірургії, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Даніель Г. Койт
1 відділення хірургії, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Вівіан Е. Сильна
1 відділення хірургії, Меморіальний центр раку Слоун Кеттерінг, Нью-Йорк, Нью-Йорк
Анотація
Передумови
Втрата ваги після шлунково-кишкового тракту для хворих на рак шлунка не була добре охарактеризована. Ми оцінили вплив змінних показників для пацієнта та процедури на післяопераційну втрату ваги після гастректомії на рак.
Методи
Проспективно ведена база даних раку шлунка ідентифікувала пацієнтів, яким проводилася резекція шлунка з приводу раку. Були виділені клінічні та патологічні характеристики, вихідний індекс маси тіла (ІМТ) та післяопераційні ваги. Зміна ваги аналізували за процентною зміною ваги та абсолютними змінами ІМТ. За допомогою моделей випадкових коефіцієнтів було перевірено, чи швидкість зміни ваги з плином часу відрізняється факторами, що цікавлять.
Результати
З 376 послідовних пацієнтів, яким була проведена резекція аденокарциноми шлунка, 55% були чоловіками, середній вік 66 років і середній передопераційний ІМТ 27,1 (діапазон 16,2–45,6). Тотальна резекція шлунка була пов’язана із більшою втратою ваги, ніж субтотальна резекція шлунка через 1 рік (15 проти 6%, рання стадія; 17 проти 7%, пізня стадія). Максимальна зміна ваги спостерігалася через 6–12 місяців після операції і залишалася стабільною або покращувалася через 2 роки. Для пацієнтів на ранніх та пізніх стадіях медіана відсотків втрати ваги через 1 рік була більшою для ІМТ ≥ 30 порівняно з ІМТ 1,2. Після операції на відстежуванні верхніх відділів шлунково-кишкового тракту переваги раннього перорального годування добре відомі, тоді як додаткове харчування часто забезпечується заспокоїти занепокоєння щодо втрати ваги, недоїдання та низької якості життя. 3–5
Наше сучасне розуміння втрати ваги після гастректомії визначається переважно резекцією при виразковій хворобі. Наприклад, у когорті Джонсона 1958 року, менш ніж у 10% пацієнтів проводилася резекція доброякісних або злоякісних пухлин шлунка або стравоходу. 6 Сучасні дослідження азіатських хворих на рак шлунка зосереджувались на впливі післяопераційної втрати ваги, пов’язаної із проведенням ад’ювантної терапії, а також на рецидиви захворювання та виживання. 7,8 Незважаючи на ці повідомлення, наша здатність виявляти пацієнтів із ризиком надмірної післяопераційної втрати ваги та прогнозувати втрату ваги для окремих пацієнтів після гастректомії обмежена.
Метою цього дослідження було описати закономірності схуднення після резекції шлунка при раку шлунка та визначити фактори, характерні для пацієнта та лікування, пов'язані з тривалістю або ступенем втрати ваги. Ми обстежили хворих на ранній стадії раку шлунка, які отримували гастректомію як монотерапію, щоб оцінити вплив операції на втрату ваги. Оскільки передопераційний індекс маси тіла (ІМТ) раніше корелював із післяопераційними ускладненнями, ми також досліджували вплив ІМТ на післяопераційну втрату ваги. 9 Крім того, ми розглянули пацієнтів на пізніх стадіях, які пройшли мультимодальну терапію, щоб вивчити вплив факторів, пов'язаних з лікуванням, на післяопераційну втрату ваги.
МЕТОДИ
Після затвердження комітетом з огляду установи, всі пацієнти, яким проводилась лікувальна гастректомія шлункової аденокарциноми в період з липня 2007 року по липень 2013 року, були ідентифіковані з інспекційної бази даних раку шлунка. Пацієнтів виключали, якщо у них не реєстрували післяопераційну вагу, для паліативних або резекцій R2, проксимальної резекції шлунка та езофагогастректомії, смерті протягом 90 днів або рецидиву захворювання протягом 12 місяців після операції та одночасного раку. Доопераційний зріст та вага, зафіксовані протягом 10 днів після операції, та післяопераційна вага були вилучені з електронної медичної картки. Зміна ваги аналізували за процентною зміною ваги (кілограми) та абсолютною зміною ІМТ.
Усім пацієнтам була проведена резекція шлунка в одному закладі та отримана стандартизована післяопераційна допомога. Усі пацієнти отримували лімфаденектомію D1 або D2. Обсяг гастректомії базувався на розташуванні пухлини та реконструкції відповідно до кількості залишкового шлунка. Реконструкція Roux-en-Y (RY) застосовувалась для тотальної резекції шлунка та субтотальних шлунково-кишкових шляхів, де було видалено понад 50% шлунка; Реконструкція Billroth II (BII), коли було видалено менше 50% шлунка. Пацієнти були класифіковані як такі, що мають ранні стадії (післяопераційні T1/T2, N0, M0) або пізні стадії (післяопераційні T3/T4, N0, M0 або будь-які T, N1-3, M0–1) на основі кінцевої патології відповідно до 7-е видання Американського об'єднаного комітету з питань раку (AJCC), постановочна система. 10 Усі пацієнти отримують післяопераційні дієтичні консультації; дієтичні добавки не передбачаються в рамках звичайної клінічної допомоги.
Статистичний аналіз
Всі аналізи проводились окремо для пацієнтів на ранніх та пізніх стадіях. У групі на ранніх стадіях використовувались багатовимірні моделі випадкових коефіцієнтів із стійкими стандартними помилками та неструктурованою матрицею коваріації для прогнозування середнього відсотка втрати ваги від операції, а найменш квадратні середні значення використовувались для прогнозування відсотків втрати ваги для коваріатів, що цікавили (вік, стать, передопераційний ІМТ, тип операції, велике післяопераційне ускладнення, неоад’ювантна хіміотерапія). 11 Візуальний огляд графіків даних показав квадратичну залежність від часу, отже, багатовимірні моделі включали квадратичний термін між часом та коваріатами, що цікавлять, що підтверджується меншим інформаційним критерієм Акакай для квадратних моделей випадкових коефіцієнтів порівняно з лінійними моделями. Усі моделі були скориговані за віком, статтю та ІМТ. На додаток до багатовимірних методів регресії, для опису зміни ваги від вихідного рівня до 1 місяця (3–6 тижнів), 3 місяців (10–14 тижнів), 6 місяців (5–7 місяців), 12 місяців ( 10–14) та 24 місяці (22–26) після операції.
Індекс маси тіла ІМТ, BII Billroth-II, RY Roux-en-Y
Пухлини найчастіше розташовувались у дистальному відділі шлунка (n = 187, 50%) або тілі (n = 106, 28%). У семи пацієнтів (2%) була аденокарцинома шлунково-стравохідного з’єднання Siewert III, у восьми пацієнтів (2%) були дифузно інфільтруючі пухлини, а у чотирьох пацієнтів (1%) пухлини в залишковому шлунку після попередньої часткової резекції шлунка. Тип Лорена реєстрували як дифузний (n = 122, 32%), кишковий (n = 168, 45%), змішаний (n = 79, 21%) або невідомий (n = 7, 2%). Неад'ювантну хіміотерапію вводили 40% нашої когорти (n = 150), тоді як неоад'ювантна променева терапія була рідкістю (n = 2, 0,5%). Пацієнтам проводили або субтотальну гастректомію з гастроеюностомією BII (субтотальна/BII, n = 142), проміжну гастректомію з гастроеюностомією RY (субтотальна/RY, n = 92), або тотальну гастректомію з езофагоєюностомією RY (загальна/RY, n = 142). Загалом, 23% (85/376) усіх пацієнтів отримували малоінвазивну шлунково-кишкового тракту, і не було різниці у втраті ваги між пацієнтами, які перенесли відкриту резекцію шлунка, і тими, хто переніс малоінвазивну шлунково-мозкову хворобу.
Розподіл післяопераційної патологічної стадії склав: 0 стадію (n = 16, 4%, усі отримували неоад'ювантну хіміотерапію з повною патологічною реакцією), I стадію (n = 153, 41%), II стадію (n = 121, 32% ), III стадія (n = 82, 22%) та IV стадія (n = 4, 1%). Ад'ювантну хіміотерапію вводили 35% (n = 132) пацієнтів; 7% (n = 25) отримували ад'ювантну променеву терапію. Основні ускладнення (ступінь 3 та 4) були зафіксовані у 54 пацієнтів (14%). У меншості пацієнтів були встановлені зонди для ентерального харчування (n = 20, 5%), завжди в контексті післяопераційних ускладнень. 12
Рання стадія хвороби
Пізня стадія хвороби
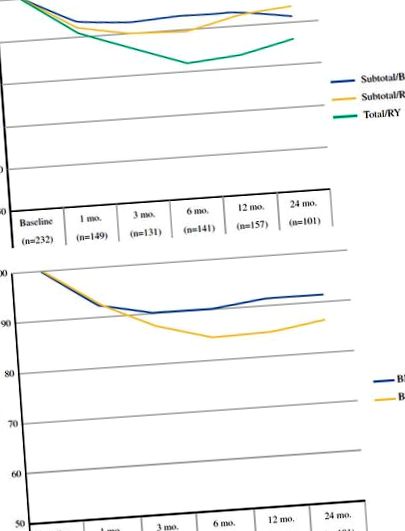
Структури схуднення для 221 пацієнта на пізній стадії були подібними до тих, що спостерігались у пацієнтів на ранніх стадіях. Найнижчий рівень післяопераційної ваги стався через 6 місяців, і вага після цього з’явилася на плато або зросла. Як і очікувалось, у пацієнтів пізньої стадії рівень неоад’ювантної терапії (49 проти 27%) та ад’ювантної хіміотерапії (49 проти 15%) був вищим, ніж у пацієнтів ранньої стадії. Введення неоад'ювантної хіміотерапії асоціювалося із середньою процентною зміною ваги від початкової оцінки до часу операції -1,9% (SD ± 6,4), а ад'ювантна терапія не мала статистично значущого впливу на втрату ваги. Як і у пацієнтів на ранніх стадіях, пацієнти пізньої стадії, яким була проведена тотальна резекція шлунка, досягли найнижчого значення післяопераційної ваги приблизно через 6 місяців (рис. 2б).
Зміна ваги з часом у пацієнтів з пізньою стадією раку шлунка за типом процедури (a) та базовий ІМТ (b). Кількість пацієнтів, які сприяють розрахунку середнього значення втрати ваги в кожен момент часу, наведено в дужках
Розміщення черезшкірних ендоскопічних трубок єюностомії в післяопераційному періоді було нечасто (n = 20, 5%), переважно у пацієнтів на пізніх стадіях (n = 14; 70% усіх розміщень), і завжди в результаті ускладнення що перешкоджало пероральному годуванню. Пацієнтам, яким була проведена тотальна резекція шлунка, післяопераційні пробірки для годування ставили частіше (8%) порівняно з субтотальною шлунково-кишковою шлунково-кишковою системою за будь-якого методу реконструкції (BII, 3%; RY, 4%). Не було зв’язку між розміщенням пробірки для годування та втратою ваги, а також не було різниці ні в передопераційній вазі, ні в ІМТ між пацієнтами, які отримували та не отримували післяопераційні зонди для годування (p = 0,4 та p = 0,06, відповідно). Низький рівень основних ускладнень у пацієнтів на ранніх (n = 20, 13% усіх пацієнтів) та пізніх стадіях (n = 34, 15%) виключав аналіз впливу ускладнень на втрату ваги.
Щоб дослідити вплив надзвичайно низького або високого ІМТ на післяопераційну втрату ваги, ми окремо проаналізували пацієнтів з ІМТ 35. 145 пацієнтів з ІМТ 35 (медіана 37,5). Їм була проведена загальна резекція шлунка (n = 8), проміжний підсумок/RY (n = 7) або проміжний підсумок/BII (n = 12). З 14 пацієнтів на пізній стадії 7 отримували неоад’ювантну хіміотерапію, а 13 пацієнтів мали ранню стадію захворювання. Основні післяопераційні ускладнення мали місце у 5 пацієнтів, а у 2 було встановлено трубку для годування.
ОБГОВОРЕННЯ
Це дослідження пропонує найбільший опис післяопераційної втрати ваги після резекції шлунка при раку шлунка в західному центрі. Втрата ваги найбільша у пацієнтів, яким потрібна тотальна резекція шлунка та найнижчі показники від 6 до 12 місяців після операції для пацієнтів на пізніх стадіях (рис. 2) та 12 та 18 місяців для пацієнтів на ранніх стадіях (рис. 1). Незалежно від процедури, пацієнти з більшим базовим ІМТ втрачають значно більше ваги, ніж пацієнти з нижчим ІМТ, зберігаючи нормальний або надлишковий вагу ІМТ протягом усього.
Пацієнти з ранньою стадією захворювання та ІМТ 13 Приблизно дві третини цих пацієнтів мали ранню стадію захворювання та середній передопераційний ІМТ у нормі.
Випробування Фейна та співавт. порівнював реконструкцію RY з мішком або без нього після загальної резекції шлунка та повідомляв про 15% втрату ваги через 3–6 місяців, яка зберігалася протягом 5 років для всіх пацієнтів. 14 Подібним чином, ми виявили, що пацієнти з раком шлунка на ранній стадії, які перенесли тотальну резекцію шлунка з реконструкцією RY, мали очікувану втрату ваги від вихідного рівня на 12 та 19% через 3 та 6 місяців відповідно. У пацієнтів із пізньою стадією захворювання, які перенесли загальну резекцію шлунка, спостерігалося порівнянне спостерігане зниження ваги через 3 та 6 місяців після операції 13 та 17% відповідно.
Наша практика полягає у введенні обмеженої кількості рідини в рот у перший післяопераційний день, якщо життєві показники та клінічний огляд пацієнта є нормальними. Дієта висувається щодня, і до післяопераційного дня 4 пацієнти можуть споживати дієту після гастректомії. Усі пацієнти перед випискою отримують дієтичні консультації медперсоналу та персоналу харчування. Ми не включаємо дієтичні добавки як частину звичайної клінічної допомоги. Рентгенологічна оцінка анастомозів проводиться за клінічними показаннями. Оскільки звичайне використання зондів для годування не підтверджується перспективними даними та може бути шкідливим, ми розміщуємо їх лише після ускладнення, яке запобігає пероральному годуванню. 4,5,15,16 Після гастректомії стурбованість з приводу післяопераційної втрати ваги та дефіциту харчування є мотивуючими факторами для подальшого вивчення раннього післяопераційного ентерального або парентерального харчування. Наші дані свідчать про те, що ми можемо не тільки передбачити значну післяопераційну втрату ваги на основі запланованої операції та базового ІМТ, але також і те, що рутинне використання зондів для ентерального годування є непотрібним.
Це дослідження обмежене своїм ретроспективним характером та упередженнями, що супроводжують будь-який звіт однієї установи. Ми мали на меті охарактеризувати вплив ступеня резекції шлунка та інших легко вимірюваних змінних показників, пов’язаних із лікуванням, на післяопераційну втрату ваги. Як таке, наше дослідження не намагається співвіднести такі фактори, як втрата ваги, що передує діагностиці, харчові параметри (наприклад, преальбумін) або супутні захворювання, такі як цукровий діабет або тютюнова залежність.
Спостереження передбачуваної та закономірної втрати ваги на основі загальновизнаних факторів додає сили узагальненості наших висновків. Основною силою цих даних є лікування послідовних пацієнтів у сучасну епоху хірургами з послідовною практикою. Втрата ваги після операції чітко залежить від передопераційного ІМТ та ступеня резекції. Більшість пацієнтів відчувають незначну втрату ваги, досягають найнижчого значення між 6 та 18 місяцями після операції (залежно від клінічної стадії та обсягу операції), а згодом стабілізують або збільшують свою вагу. Ці дані дозволять клініцистам виявляти та консультувати пацієнтів із ризиком значної післяопераційної втрати ваги.
Подяки
Автори дякують Маріанні Бенінаті за її досвід та відданість роботі з базою даних раку шлунка.
РОЗКРИТТЯ Це дослідження фінансувалось частково за рахунок гранту підтримки онкологічного центру NIH/NCI P30 CA008748.
- Передвісники втрати ваги в кінці лікування та 1-річне спостереження за поведінковою втратою ваги
- Прогнози вправ на успіх у схудненні проти
- Закономірності та предиктори схуднення після гастректомії при раку - PubMed
- T2D, Втрата ваги, незалежно пов'язана з вищим ризиком раку підшлункової залози AJMC
- Пітер Фачінеллі виявляє схуднення на 30 кг, позбавляючи сорочки від раку простати