Вплив білого рису та білого хліба як основної їжі на мікробіоти кишечника та метаболізм господаря
Пов’язані дані
Анотація
Метою цього дослідження було вивчити вплив двох видів основних японських основних продуктів харчування, білого рису та білого хліба, на мікробіоти кишечника на тлі, коли учасники їдять загальні гарніри. Сім здорових суб'єктів завершили дієтичне втручання двома 1-тижневими періодами тестування з 1-тижневим періодом змиву у перехресному дизайні (реєстрація UMIN UMIN000023142). Білий хліб або білий рис і 21 заморожений готовий гарнір були спожиті протягом періодів випробувань. На початковому етапі та наприкінці кожного періоду збирали зразки крові натще, зразки дихання та зразки калу. Для зразків калу для аналізу мікробіоти кишечника використовували послідовність генів 16S рРНК. Після періоду хліба кількість фекальних видів Bifidobacterium (19,2 ± 14,5 проти 6,2 ± 6,6 (%), p = 0,03), глюкагоноподібний пептид 1 (GLP-1) натще (13,6 ± 2,0 проти 10,5 ± 2,9 ( пг/мл), р = 0,03) та дихання водню (23,4 ± 9,9 проти 8,2 ± 5,5 (проміле), р = 0,02) були значно вищими, ніж у післярізовий період. SCFA плазми також, як правило, був вищим після періоду хліба. Білий хліб містить більше харчових волокон, ніж рафінований короткозернистий рис. Ці результати свідчать про те, що споживання неперетравлюваних вуглеводів з короткозернистого рису як основної їжі може бути меншим, ніж у білого хліба.
1. Вступ
Рис є традиційною основною їжею японської дієти, але споживання рису на душу населення в Японії зменшилось за останні 50 років [1,2]. Тим часом споживання хліба в Японії зросло, і рис і хліб зараз є двома основними основними продуктами харчування, які забезпечують основну частку споживання енергії в Японії [3].
Дієтичний режим вживання рису як основної їжі включає нижчий рівень споживання жиру та насичених жирів та більший рівень споживання харчових волокон у порівнянні з вживанням продуктів із пшеничного борошна як основних продуктів харчування [4]. Попереднє поперечне дослідження показало, що більш високе споживання рису та нижче споживання хліба пов'язані з меншою поширеністю функціональних запорів [5]. Однак залишається незрозумілим, чи обумовлений цей ефект головним чином різницею основних продуктів харчування або дієтичних компонентів, включаючи гарніри.
Приблизно 10% поглинених вуглеводів протистоїть амілазі підшлункової залози та уникає травлення в тонкому кишечнику і залишається основним субстратом для бродіння в товстій кишці [6]. Під час ферментації цих неперетравлюваних вуглеводів мікробіота кишечника виробляє коротколанцюгові жирні кислоти (СКЖК) [7,8]. Згідно з деякими попередніми дослідженнями, SCFA, що виробляються мікробіотою кишечника, пов’язані з метаболізмом ліпідів [9] та метаболізмом глюкози у людей [10,11,12].
У нашій повсякденній їжі гарніри відрізняються від страви до їжі, але основні продукти споживаються неодноразово. Ми висунули гіпотезу, що вживання в їжу неперетравних вуглеводів, отриманих із основних продуктів харчування, впливатиме на метаболізм господаря через склад мікробіоти кишечника. У поточному пілотному дослідженні ми зосереджуємо увагу на різниці основних продуктів харчування та їхньому впливі на склад мікробіоти кишечника та метаболізм глюкози та ліпідів у двоперіодному дизайні кросоверу з використанням комерційного пакету гарнірів.
2. Метод
2.1. Предмети
Для цього дослідження були залучені здорові добровольці з нашого дослідницького відділу (студенти, технічний та науковий персонал). Критеріями включення були такі: (1) ті, хто в даний час не приймав жодних ліків; (2) ті, хто не мав відхилень у фізичному огляді протягом минулого року. Суб'єкти, які мали гарячку, діарею або запалення верхніх дихальних шляхів протягом періоду дослідження, були виключені з аналізу. Протокол (реєстрація UMIN UMIN000023142) був затверджений Вищою школою Університету Кіото та Медичним факультетом, Комітетом з етики. Дослідження проводилось в Університетській лікарні Кіото відповідно до принципів Гельсінкської декларації. Усі випробувані дали письмову інформовану згоду.
2.2. Вивчати дизайн
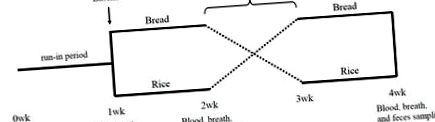
Дослідження було рандомізованим, перехресним дослідженням. Після 1-тижневого періоду обкатування випробовуваних було рандомізовано у співвідношенні 1: 1 на одну з двох послідовностей втручання: Хлібний період із доданими гарнірами протягом 1 тижня, наступний рисовий період із доданими гарнірами протягом 1 тижня або рисовий період з гарнірами, що постачаються протягом 1 тижня, а потім період хліба з гарнірами, що постачаються, протягом 1 тижня (рис. 1). Між двома тестовими періодами був включений 1-тижневий період вимивання. На початковому етапі та в кінці кожного періоду тестування відбирали зразки крові, дихання та калу (рис. 1).
У періоди обкатки та вимивання випробовуваним було наказано уникати вживання пробіотиків, йогурту, олігосахаридів та кисломолочного напою. Під час тестових періодів випробовувані не вживали нічого, крім основних страв (білий хліб або білий рис) та гарніри, що постачаються. Білий хліб та білий рис на ринку готував кожен суб’єкт. Поставлені гарніри представляли собою упаковку заморожених 21 наборів гарнірів (корпорація TOKATSU FOODS, Йокогама, Японія). Випробовувані обирали один набір гарнірів для кожного прийому їжі в тому порядку, який їм сподобався протягом перших 6 днів, але в останній день три набори гарнірів були зафіксовані в обидва періоди. Випробовувані реєстрували кількість хліба або рису, який вони з'їли протягом першого періоду тестування, і вони з'їли еквівалентну енергію рису або хліба у другому періоді тестування. Харчовий вміст хліба та рису розраховували на основі бази даних про харчовий склад, опублікованої Міністерством освіти, культури, спорту, науки та технологій, Японія [13], а харчовий вміст гарнірів забезпечував виробник.
2.3. Оцінка фекальних зразків
Зразки калу збирали випробовувані вдома. Випробовуваним було наказано покласти зразки калу в пробірки та покласти їх у ящики із сухим льодом (-78 ° C) відразу після збору та принести коробки в лабораторію. Зібрані зразки калу зберігали при -80 ° C до аналізу.
Аналіз секвенування генів 16S рРНК структури мікробних спільнот у зразках калу проводили за допомогою MiSeq (Illumina, Сан-Дієго, Каліфорнія, США) в TechnoSuruga Laboratory Co., Ltd. (Сідзуока, Японія) згідно з методикою, описаною раніше [14]. Коротше кажучи, ПЛР-ампліфікацію проводили за допомогою 341F (5′-CCTACGGGAGGCAGCAG-3 ′) [15] та 806R (5′-GGACTACHVGGGTWTCTAAT-3 ′) [16], які були праймерами для посилення області V3 – V4 у бактеріальних 16S. рДНК. На додаток до специфічних областей грунтування V3 – V4, ці праймери доповнювали стандартні прямі та зворотні праймери Illumina. Зворотний праймер також містив послідовність індексування 6 bp (CAGATC, ACTTGA, GATCAG, TAGCTT, GGCTAC, CTTGTA, ATCACG, CGATGT, TTAGGC та TGACCA), щоб забезпечити мультиплексування. Метод ПЦР приземлення для теплового циклічного руху був використаний із системою PCR GeneAmp 9700 (ABI, Фостер-Сіті, Каліфорнія, США). Кожна реакційна суміш ПЛР (25 мкл) містила 20 нг геномної ДНК, 2 × буфер MightyAmp Ver.2 (Takara, Otsu, Японія), 0,25 мкМ кожного праймера та 1,25 одиниці ДНК-полімерази MightyAmp (Takara, Otsu, Японія). Кожну реакцію ПЛР та підготовку пулу ампліконів проводили, як описано раніше [14].
Кожен мультиплексний пул бібліотек отримав 12,5% контролю phiX для поліпшення базового виклику під час секвенування, як рекомендував Illumina для об’єднання двох бібліотек [14]. Секвенування проводили із використанням парного кінця циклу 2 × 281 bp на системі секвенування Illumina MiSeq та хімічного реагенту MiSeq Reagent Kit версії 2 (500 циклів). Виконано парне секціонування з довжиною зчитування 281 bp. Після демультиплексування спостерігалося чітке перекриття зчитування парних кінцівок. Це накладання дозволило з’єднати парні читання разом із програмою fastq-join (http://code.google.com/p/ea-utils/). Метод якісної фільтрації послідовностей був наступним: Для подальшого аналізу були витягнуті лише зчитування, що мали показники якості (QV) ≥20 для понад 99% послідовностей.
Програмне забезпечення Metagenome @ KIN (World Fusion Co., Ltd., Токіо, Японія) було використано для пошуку гомологій із визначеними послідовностями 16S рДНК, проти TechnoSuruga Lab Microbial Identification Databese DB-BA10.0 (TechnoSuruga Laboratory, Co., Ltd ., Токіо, Японія), що містить лише бактерії, що стоять у систематичній номенклатурі [17,18]. Види бактерій були ідентифіковані на основі даних 97-відсоткової межі подібності з DB-BA 10,0 [17,18].
2.4. Вимірювання зразків крові
Зразки крові відбирали після нічного голодування (12 год). В усіх точках зразки крові для вимірювання глюкози в плазмі крові збирали у пробірки, що містять фторид натрію (NaF) та тетраоцтову кислоту етилендіаміну (EDTA); зразки крові на сироватковий інсулін, безсироваткові жирні кислоти (FFA) та тригліцериди сироватки крові (TG) збирали в пробірки, що містять прискорювач згортання крові; і зразки крові для інкретину збирали в пробірки, що містять інгібітор дипептидилпептидази-4 (DPP-4) (BD P800; Бектон Дікінсон, Сан-Хосе, Каліфорнія, США). Ці зразки крові центрифугували (3000 об/хв, 20 хв, 4 ° C), а зібрані зразки плазми та сироватки зберігали при -80 ° C до аналізу. Зразки крові для коротколанцюгових жирних кислот (SCFA) збирали в охолоджені льодом пробірки, що містять EDTA, і негайно центрифугували (3000 об/хв, 10 хв, 4 ° C). Зібрані зразки плазми миттєво заморожували у рідкому азоті та зберігали при -80 ° C до аналізу.
Глюкозу в плазмі крові вимірювали за допомогою спектрофотометрії ультрафіолетового поглинання в SRL, Inc., Токіо, Японія. Інсулін у сироватці крові визначали за допомогою імунного аналізу на хемілюмінесцентні ферменти в SRL, Японія. FFA та тригліцерид сироватки крові визначали за допомогою ферментативних колориметричних наборів та методу гліцерол-3-фосфат-оксидази відповідно у SRL, Японія. Загальний глюкагоноподібний пептид 1 (GLP-1) вимірювали набором аналізів загальної кількості GLP-1 (версія 2) (K150JVC-1; Mesoscale Discovery, Гейтерсбург, штат Медіка, США); загальний глюкозозалежний інсулінотропний поліпептид (GIP) вимірювали людським GIP (загальним) ELISA (EZHGIP-54K; Merck Millipore, Дармштадт, Німеччина). SCFA плазми вимірювали за допомогою рідинної хроматографії у поєднанні з тандемною мас-спектрометрією (LC-MS/MS) в LSI Medience Corporation, Токіо, Японія.
2.5. Аналізи дихання водню
Зразки ендідального дихання збирали в алюмінієві мішки одночасно з забором крові для вимірювання дихання воднем, що є показником бродіння товстої кишки [10,11,19,20,21]. Дихання водню вимірювали за допомогою простого газового хроматографа (Breath Gas Analyzer BGA1000D) в Лабораторії біохімії, що харчується, метаболізмом, Нара, Японія [22,23].
2.6. Статистичний аналіз
Розрахунок обсягу вибірки базувався на стандартизованому розмірі ефекту 2,5 (дихальний водень), оцінений у попередньому дослідженні [10]. Розмір вибірки п’ять був необхідний, щоб забезпечити 80% потужності для виявлення цієї різниці на рівні двобічного значення 0,05.
Усі дані виражаються як середнє із стандартним відхиленням. Порівняння зразків на кінець періодів хліба та на кінець рисових періодів проводили за допомогою парного t-тесту. Проаналізовано двосторонні p 2) 21,0 ± 1,5 (діапазон 18,6–23,1)). Глюкоза в плазмі та інсулін у сироватці крові у всіх пацієнтів знаходились у межах норми (91,2 ± 2,9 мг/дл, 5,2 ± 1,6 мкМЕ/мл, відповідно) (Таблиця 1). П'ять із семи випробовуваних (два чоловіки та три жінки; середній (± SD) вік 36,2 ± 3,9 року та ІМТ (кг/м 2) 20,4 ± 1,3) аналізували на вміст SCFA у плазмі крові, водневий подих та мікробіоти кишечника.
Таблиця 1
Характеристика суб'єктів на вихідному рівні.
- Білий хліб проти білого рису - Вирок вийшов; Чіткий фітнес
- Дієта діабету 2 типу Коричневий хліб проти білого - ось найкращий хліб для діабетиків для зниження крові
- Ствердження, що гостра їжа збільшує метаболізм - The New York Times
- Вплив чорносливу на випорожнення стільця, час транзиту кишечника та шлунково-кишкову мікробіоти А рандомізовано
- Що; s Найздоровіший рис по коричневому, білому, дикому рису та ін