Миші, у яких відсутні рецептори GPR3, проявляють пізній фенотип ожиріння через порушення термогенної функції в коричневій жировій тканині
Предмети
Анотація
Ми повідомляємо про несподіваний зв’язок між старінням, термогенезом та збільшенням маси тіла через рецептор, зв’язаний з білком-сиротою G GPR3. Миші, яким бракувало GPR3 і які підтримували нормальний чау, мали однакову масу тіла протягом перших 5 місяців життя, але після цього набрали значно більшу вагу і виявили зменшені загальні витрати енергії та нижчу температуру тіла. У віці до 5 місяців миші GPR3 KO вже мали нижчу термогенну експресію гена та рівень білка 1, що роз'єднував, і демонстрували порушення всмоктування глюкози в міжлопаткову коричневу жирову тканину (iBAT) щодо мешканців WT. Ці молекулярні відхилення в iBAT мишей GPR3 KO передували вимірюваній різниці у масі тіла та температурі тіла в умовах навколишнього середовища, але були пов'язані з нездатністю підтримувати тепловий гомеостаз під час гострого холоду. У той же час той самий холодний виклик спричинив 17-кратне збільшення експресії Gpr3 у iBAT мишей WT. Таким чином, GPR3, як видається, відіграє ключову роль у термогенній реакції iBAT і може представляти нову терапевтичну мішень при віковому ожирінні.
Вступ
Ожиріння становить головне глобальне навантаження на охорону здоров'я, яке більше не обмежується розвиненими країнами. Недавній звіт підрахував, що майже третина молодих людей та дорослих у всьому світі мають надлишкову вагу або страждають ожирінням 1, і, за прогнозами, ця частка буде зростати внаслідок старіння суспільства 2,3,4,5,6. До 2050 року кількість дорослих американців у віці 65 років і старше, як очікується, зросте більш ніж удвічі - з 40,2 млн. До 88,5 млн. 7 .
Незважаючи на загальний значний прогрес у розумінні біоенергетичних шляхів, питання про те, чому старіння схильна до збільшення ваги, залишається неадекватним. Ожиріння у дорослих або пізній початок спостерігалося у мишей, у яких відсутній фактор активації тромбоцитів 8, аденилілциклаза типу 3, рецептор інсуліну в коричневій жировій тканині 10, у трансгенних мишей гена людського реніну 11 або експериментально індукований у молодих самок щурів 12 . Віковий приріст ваги постійно асоціюється з порушенням термогенезу через запрограмовану втрату функції міжлопаткової коричневої жирової тканини (iBAT) 8,13,14, що переносить надлишок енергії у вісцеральні та підшкірні жирові депо для зберігання 12,14,15 . Проте вікові фактори, що контролюють функцію iBAT, залишаються в основному невідомими.
GPR3 є членом-сиротою класу A надсімейства G-білкового рецептора (GPCR), гомологом кластеру, що включає GPR6 та GPR12, природні ліганди яких досі невідомі 16,17,18,19,20. Нещодавно синтетична мала молекула була визначена як специфічний сурогатний агоніст GPR3 людини 21,22. GPR3 сильно експресується в ооцитах, де його пов’язують із підтриманням мейотичного арешту ооцитів 23,24,25,26,27,28,29,30 та недостатністю яєчників 31,32,33. GPR3 також сильно експресується в областях мозку, причетних до нейродегенеративних захворювань 34,35. Можлива роль GPR3 у метаболічних та старіючих ефектах, особливо щодо збільшення ваги, не вивчалась. Наш інтерес до GPR3 спочатку був обумовлений його гомологією послідовності з двома існуючими канабіноїдними рецепторами 36, що зробило його потенційним кандидатом у наших пошуках ще невстановленого третього канабіноїдного рецептора. Однак ми були здивовані виявленням нового і несподіваного фенотипу, який створив новий напрямок для нашого дослідження. Тут ми повідомляємо про несподіваний зв’язок між старінням та ожирінням через GPR3. Миші, у яких відсутній GPR3, виявляють ожиріння пізнього початку, пов’язане зі зменшенням рівня роз’єднання білка 1 білка в iBAT та термогенезі.
Результати
Миші старшого покоління Gpr3 KO мають фенотип ожиріння
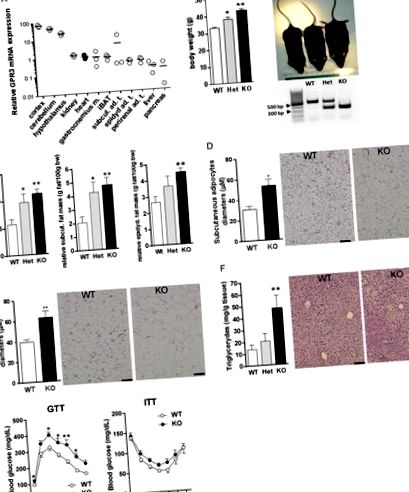
Gpr3 експресується в декількох метаболічно активних периферичних тканинах, хоча на нижчих рівнях, ніж у центральній нервовій системі (ЦНС) (рис. 1А), і його часткова або повна делеція призводить до специфічних для генотипу змін маси тіла людей старшого віку (12 місяців ) миші (рис. 1Б). Таким чином, протягом одного року гетерозиготні (Het) та нокаутуючі (KO) миші GPR3, що підтримувались на регулярній миші, отримували в середньому
На 30% більше ваги відповідно, ніж їх однолітки з диким типом (WT), і візуально їх можна було відрізнити один від одного (рис. 1Б). Відмінності у масі тіла серед 12-місячних жінок GPR3 WT, Het та KO також були значними, але менш помітними, ніж у чоловіків (27,31 ± 1,14 г, 27,39 ± 0,83 г та 30,93 ± 1,04 г, відповідно; P Рисунок 1
Відмінності фенотипів серед мишей GPR3.
Показники ожиріння у старих самців мишей GPR3 Het та KO зросли в 1,7 ± 0,3 рази та 2,0 ± 0,1 рази відповідно у порівнянні з однолітками WT (рис. 1С). Найбільш помітні відмінності спостерігались у підшкірних (рис. 1D) та епідидимальних (рис. 1E) жирових складах, на які припадала більша частина ожиріння та збільшення ваги. За погодженням з появою на гістологічних зрізах, підшкірні та епідидимальні адипоцити були помітно більшими у 12-місячних мишей GPR3 KO, ніж у вікових однокласників WT (рис. 1C). Фарбування гематоксиліном та еозином (H&E) печінкових зрізів у старих мишей GPR3 KO виявило накопичення крапель жиру, що було паралельно помітному збільшенню вмісту печінкових тригліцеридів (рис. 1C). Дивно, але видалення GPR3 не вплинуло на метаболічні маркери сироватки у 12-місячних мишей, що не голодували. Визначним винятком був лептин, висока концентрація якого у мишей GPR3 KO безпосередньо корелювала із підвищеним ожирінням (табл. 1). Крім того, після нічного голодування концентрація глюкози в крові у старих мишей GPR3 KO була значно вищою, ніж у їх одноліток WT, а GPR3 KO продемонструвала помітне порушення толерантності до глюкози (GTT; рис. 1G, ліва панель), що відображається вищим Значення AUC, ніж у аналогів WT (353,63 ± 34,02 та 248,02 ± 11,64 години х мг/дл, відповідно, P Таблиця 1 Маркери метаболізму в сироватці крові та концентрація глюкози в цільній крові у 12-місячних мишей.
Миші старшого віку GPR3 KO зменшили загальні витрати енергії
Непряма калориметрія виявила помітне і стійке зменшення загальних витрат енергії у старих мишей GPR3 KO (TEE; рис. 2А) без істотної зміни їх коефіцієнта дихання (RQ; рис. 2B). Зниження ТЕЕ було пов’язане із супутніми падіннями споживання кисню та виробництва вуглекислого газу в групі GPR3 KO (Рисунок S1). Споживання їжі також було меншим у мишей GPR3 KO, ніж у їх одноліток (рис. 2C), тоді як, що важливо, амбулаторна активність залишалася однаковою між генотипами (рис. 2D). Ці метаболічні відмінності були подібними протягом світлової та темної фаз (рис. 2, права панель) і гармоніюють із фенотипом ожиріння.
Метаболічні профілі старших мишей GPR3, як аналізували за допомогою непрямої калориметрії.
Миші GPR3 KO мають фенотип ожиріння із пізнім початком ожиріння
Для вивчення часової динаміки фенотипу GPR3 KO ми проводили моніторинг маси тіла стандартних мишей, яких годували чау, протягом 18 місяців. Як показано на рис. 3А, маса тіла не відрізнялася між мишами WT та GPR3 KO протягом перших 5 місяців життя, але миші GPR3 KO після цього набрали значно більшу вагу. У віці 5 місяців обидві групи мали однакові значення TEE, RQ, споживання їжі та амбулаторної активності (рис. 3B – E). Вони також мали подібний вміст тригліцеридів у калі (рис. S2), що свідчить про порівнянні здатності кишкової абсорбції. У міру подальшого прогресу тварин миші GPR3 KO почали набирати значно більшу вагу. Для того, щоб краще зрозуміти, чому у мишей GPR3 KO розвивається ожиріння в подальшому житті, ми провели додаткові дослідження на 5-місячних (дорослих) тварин, оскільки це був останній момент часу до того, як фенотип ожиріння став очевидним.
Миші GPR3 KO мають пізній фенотип ожиріння із незмінним метаболічним профілем до повноліття.
Дорослі миші GPR3 KO мають порушення всмоктування глюкози в iBAT
Спочатку ми провели експерименти з гіперінсулінемічними еуглікемічними затискачами, щоб вивчити тканинно-специфічні відмінності в поглинанні глюкози у 5-місячних мишей. У цьому віці тварини WT та GPR3 KO все ще мали однакову масу тіла (31,55 ± 1,02 г та 31,06 ± 1,15 г відповідно; n = 6–7). Базальний рівень глюкози в крові до затискача (рис. 4А), швидкість інфузії глюкози (ГІР) та рівень глюкози в крові під час затискання (рис. 4А – В), кліренс глюкози у всьому тілі (Rd; рис. 4С) та індуковане придушення вироблення печінкової глюкози (hGP; рис. 4D) також були подібними між дорослими генотипами GPR3. Проте існували деякі помітні відмінності між мишами WT та GPR3 KO у поглинанні глюкози в окремих тканинах (рис. 4Е). Особливо заслуговує на увагу в 2 рази менший рівень поглинання глюкози в iBAT мишей GPR3 KO порівняно з їх аналогами з WT. На відміну від цього, поглинання глюкози було значно вищим у жировій тканині епідидиму мишей GPR3 KO, в той час як воно залишалося однаковим між групами в підшкірному та периренальному жирових депо, м’язах печінки та шлунково-кишкового тракту та в гіпоталамусі (рис. 4Е).
Контроль глікемії у дорослих мишей GPR3.
Молекулярні зміни iBAT у дорослих мишей GPR3 KO передують зниженню температури ядра тіла у старших мишей
Ми не спостерігали суттєвих відмінностей у температурі ядра тіла протягом перших 5 місяців життя, хоча температура тіла, як правило, знижувалася швидше з часом у GPR3 KO, ніж у мишей WT. На той час, коли тварини досягли 12-місячного віку, температура тіла була значно нижчою у GPR3 KO, ніж у мишей WT, і вона залишалася нижчою через 6 місяців (рис. 5А). Це супроводжувалося зниженням рівня норадреналіну iBAT та зниженням тироксину в сироватці крові (Т4), але не концентрацією трийодтироніну (Т3) та тиреотропного гормону (ТТГ) у 12-місячних мишей GPR3 KO (рис. S3). Зниження рівня експресії гена Gpr3 було також помітним у 12-місячних мишей WT (рис. 5B).
Термогенні особливості дорослих мишей GPR3.
У віці 5 місяців у мишей GPR3 KO та WT були порівнянні рівні норадреналіну в тканині та концентрації T3, T4 та TSH у сироватці крові (рис. S3). Тим не менш, незважаючи на нормальну температуру тіла в стані спокою, iBAT у дорослих мишей GPR3 KO вже демонстрував деякі молекулярні зміни, які гармонізували та передбачали втрату термогенної функції в більш пізньому віці. Миші, у яких відсутній GPR3, мали значно нижчу базальну експресію роз’єднуючого білка 1 (UCP1), активованого проліфератором пероксисоми рецептора γ-коактиватора 1 альфа (PGC1α) та йодтироніндейодинази типу 2 (Dio2), без змін у генах, що кодують адренергічні рецептори, транспортери глюкози, синтази жирних кислот або десатурази стеароїл-КоА (рис. 5С). Як засвідчує Вестерн-блот, iBAT у мишей GPR3 KO також мав помітно знижений вміст UCP1 без різниці в рівні білка субодиниці II цитохрому с оксидази (MTCO2). Це спостереження було підтверджено їх нижчою інтенсивністю мічення флуоресценції UCP1 на ділянках iBAT (рис. 5D).
Для того, щоб перевірити, чи зниження білка UCP1 у iBAT мало фізіологічний вплив на дорослих мишей GPR3 KO, ми тимчасово помістили їх у холодне середовище (4 ˚C) та дослідили здатність захищати їх основну температуру тіла після гострого впливу холоду. Як показано на рис. 5Е, миші WT змогли успішно підтримувати свою фізіологічну температуру в холодних камерах протягом експерименту. На противагу цьому, незважаючи на нормальну температуру серцевини тіла в умовах навколишнього середовища, порівнянний рівень iBAT норадреналіну та сироваткові маркери функції щитовидної залози між групами під час впливу холоду (рис. S4), 5-місячні миші GPR3 KO виявляли порушення толерантності до холоду, що проявилось поступовим зниженням їх основних температур тіла під час холодної боротьби. Наприкінці холодного сеансу температура тіла у мишей GPR3 KO була нижчою в середньому на 0,9 ° C, ніж у групі WT, тоді як температура тіла дорослих мишей GPR3 KO негайно повернулася до рівня попередньої експозиції, як тільки тварин перевели на свій домашні клітини в умовах навколишнього середовища (рис. 5D).
Гострий вплив холоду сильно вплинув на GPR3 Експресія мРНК у iBAT мишей WT, яка зросла в 17 разів відносно рівня в умовах навколишнього середовища (рис. 5Е). На противагу цьому вираз Gpr6 і Gpr12 залишався незмінним (рис. S5), тоді як зміни в інших генах, що представляли інтерес, під час застуди були досить скромними і проходили за однаковою схемою в обох групах. Помітним винятком було більш високе, можливо компенсаційне збільшення Діо2 експресія гена в GPR3 KO щодо експресії у мишей WT (Фігура S6).
Вищезазначені результати вказують на те, що 5-місячні миші GPR3 KO, підтримуючи нормальну температуру тіла в оточуючих умовах, порушують свою здатність захищати тепловий гомеостаз під час холодної дії.
Обговорення
Старіння було нерозривно пов'язане із метаболічними змінами, які схиляють людину до ожиріння та пов'язаних з ним патологій. Незважаючи на перекриття сигнальних шляхів, фактори, що пов'язують старіння із ожирінням, залишаються в основному невідомими.
У цьому дослідженні ми досліджували ефекти абляції GPR3-абляції на енергетичний обмін мишей. Цей рецептор раніше був причетний до передчасного старіння яєчників 31,32,33 та нейродегенеративних розладів 34,35, що є віковою патологією. Тут ми вперше повідомляємо, що миші-самці, у яких відсутній GPR3, виявляють ожиріння пізнього періоду, коли підтримують їх на регулярній дієті чау. Вага тіла та метаболічні профілі не відрізнялися серед чоловічих груп GPR3 KO та WT протягом перших 5 місяців життя, після чого маса тіла систематично зростала і специфічно для генотипу, так що до віку 12 місяців миші GPR3 KO були значно важче, ніж їхні односмітники, через значно вищий показник ожиріння та пов’язаний із порушенням термогенезу. Ефект дозування гена виявився також у проміжному фенотипі гетерозиготних тварин. Самки мишей GPR3 KO набирали значно меншу вагу, ніж самці, що вказує на те, що передчасне старіння яєчників навряд чи буде відповідальним за фенотип ожиріння і, якщо що, може насправді обмежити експресію цього фенотипу у самок мишей.
Незважаючи на надмірну вагу, метаболічний профіль 12-місячних мишей GPR3 KO не виявляв класичних системних особливостей метаболічного синдрому. Абляція GPR3 не спричиняла системної гіперглікемії, гіперінсулінемії, дисліпідемії, пошкодження печінки або зміни основних метаболічних маркерів в умовах не натощак. Як відображають тести GTT та ITT, 12-місячні миші GPR3 KO не переносили глюкозу, але залишалися чутливими до інсуліну, сумісними зі станом нижчого використання енергії.
На закінчення, як узагальнено на рис. 6, ці висновки встановлюють зв'язок між віковими змінами термогенезу та збільшенням ваги через рецептор-сирота GPR3. Миші, у яких відсутній GPR3, виявляли пізній фенотип ожиріння через порушення термогенної функції iBAT. Отже, GPR3 може служити новою фармакологічною мішенню при розробці відповідного терапевтичного втручання для лікування ожиріння у людей, що старіють.
Короткий зміст змін фенотипу у мишей з дефіцитом GPR3.
- Нова функція мишей із дефіцитом старого ферменту NEP розвиває ожиріння пізнього початку
- Структурні та функціональні зміни в нирках американських мишей із ожирінням, що спричинені дієтою
- PRIME PubMed Kefir запобігає накопиченню зайвого жиру у мишей із ожирінням, спричинених дієтою
- Передопераційна ендоскопія верхніх відділів шлунково-кишкового тракту у пацієнтів із ожирінням, які перенесли баріатричну операцію
- Ознаки ожиріння морських свинок