Клінічна харчова гіперчутливість: значущість Е-позитивних клітин імуноглобуліну дванадцятипалої кишки
Анотація
Через низьку надійність лабораторних досліджень діагностика харчової алергії базується на клінічній реакції на подвійну сліпу плацебо-контрольовану харчову проблему. Метою цього дослідження було оцінити значення IgE-позитивних клітин дванадцятипалої кишки в діагностиці харчової алергії. Тридцять одній дитині з історією можливої харчової алергії пройшли біопсію дванадцятипалої кишки, шкірні проби та вимірювання антитіл до IgE у сироватці крові, і їх посадили на елімінаційну дієту з подальшим харчовим втручанням. Відкриті харчові випробування проводились у пацієнтів віком до 12 місяців, а подвійні сліпі плацебо-контрольовані випробування стосувались підозр на їжу. На підставі клінічної харчової гіперчутливості пацієнтів розділили на дві групи. Група 1 складалася з 13 дітей з харчовою алергією. Тринадцять із 20 позитивних провокацій викликали реакції протягом 12 годин після закінчення виклику, сім пізніше. Група 2 була контрольною групою і включала 18 пацієнтів з негативними харчовими проблемами. Кількість IgE-позитивних клітин у зразках біопсії було значно більшим у групі 1 по відношенню до групи 2 (153,24 ± 83,13 проти 18,4 ± 18,9; стор
Елімінаційна дієта з подвійною сліпою плацебо-контрольованою харчовою проблемою вважається золотим стандартом для діагностики харчової алергії у немовлят та дітей (1). Негайні реакції після їжі можна легко визначити, тоді як уповільнені реакції важко розпізнати (2). Тому необхідні неклінічні критерії для діагностики харчової алергії. Серед запропонованих діагностичних тестів, SPT та вимірювання сироваткових антитіл IgE до харчових продуктів зазвичай проводять у дітей із підозрою на харчову алергію. Однак ці тести слід розглядати як лише свідчення про харчову алергію (3,4).
IgE-позитивні клітини були продемонстровані в слизовій оболонці кишечника за допомогою імуноелектронної мікроскопії (5). Однак повідомлялося про суперечливі результати щодо присутності IgE-вмісних клітин у слизовій оболонці тонкої кишки та про їх відношення до сироватково-специфічних антитіл IgE у неконтрольованих дослідженнях у пацієнтів з харчовою алергією (6–11). Поки що відсутні порівняльні дані щодо діагностичної точності SPT для харчових продуктів проти позитивні клітини IgE в слизовій оболонці кишечника, а також на кореляцію між клітинами, що містять IgE дванадцятипалої кишки, і загальним рівнем IgE в сироватці крові.
Тому нас цікавило, по-перше, чітке встановлення значення IgE-позитивних клітин дванадцятипалої кишки в діагностиці харчової алергії у дітей, а по-друге, порівняння знахідки клітин, що містять IgE-клітини слизової оболонки дванадцятипалої кишки, з результатами SPT та рівнями IgE у сироватці крові.
МЕТОДИ
Пацієнти. Тридцять одна дитина з симптомами в анамнезі, які можуть бути спричинені харчовою алергією, були послідовно залучені до дослідження. Скарги викликали блювоту у 24 випадках, екзему у 14, діарею у 5, біль у животі у 3, астму у 2, кропив’янку у 2, ангіоневротичний набряк у 1, відсутність процвітання у 1.
Всім дітям була проведена ендоскопія верхніх відділів кишечника (Olympus GIF-XP 20) перед початком елімінаційної дієти. Дуоденальна біопсія проводилася у всіх дітей. Дітей досліджували, маючи симптоми або протягом 24 годин з моменту останньої появи клінічних ознак алергії. Імунологічні дослідження були проведені у всіх пацієнтів.
Відповідно до наявності або відсутності клінічних реакцій на пероральний прийом їжі, дітей включали відповідно до пацієнта з алергією на їжу або до контрольної групи. У групу пацієнтів з харчовою алергією входило 13 дітей (8 хлопчиків та 5 дівчаток; віковий діапазон від 2 місяців до 4 років, середній показник 15 ± 13 місяців) з позитивною їжею (див. Таблицю 1). Тринадцять із 20 позитивних тестів на провокацію викликали реакції протягом 12 годин після закінчення виклику. Ці ранні реактори мали такі симптоми: блювота у 8 випадках, кропив’янка у 5, висип у 5, ангіоневротичний набряк у 4, діарея у 4, екзема у 1, астма у 1, риніт у 1. Сім поодиноких уповільнених реакцій, які почали більше 12 h після виклику: екзема у 6 випадків та діарея у 1. У двох дітей були ранні реакції, а потім розвинулися уповільнені симптоми: екзема у 2 випадках та діарея у 1. У 11 дітей виявлено алергію на коров'яче молоко, 5 на яйце, 3 до пшениці та 1 до баранини.
Контрольну групу складали 18 пацієнтів (12 хлопчиків та 6 дівчаток; віковий діапазон від 5 місяців до 10 років, у середньому 44 ± 41 місяці), у яких не було харчової алергії (негативні результати перорального прийому їжі). Вік контрольної групи був значно вищим, ніж вік групи пацієнтів (стор Тест 2 із корекцією безперервності Йейтса був використаний для порівняння відмінностей у відсотках харчових алергіків та контрольних дітей, які мали підвищений загальний рівень IgE у сироватці крові. Кореляції досліджувались лінійно-регресійним аналізом та коефіцієнтом рангової кореляції Спірмена (рS).
РЕЗУЛЬТАТИ
Імунологічні дослідження. Середні логарифмічні загальні рівні IgE у сироватці крові у дітей, що страждають алергією на їжу (2,12 ± 0,62), були значно підвищені порівняно з показниками контрольної групи (1,44 ± 0,23) (стор Таблиця 2 Чутливість, специфічність та позитивна та негативна точність прогнозування кількості клітин, що містять IgE дванадцятипалої кишки, загального сироваткового IgE, SPT та специфічних антитіл IgE до двох харчових антигенів, найбільш часто асоційованих з харчовою гіперчутливістю
Не виявлено суттєвої різниці між результатами SPT та алерген-специфічними сироватковими антитілами IgE при виявленні дітей з алергією на яйце або коров’яче молоко. Крім того, не виявлено суттєвих відмінностей між загальним рівнем IgE у сироватці крові та результатами SPT, або харчовими специфічними антитілами IgE, або SPT-позитивними харчовими специфічними антитілами IgE при виявленні алергічних суб'єктів. Позитивні реакції SPT та RAST не були пов'язані з часом появи симптомів.
Пацієнти 3 та 11 (табл. 1), які мали лише атопічний дерматит після перенесеного захворювання, проходили спостереження в амбулаторії, щоб отримати підтвердження позитивного виклику коров’ячого молока. Під час однорічного спостереження на дієті без коров’ячого молока не було екзематозних уражень.
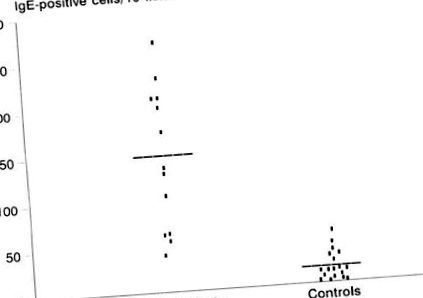
IgE-містять клітини слизової оболонки дванадцятипалої кишки. Розподіл кількості IgE-позитивних клітин у зразках біопсії у дітей, що страждають алергією на їжу (153,24 ± 83,13), був значно підвищений порівняно з контрольною групою (18,4 ± 18,90) (стор Фігура 1
Значення чутливості, специфічності та позитивної та негативної точності прогнозування, розраховані для кількості клітин, що містять IgE дванадцятипалої кишки, та загального рівня IgE у сироватці крові для клінічної гіперчутливості до принаймні однієї їжі наведені в таблиці 3. Загалом, діагностична точність IgE- містять клітини був високим. Однак не було значної різниці між кількістю IgE-вмісних клітин та загальним рівнем IgE у сироватці крові при виявленні дітей з харчовою алергією.
Серед 12 дітей з алергією на їжу з підвищеною кількістю дванадцятипалої кишки IgE-позитивних клітин двоє мали негативні SPT та специфічні IgE антитіла до продуктів харчування, що порушують, а в одного з них рівень IgE в сироватці крові був нормальним. В обох дітей були поодинокі затримки клінічних реакцій після харчових проблем (табл.
Встановлено, що кількість дуоденальних IgE-вмісних клітин у дітей з клінічними реакціями на коров'яче молоко має високу, але не абсолютну діагностичну точність. Чутливість та негативна точність прогнозування IgE-позитивних клітин дванадцятипалої кишки у дітей з клінічною гіперчутливістю до яйцеклітини були високими, але позитивна точність та специфічність прогнозування були низькими (табл. 2). Не виявлено суттєвої різниці між кількістю IgE-вмісних клітин та результатами SPT, або харчових специфічних сироваткових антитіл IgE, або SPT-позитивних алерген-специфічних антитіл IgE або сироваткових рівнів IgE у виявленні дітей з клінічною гіперчутливістю до коров’ячого молока та яйце.
У дітей з харчовою алергією в слизовій оболонці дванадцятипалої кишки спостерігалася помітна запальна клітинна інфільтрація, яка включає лімфоцити, переважно плазматичні клітини, поліморфи та деякі еозинофіли. Кількість тучних клітин становила 3,6 на 10 полів зору. У контрольній групі тучні клітини практично відсутні, а інфільтрат бідний. IgE-позитивні клітини вважали головним чином мононуклеарними клітинами. Більшість з них були визнані плазматичними клітинами; тучні клітини представляли 2,3% IgE-позитивних клітин.
ОБГОВОРЕННЯ
Результати цього дослідження показали, що IgE-позитивні клітини слизової оболонки дванадцятипалої кишки значно збільшуються у дітей з харчовою алергією. Ці висновки узгоджуються з попередніми звітами, що описували асоціацію клітин, що містять IgE, дванадцятипалої кишки з алергією на коров’яче молоко (7–9). Неконтрольовані фінські дослідження (6,10,11) виявили різні результати щодо IgE-позитивних клітин на місці слизової оболонки кишечника. Однак порівняти наші результати з їх результатами непросто через різну конструкцію експерименту та використовувані імуногістохімічні методи та через відсутність специфічності антисироватки, особливо до 1980 р. (18). Ці відмінності можуть також пояснити наше спостереження за IgE-позитивними клітинами, які є переважно плазматичними клітинами. Цей висновок відповідає деяким попереднім дослідженням (5,8), але суперечить результатам інших (19), які показали переважно тучні клітини.
Крім того, наші дані показують, що чутливість, специфічність та прогнозні показники дуоденальних IgE-позитивних клітин подібні до показників SPT та специфічних сироваткових антитіл IgE до продуктів харчування. Діагностична точність SPT та специфічних сироваткових антитіл IgE до коров'ячого молока та яєць була порівнянна з тією, що повідомлялась у попередніх дослідженнях (3,4). Вимірювання IgE-позитивних клітин слизової оболонки дванадцятипалої кишки не дало жодної діагностичної переваги над загальним IgE в сироватці крові при прогнозуванні клінічної харчової алергії. Оскільки поширеність харчової алергії в нашій популяції була вищою, ніж серед загальної популяції (20), нормальну кількість клітин, що містять IgE, слід вважати корисними для виключення клінічної харчової гіперчутливості. Збільшення кількості імунореактивних клітин IgE слід розглядати лише як підказку щодо реакції на продукти харчування (21).
Шрандер та ін. (8) визначив у 16 дітей з непереносимістю коров’ячого молока діагностичне значення IgE-позитивних клітин слизової оболонки дванадцятипалої кишки, забарвлених методом імунопероксидази, та специфічних антитіл IgE до сироватки порівняно з коровим молоком. Специфічність та позитивна точність прогнозування кількості IgE-позитивних клітин були порівнянні з нашими, але чутливість була нижчою. Однак ці автори не описували, як проводили харчові випробування та які симптоми викликали. Вони провели якісну, а не кількісну оцінку імуногістохімічних фарбувань. СПТ не вивчались.
У дітей із затримкою клінічних реакцій на продукти харчування імунологічні тести не мають діагностичного значення (22, 23). Цікаво, що ми виявили, що реактори із затримкою мали значно підвищену кількість IgE-позитивних клітин слизової оболонки дванадцятипалої кишки, навіть за відсутності підвищених загальних рівнів IgE у сироватці крові, специфічних антитіл до IgE у сироватці крові або позитивного SPT до їжі-порушника. Таким чином, наші висновки свідчать про те, що IgE-опосередкованими є не тільки реакції гострого початку, але й реакції, що виникають із затримкою, що виникають принаймні через 12 годин після впливу їжі (24). Однак діагностичне значення цього спостереження потребує подальшого уточнення.
У деяких реакторах із затримкою симптоми не можуть бути легко пов'язані з повторним введенням їжі через тривале відставання або різний перебіг захворювання. Тому ми спостерігали за пацієнтами 3 та 11 (табл. 1), щоб підтвердити позитивний виклик коров’ячому молоку. Під час 1-річного спостереження у дітей, які отримували дієту без коров’ячого молока, не спостерігалося екзематозних уражень.
У нашій досліджуваній популяції діти з харчовою алергією були значно молодшими, ніж діти контрольної групи. Це узгоджується з дослідженнями (25, 26), які повідомляли про більшу поширеність побічних реакцій на їжу у грудному віці та ранньому дитинстві. Загальний рівень IgE у сироватці крові зростає протягом дитинства (17), але було встановлено, що він нижчий у контрольній групі. Тому ми вважаємо, що різний вік двох груп не впливав на наші результати.
Попередні дослідження пропонували підтвердження пошкодження слизової оболонки кишечника у деяких пацієнтів з харчовою алергією шляхом документування 1) незначні морфологічні зміни слизової оболонки тонкої кишки (27–30), 2) підвищена проникність шлунково-кишкового тракту (31–34) та 3) реакції на слизову шлунка після внутрішньошлункової їжі під час ендоскопії (35). Однак механізми, що відповідають за кишкові зміни у хворих на харчову алергію, недостатньо вивчені (36). Кілька досліджень вказують на те, що беруть участь негайні реакції гіперчутливості. У дітей з харчовою алергією підвищений рівень IgE був виявлений як у фекаліях (37), так і в кишкових промиваннях (38), а також підвищена концентрація катіонного білка каолінового еозинофілу (39). Наші результати поширюють ці попередні спостереження, показуючи значну кореляцію між клінічною гіперчутливістю до їжі та збільшенням кількості IgE-позитивних тучних клітин слизової оболонки дванадцятипалої кишки, а також плазматичних клітин, що продукують IgE.
Виявлення алерген-специфічних антитіл IgE при кишкових промиваннях у хворих з непереносимістю їжі як негативними SPT, так і специфічними до їжі сироватковими антитілами IgE інтерпретується як результат суворо локального синтезу IgE (38). На відміну від цього, існує певна підтримка думки, що у пацієнтів з атопічними захворюваннями задіяна вся імунна система слизової (40). Більше того, виявлено, що місцеве вироблення IgE в кишечнику малоймовірно задіяне у значній мірі, оскільки IgE-позитивні В-клітини представляють менше 2% клітин, що продукують Ig-кишечник (41). Крім того, встановлено, що концентрації IgE у сироватці крові пов’язані з кількістю базофільних IgE-рецепторів (42). Погоджуючись з цими спостереженнями, ми виявили, що кількість IgE-позитивних клітин слизової оболонки дванадцятипалої кишки корелювало з рівнем IgE у крові, що свідчить про системну продукцію IgE. Це вірно і для пацієнтів зі шлунково-кишковими скаргами. Наші дані про імунореактивні клітини IgE в слизовій оболонці дванадцятипалої кишки за відсутності позитивного SPT або алерген-специфічних антитіл IgE не виключають строго місцевого продукування IgE. В якості альтернативи ці результати можна пояснити низькою точністю імунологічних тестів.
Наше дослідження вказує на те, що поява шкірних, шлунково-кишкових та респіраторних симптомів після прийому їжі пов'язане з опосередкованими IgE реакціями в слизовій оболонці дванадцятипалої кишки. Ми виявили, що IgE-позитивні клітини дванадцятипалої кишки мали високу, але недосконалу діагностичну точність, яка була порівнянна з точністю загальних сироваткових IgE, SPT та харчових специфічних IgE антитіл. Таким чином, наші результати підтверджують, що дієта для усунення алергену, що супроводжується харчовою проблемою, є найбільш точним засобом діагностики харчової алергії. Однак ми виявили збільшення IgE-вмісних клітин у всіх реакторах із затримкою, незважаючи на той факт, що одна третина мала негативні імунологічні тести. Белер та ін. (22) виявили, що жоден пацієнт із уповільненою реакцією на виклик коров’ячого молока не мав позитивних SPT або специфічних сироваткових антитіл IgE. Потрібне більш масштабне дослідження, щоб встановити, чи можуть наші результати у групі реакторів із затримкою мати діагностичне значення.
- Невпорядковані клітини щогли та підказки до харчової алергії - Сторінка 2 з 3 - Алергічне життя
- Клінічне випробування щодо гіперчутливості - Реєстр клінічних випробувань - ICH GCP
- Раннє введення продуктів для профілактики харчової алергії Алергія, астма; Повний текст клінічної імунології
- Шаленство при годуванні, наскільки точними є вказівки щодо годування вашої тварини; Служба клінічного харчування в
- Вузлова лімфоїдна вузлова гіперплазія у дітей у зв’язку з харчовою гіперчутливістю -