Вплив селективної гемопоетичної експресії IL-37 людини на системне запалення та атеросклероз у мишей з дефіцитом LDLr
Герте Хуке
1 кафедра медицини, відділ ендокринології, медичний центр Лейденського університету, поштова зона C7Q, P.O. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лабораторія експериментальної судинної медицини Ейнтховена, П.О. Box 9600, 2300 RC Leiden, Нідерланди
П. Падміні С. Дж. Хедое
1 кафедра медицини, відділ ендокринології, медичний центр Лейденського університету, поштова зона C7Q, P.O. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лабораторія експериментальної судинної медицини Ейнтховена, П.О. Box 9600, 2300 RC Leiden, Нідерланди
3 кафедра пульмонології, медичний центр Лейденського університету, Лейден П.О. Box 9600, 2300 RC Leiden, Нідерланди; [email protected]
Джанна А. ван Діпен
4 Кафедра загальної внутрішньої медицини та Центр інфекційних хвороб Радбуда, Медичний центр Неймегенського університету Радбуда, 6525 HP Неймеген, Нідерланди; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
Карін Пайк-Оверзет
5 Кафедра імуногематології та переливання крові Медичного центру Лейденського університету, П.О. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (K.P.-O.); [email protected] (F.J.T.S.)
Брітт ван де Вен
1 кафедра медицини, відділ ендокринології, медичний центр Лейденського університету, поштова зона C7Q, P.O. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
Надія Вазірпанах
1 кафедра медицини, відділ ендокринології, медичний центр Лейденського університету, поштова зона C7Q, P.O. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
Ізабель Мол
1 кафедра медицини, відділ ендокринології, медичний центр Лейденського університету, поштова зона C7Q, P.O. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лабораторія експериментальної судинної медицини Ейнтховена, П.О. Box 9600, 2300 RC Leiden, Нідерланди
Пітер С. Хімстра
3 Кафедра пульмонології Медичного центру Лейденського університету, Лейден П.О. Box 9600, 2300 RC Leiden, Нідерланди; [email protected]
Френк Дж. Стал
5 Кафедра імуногематології та переливання крові Медичного центру Лейденського університету, П.О. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (K.P.-O.); [email protected] (F.J.T.S.)
Рінке Штінстра
4 Кафедра загальної внутрішньої медицини та Центр інфекційних хвороб Радбуда, Медичний центр Неймегенського університету Радбуда, 6525 HP Неймеген, Нідерланди; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
6 Відділ харчування людини, Університет Вагенінгена, 6708 PB Вагенінген, Нідерланди
Міхай Г. Нетей
4 Кафедра загальної внутрішньої медицини та Центр інфекційних хвороб Радбуда, Медичний центр Неймегенського університету Радбуда, 6525 HP Неймеген, Нідерланди; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
7 Відділ геноміки та імунорегуляції, Інститут життя та медичних наук (LIMES), Бонський університет, 53113 Бонн, Німеччина
Чарльз А. Дінарелло
4 Кафедра загальної внутрішньої медицини та Центр інфекційних хвороб Радбуда, Медичний центр Неймегенського університету Радбуда, 6525 HP Неймеген, Нідерланди; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
8 Медичний факультет, Університет Колорадо, Аврора, CO 80045, США
Патрік К.Н. Ренсен
1 кафедра медицини, відділ ендокринології, медичний центр Лейденського університету, поштова зона C7Q, P.O. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лабораторія експериментальної судинної медицини Ейнтховена, П.О. Box 9600, 2300 RC Leiden, Нідерланди
Джиммі Ф.П. Бербі
1 кафедра медицини, відділ ендокринології, медичний центр Лейденського університету, поштова зона C7Q, P.O. Box 9600, 2300 RC Leiden, Нідерланди; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Лабораторія експериментальної судинної медицини Ейнтховена, П.О. Box 9600, 2300 RC Leiden, Нідерланди
Анотація
1. Вступ
Атеросклероз - це хронічний запальний стан, що характеризується поступовим накопиченням різних імунних клітин в артеріальній стінці [1]. Макрофаги є дуже важливими гравцями у розвитку атеросклерозу. На додаток до накопичення ліпідів, вони також виявляють велику пластичність у функції, яка варіюється від протизапальних до прозапальних фенотипів, залежно від конкретних подразників у атеросклеротичному нальоті [2]. Широкі дослідження зосереджувались на характеристиці проатерогенних цитокінів та рецепторів, що сприяють прогресуванню атеросклеротичного ураження (оглянуто в [1]). Однак лише обмежена кількість досліджень досліджувала атеропротекторну дію протизапальних цитокінів та їх терапевтичний потенціал як імунодепресивних медіаторів під час розвитку атеросклерозу [3]. Поки що протизапальні медіатори інтерлейкін (IL) -10 [4], трансформуючий фактор росту (TFG) -β [5], IL-33 [6] та антагоніст рецепторів IL-1 (IL-1ra) [7] показали, що вони проявляють помітну антиатеросклеротичну та атеропротекторну активність у мишей.
Протизапальний цитокін IL-37, раніше відомий як член сім’ї IL-1 7 (IL-1F7), з’явився як ендогенний супресор вроджених запальних та імунних реакцій [8]. IL-37 належить до сімейства IL-1, яке також включає, наприклад, IL-1α IL-1β, IL-1ra, IL-18 та IL-33. У людини різні тканини та типи клітин, включаючи моноцити крові [9], ендотеліальні клітини [10], адипоцити [11] та епітеліальні клітини [12], експресують IL-37. Однак гомолог миші ще не виявлений. Транскрипт мРНК IL-37 містить компонент нестабільності, який стабілізується при впливі клітин на запальні подразники [13], що сприяє підвищенню рівня експресії білка IL-37 у відповідь, наприклад, на агоністи Toll-подібних рецепторів, IL-1β та TNF- α [8]. Ефективність IL-37 для придушення запалення видно з експериментів in vitro, в яких індукція IL-37 помітно знижувала експресію прозапальних цитокінів та хемокінів у клітинних лініях моноцитів та макрофагів [8,14].
IL-37 складається з п’яти ізоформ (тобто IL-37a-e), серед яких IL-37b є найбільш поширеним [9]. Миші з трансгенною експресією людського IL-37b (IL-37tg) були захищені від індукованого ліпополісахаридами (LPS) септичного шоку і показали знижений рівень тканинних та системних рівнів запальних цитокінів у відповідь на LPS [8] та гепатит, індукований конканаваліном A [15]. ]. Крім того, мишей IL-37tg захищали від коліту, спричиненого декстраном сульфатом натрію (DSS), на що вказує сильно знижене запалення та проникнення товстої кишки в лейкоцити, включаючи макрофаги. Цікаво, що миші дикого типу (WT), відновлені в кістковому мозку від мишей IL-37tg, також були захищені від індукованого DSS коліту, що вказує на те, що експресія гемопоетичного IL-37 є достатньою для цього захисного ефекту [16].
Ці дані свідчать про те, що експресія IL-37 у кровотворних клітинах може зменшити місцевий приплив клітин та секрецію прозапальних цитокінів при запальних захворюваннях, включаючи атеросклероз. Це підтверджується недавнім дослідженням, в якому системне лікування ІЛ-37 захищало від атеросклерозу шляхом модуляції реакцій імунних клітин [17]. Отже, метою цього дослідження було оцінити, чи перешкоджає трансгенна експресія IL-37 у гемопоетичних клітинах накопичення макрофагів у бляшці та достатня для захисту від прогресування атеросклерозу. Ми трансплантували кістковий мозок мишам WT або IL-37tg мишам з дефіцитом рецепторів ЛПНЩ (Ldlr⁻/⁻) та оцінювали метаболічні та запальні параметри, а також розмір та склад атеросклеротичного ураження. Мишей годували дієтою західного типу (WTD), що містить 1% холестерину, щоб викликати гіперліпідемію та системне запалення низького ступеня. Ми демонструємо, що гемопоетична експресія IL-37 помірно знижує запальний статус гіперліпідемічних мишей Ldlr⁻ /, але розмір атеросклеротичного ураження або вміст макрофагів у бляшці залишається незмінним.
2. Результати
2.1. Експресія гемопоетичного IL-37 не впливає на метаболічні параметри
Людський IL-37 селективно експресувався в гемопоетичних клітинах, включаючи макрофаги, схильних до атеросклерозу мишей Ldlr⁻/by шляхом трансплантації клітин кісткового мозку мишам IL-37tg. В якості контролю мишам Ldlr⁻/were трансплантували кістковий мозок від мишей WT. Після періоду відновлення протягом дев'яти тижнів при регулярній дієті чау, гіперліпідемія була індукована, годуючи мишей дієтою західного типу із високим вмістом холестерину (ЗЗТ), збагаченою (що містить 1% холестерину) протягом восьми тижнів. Кістковий мозок мишей Ldlr⁻/trans, трансплантованих клітинами кісткового мозку IL-37tg, експресував мРНК людського IL-37 наприкінці дослідження, тоді як його не можна було виявити у трансплантованих WT мишах (дані не наведені), що підтверджує успішне відновлення кровотворення.
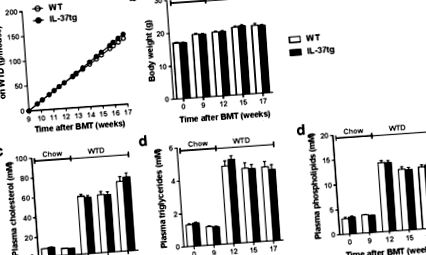
Ми оцінили вплив експресії гемопоетичного IL-37 на метаболічні параметри під час дослідження. Експресія гемопоетичного IL-37 не впливала на кумулятивне споживання їжі протягом періоду відновлення (не показано) або під час годування ВТР (рис. 1а). Вага тіла також не відрізнявся між групами (рисунок 1 b). Крім того, експресія гемопоетичного IL-37 не впливала на концентрацію загального холестерину в плазмі крові (рис. 1 с), тригліцеридів у плазмі крові (рис. 1 г) або концентрації фосфоліпідів у плазмі крові (рис. 1 д) під час дослідження.
Успішна експресія IL-37 людини в клітинах кровотворення не впливає на метаболічні параметри. Мишам Ldlr⁻/were трансплантували кістковий мозок від IL-37tg або контрольним мишам дикого типу (WT). Після дев'яти тижнів відновлення на регулярній дієті чау мишей годували західною дієтою (WTD) протягом восьми тижнів. Сукупне споживання їжі (a) вага тіла (b) та 4-годинний рівень холестерину натощак у плазмі (c) тригліцериди (d) та фосфоліпіди (e) спостерігались під час дослідження. Дані виражаються як середнє значення ± стандартна похибка середнього значення (SEM); n = 14–15 на групу. BMT, трансплантація кісткового мозку.
2.2. Експресія гемопоетичного IL-37 помірно зменшує запальний стан
Далі ми оцінили вплив експресії гемопоетичного IL-37 на показники запалення. Підживлення WTD збільшило sE-селектин у плазмі порівняно з годуванням чау, тим самим підтверджуючи індукцію запалення низької ступеня WTD, але експресія гемопоетичного IL-37 не зменшувала sE-селектину в плазмі (рис. 2а). Однак проточна цитометрія клітин крові показала, що експресія гемопоетичного IL-37 зменшує кількість циркулюючих імунних клітин, що видно із зменшення циркулюючих гранулоцитів (рис. 2 b), нейтрофілів (рис. 2 c) та еозинофілів (рис. 2 d) під час WTD- годування. Крім того, загальний вміст Т-лімфоцитів зменшувався під час годування чау- та WTD (рис. 2, е), а цитотоксичні Т-клітини значно зменшувались під час годування чау (рис. 2, е). На відміну від цього, експресія IL-37 не впливала на Т-клітини-помічники (рис. 2 г) та регуляторні Т-клітини (рис. 2 год). Хоча експресія гемопоетичного IL-37 не впливала на відсоток загальних циркулюючих моноцитів (рис. 2 i) або Ly6C lo моноцитів (рис. 2 j), експресія IL-37 зменшила кількість нещодавно завербованих моноцитів Ly6C hi (рис. 2 k). Співвідношення Ly6C lo та Ly6C hi моноцитів суттєво не збільшилось (рис. 2 I). У сукупності ці дані вказують на знижений запальний стан за допомогою експресії гемопоетичного IL-37.
2.3. Експресія гемопоетичного IL-37 не впливає на розвиток атеросклерозу
Нарешті, ми оцінили, чи зменшить запальний стан експресії гемопоетичного IL-37 ослаблення розвитку атеросклерозу. З цією метою ми визначили зону атеросклеротичного ураження в зоні клапана кореня аорти серця, а також склад атеросклеротичного ураження після восьми тижнів годування з ВТР. Незважаючи на те, що область атеросклеротичного ураження не зазнала впливу на корінні аортального серця (рис. 4 а – с), експресія IL-37 зменшила вміст гладком’язових клітин в атеросклеротичних ураженнях (рис. 4, д, г). Вміст колагену (рисунок 4 e, h) та вміст макрофагів (малюнок 4 f, i) залишаються незмінними між обома групами. У сукупності ці висновки вказують на те, що експресія гемопоетичного IL-37 незначно впливає на склад ураження без сильного впливу на розмір атеросклеротичного ураження.
Незважаючи на зменшення запального стану мишей, експресія гемопоетичного IL-37 у цьому дослідженні не зменшувала атеросклеротичного розміру вогнища та вмісту макрофагів в ураженнях. Це, мабуть, на відміну від інших недавніх досліджень, де лікування рекомбінантним IL-37 зменшувало розвиток атеросклерозу у діабетичних аполіпопротеїнів Е-дефіцитних (Apoe -/-) мишей, індукованих стрептозотоцином [25], і захищало мишей WT від індукованої ендотоксемією серцевої дисфункції [ 26] та пошкодження, спричинені ішемією міокарда/реперфузійною травмою через зменшення запального стану [27]. Дві причини можуть пояснювати відсутність впливу гемопоетичного ІЛ-37 на розвиток атеросклерозу.
4. Матеріали та методи
4.1. Тварини
4.2. Оцінка успішного відновлення кісткового мозку
В кінці дослідження кістковий мозок був виділений з гомілки та визначено гематологічний химеризм з використанням геномної ДНК методом полімеразної ланцюгової реакції (ПЛР) через 17 тижнів після ВМТ, який виділений за допомогою набору для чистої крові Gentra (Qiagen, Venlo, The Нідерланди). Відносну присутність IL-37 у кістковому мозку оцінювали за допомогою праймерів для людського IL-37 (вперед: 5′-CGATTCTCCTGGGGGTCTCTA-3 ′; зворотний: 5′-CGGCGTGCTGATTCCTTTTG-3 ′).
4.3. Аналіз ліпідів та системного запалення плазми
Кров брали з хвостової вени у мишей, що голодували протягом 4 годин, у зазначені моменти часу. Після восьми тижнів WTD зразки крові, що не посніли, збирали шляхом орбітальної знекровлення в пробірках, покритих етилендіамінтетраоцтовою кислотою (EDTA). Плазму з усіх зразків виділяли центрифугуванням та аналізували на вміст загального холестерину, тригліцеридів (Roche Diagnostics, Мангейм, Німеччина) та фосфоліпідів (Instruchemie, Delfzijl, Нідерланди) з використанням комерційних ферментативних наборів. Рівні розчинного Е-селектину (sE-селектину) у плазмі крові визначали за допомогою набору ІФА мишачого Е-селектину (R&D, Міннеаполіс, Міннесота, США). Всі аналізи проводились згідно з протоколами виробників.
4.4. Проточна цитометрія
Кров збирали перед початком (“чау”) та під час годування ЗВТ (“ЗВТ”) у пробірках, покритих ЕДТА. Після лізингу загальних еритроцитів підгрупи Т-лімфоцитів, моноцитів та гранулоцитів оцінювали за допомогою стандартного аналізу сортування клітин, активованого флуоресценцією (FACS). Клітини фарбували за допомогою кон’югованих флуорохромом моноклональних антитіл до CD4 (eBioscience, Сан-Дієго, Каліфорнія, США), CD8 (Biolegend, Сан-Дієго, Каліфорнія, США), CD11b, CD25, клон Ly6G 1A8 та Ly6C (усі BD Pharmingen, Сан-Дієго, Каліфорнія, США). Внутрішньоклітинне фарбування FoxP3 проводили за допомогою набору для фарбування FoxP3 (eBioscience). Дані отримували на FACSAria або FACSCanto II (BD Biosciences, Сан-Дієго, Каліфорнія, США) та аналізували за допомогою програмного забезпечення FlowJo (Treestar, Ashland, OR, USA). Дані представлені у відсотках живих клітин.
4.5. Ex Vivo стимуляція перитонеальних макрофагів
В кінці дослідження перитонеальні макрофаги були виділені та стимульовані ex vivo 10 нг · мл -1 ліпополісахариду кишкової палички (E. coli LPS; серотип O55: B5, Sigma Aldrich, Сент-Луїс, Міссурі, США), який був далі очищають, як описано в [30], або витримують у фізіологічному розчині як контроль протягом 24 годин. Концентрації хемоаттрактантів кератиноцитів (KC) та IL-6 визначали у середовищі комерційними наборами ELISA (Biosource, Камарілло, Каліфорнія, США) відповідно до інструкцій виробника.
4.6. Аналіз експресії генів
РНК виділяли із заморожених зразків печінки миші (приблизно 30 мг) за допомогою реагенту для виділення трипусної РНК (Roche) відповідно до протоколу виробника. Загальна РНК (1 мкг) була зворотно транскрибована за допомогою зворотної транскриптази вірусу мишачого лейкозу Молоні (M-MLV) (Promega) для qRT-PCR згідно з інструкціями виробника для отримання кДНК. Експресія мРНК нормалізувалась до експресії мРНК β2-мікроглобуліну і експресувалась відносно мишей WT, використовуючи метод ΔΔCt. Використані послідовності праймерів наведені в таблиці 1 нижче.
- Який вплив веганської дієти з низьким вмістом жиру на функцію підшлункової залози у людей із надмірною вагою та без діабету
- Які наслідки дієти з низьким вмістом білка для дорослих без діабету з хронічними захворюваннями нирок
- Виживання йогуртових бактерій в кишечнику людини
- Вплив центрального ожиріння на запалення, гепсидин та метаболізм заліза у молодих жінок
- Виживший під час експериментів нацистських близнюків розмовляє з лікарями про дослідження людей - ScienceDaily