Вплив дієти з високим вмістом жирів і низьким вмістом вуглеводів на окислення субстрату міокарда, чутливість до інсуліну та серцеву функцію після ішемії-реперфузії
Кафедра медицини Алабамського університету в Бірмінгемі, Бірмінгем, штат Алабама;
Інститут серцево-судинних досліджень, Національний університет охорони здоров’я, Національний університет Сінгапуру, Сінгапур; і
Кафедра медицини Алабамського університету в Бірмінгемі, Бірмінгем, штат Алабама;
Кафедра медицини Алабамського університету в Бірмінгемі, Бірмінгем, штат Алабама;
Медичний факультет Алабамського університету в Бірмінгемі, Бірмінгем, Алабама;
Кафедра медицини Алабамського університету в Бірмінгемі, Бірмінгем, штат Алабама;
Медичний центр Бірмінгема, Бірмінгем, Алабама
Адреса для запитів на передрук та іншої кореспонденції: С. Г. Ллойд, департамент медицини, Відділ серцево-судинних захворювань, Університет. Алабами в Бірмінгемі, МРТ серця D-101, 1808 7th Ave. South, Бірмінгем, AL 35294-0012 (електронна пошта: [електронна пошта захищена]).
Анотація
Окислення субстрату та реакція на введення/виведення більше залежать від дієти, ніж від змін фізіологічного діапазону циркулюючого субстрату та інсуліну. Це було пов'язано зі зміною чутливості до інсуліну. Після I/R спостерігалася позитивна (з кетоном) та негативна (з FFA) кореляція між відновленням функції та окисленням субстрату.
Тварини та дієти.
Усі експерименти на тваринах були схвалені Інституційним комітетом з догляду та використання тварин Університету Алабами в Бірмінгемі та слідували Посібнику з догляду та використання лабораторних тварин (Національна академія наук, 1996). Дорослих самців щурів Sprague-Dawley 300 ± 10 г (Taconic Farms, Hudson, NY) годували однією з двох дієт, кожна з яких була розроблена, щоб бути подібною до тих, що використовуються людьми для схуднення: HFLCD [60% калорій від жиру/30% з білка/10% з вуглеводів, відносно високий вміст білка (30% ккал) і дуже висока кількість насиченого (40%) і мононенасиченого (40%) жиру, розробленого таким чином, щоб бути подібним до фази індукції Дієта Аткінса для людей (10) (TestDiet 5TSY, Richmond, IN)] або контрольна дієта з низьким вмістом жиру (CONT) (16/19/65%; TestDiet 5TJM). Детальні компоненти дієти, включаючи пропорції насичених, моно- та поліненасичених жирів, а також поліненасичених жирних кислот n-3 та n-6, були описані раніше (24, 25). Тварин годували дієтами протягом 14 днів до проведення перфузійних експериментів. Щурів утримували при 22 ° C протягом 12-годинного циклу світло-темрява. Тваринам було дозволено вільний доступ до їжі та води.
Ізольована перфузія серця.
Таблиця 1. Використовувані інсулінові та кетонові буферні композиції та позначення/етикетки
ЯМР-спектроскопія.
Після 30-хвилинного рівноваги немічений глюкоза, лактат, пальмітат і кетон у буфері перемикаються на 13-мічену глюкозу (рівномірно позначену на всіх 6 вуглецях, позначену як [U-13 C] глюкоза), лактат натрію (рівномітно позначений на всі 3 вуглеці, позначені [U-13 C] лактатом), піруват натрію (рівномітно позначений; [U-13 C] піруват), пальмітат натрію (маркований 13 C лише в 1-положенні; [1- 13 C] пальмітат) та 3-гідроксибутират натрію як кетон (3-HB, мічений у положеннях 2 та 4; [2,4-13 C] 3-HB) при тих же концентраціях, що і немечені сполуки, як більш докладно описано нижче . Після 30 хв перфузії з міченими субстратами цілі серця заморожували, заморожені серця подрібнювали в порошок, а тканину серця гомогенізували та екстрагували крижаною 6% хлорною кислотою. Екстракт сушили ліофілом і повторно розчиняли у фосфатному калійному буфері (рН 7,5, 50 мМ) з розчинником 2 H2O (99,9%; Кембриджські ізотопні лабораторії, Андовер, Массачусетс).
Спектри ЯМР 13 C, розщеплені протоном, посилені NOE, збирали на ЯМР-спектрометрі Bruker AVANCE 500, що працює при 11,85 Т, за допомогою гетероядерного широкосмугового зонда TBI. Спектри збирали при 300 К зі спектральною шириною 25 кГц і 32 тис. Точок даних. Спектри збирали з підсумовуванням сканувань, поки не було досягнуто належного співвідношення сигнал/шум (зазвичай сканування 4k – 64k). Спектри аналізували за допомогою програмного забезпечення Nuts (AcornNMR, Livermore, CA). Дані часової області 13 C обробляли з розширенням лінії від 1 до 2 Гц, заповнювали нулем, трансформували Фур’є і посилали на пік метилового вуглецю лактату (при 21,1 ppm). Мультиплетні відносні площі ЯМР глутамату 13 С у вуглецях від 1 до 5 та інтегровані області резонансів С3 та С4 (з поправкою на ефекти релаксації) вимірювали, як описано раніше (26, 27).
13 Аналіз ізотомеру С-глутамату.
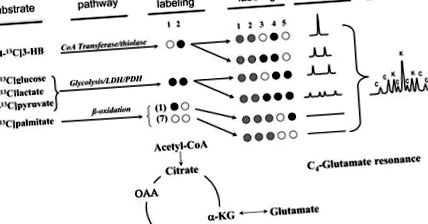
Рис. 1.Схема маркування субстратів у циклі TCA, як використано в цих експериментах, та отримані в результаті глутамат C-4 спектральні ізотомери. Чорні кола, заповнені маркуванням вуглецю-13 (збагачення від 98 до 99%), маркування природного достатку відкритих кіл (тобто 99% вуглецю-12), а сірі кола можуть бути або вуглецем-12, або вуглецем-13, оскільки вони не сприяють спектр глутамату С-4. У спектрі ЯМР 13 C праворуч K являє собою піки ізотомерів, отримані з кетону (3-HB); С являє собою похідні вуглеводів (глюкоза, лактат та піруват). Зауважте, що β-окислення [1- 13 C] пальмітату призводить до семи немічених фрагментів ацетил-КоА та одного [1- 13 С] ацетил-КоА фрагментів, жоден з яких не сприяє резонансу глутамату С4. OAA, оксалоацетат; α-KG, α-кетоглутарат.
Вимірювання серцевої чутливості до ізольованого серця.
Серця, виділені з груп CONT або HFLCD, перфузували чотирма перфузійними буферами (HI-HK, HI-LK, LI-LK та LI-HK) під час перфузійної базової перфузії та LFI (0,3 мл/хв; тривалість 60 хв), а потім 60 хв реперфузії. Заморожені цілі серця подрібнювали, а білок із зразків 50 мкг екстрагували для вестерн-блот. Для оцінки чутливості до інсуліну іншу групу серця було перфузовано чотирма дозами інсуліну: дуже низькою дозою (5 мкУ/мл), фізіологічним діапазоном дози (15 мкЕ/мл), проміжною дозою (100 мкУ/мл) та фармакологічна висока доза для максимальної стимуляції (2000 мкО/мл); N = 5 для кожної дози інсуліну та дієтичної групи. Після 60-хвилинної перфузії всі серця швидко заморожували, витягували білок із зразків 50 мкг цілої серцевої тканини та проводили вестерн-блот з комерційними антитілами: анти-Akt та анти-фосфо-Ser473-Akt (розведення 1: 2000; Абкам, Кембридж, Массачусетс). Інтенсивності смуг аналізували ImageJ для кількісного визначення Akt та фосфо-Akt (p-Akt). Інтенсивність фосфо-Akt ділили на інтенсивність загального Akt.
Статистичний аналіз.
Дані для порівняння безперервних змінних між двома групами аналізували за допомогою загальної лінійної моделі багатовимірного тесту та тестів лінійної регресії (IBM SPSS Statistics, GraphPad Prism). Значення були виражені як середні значення ± SE. Різниця між групами вважалася значною на сьогодні P
Рис.2.HFLCD підвищує сприйнятливість до ішемічного ураження міокарда. A:% відновлення базової RPP. B і C.:% відновлення вихідного рівня ± dP/dt наприкінці 60-хвилинної LFI та 60-хвилинної реперфузії. Дані наведені для кожної комбінації буферної перфузії. Засоби ± SE, n = Від 4 до 6 у кожній групі, *P
Таблиця 2. Загальна лінійна модель визначення величини ефектів дієти, буферного інсуліну, буферного кетону та всіх можливих взаємодій між цими факторами на функцію лівого шлуночка після ішемії-реперфузії
Рис.3.Репрезентативні спектри ЯМР 13 C, що демонструють вступ до циклу TCA субстрату в базових умовах та в режимі введення/виведення. Репрезентативні 13 C ЯМР-спектри від 15 до 55 ppm (зліва) і в районі 33 проміле (правильно), зосереджуючись на глутаматному С4-резонансі, в умовах базового рівня (умови нормального потоку) (A) або I/R (B). Літера С позначає піки, що виникають в результаті СНО, а К позначає піки, що виникають внаслідок включення кетонів.
Таблиця 3. Вплив дієти, буферного інсуліну, буферного кетону та взаємодії між цими факторами на введення субстрату циклу TCA після ішемії-реперфузії
Таблиця 4. Вплив дієти, буферного рівня інсуліну та кетонів на частку загального ацетил-КоА, що надходить у цикл ТСА в умовах нормоксиї та в/в.
Означає ± SE, n = Від 4 до 6 у кожній групі. Значення виражаються як% від загального входу в цикл ТСА з пулу ацетил-КоА, отриманих від кожного субстрату та округлених до найближчих відсотків.
* P # P † P ‡ P
Рис.4.Взаємозв'язок між серцевою функцією та входом циклу TCA FFA, CHO та кетону. Ліворуч: кореляція між швидкістю і тиском (RPP) (мм рт.ст./хв) та входом циклу TCA за допомогою лінійного регресійного аналізу. Співвідношення P значення
Вплив дієти та ішемії-реперфузії на сигналізацію про інсулін у міокарді щурів.
Співвідношення фосфо-Akt до загального Akt було подібним між серцями HFLCD та CONT при нормоксії. Однак в умовах I/R щури, що харчуються HFLCD, як правило, демонстрували зниження p-Akt/загального Akt у діапазоні комбінацій буферного інсуліну та кетону, що вказує на знижений сигнальний ефект інсуліну у HFLCD (рис. 5).
Рис.5.Сигналізація про інсулін у міокарді щурів в умовах нормоксичності та введення/введення. Зразки тканин серця з CONT і HFLCD, перфузовані з різними буферами, піддавали Вестерн-блот-аналізу, виявляючи p-Ser473-Akt і загальний Akt. Дані відображаються як відношення p-Akt/загального Akt, нормоване для того, щоб зробити групу CONT = 100% за нормоксичних та I/R умов; *P
Чутливість до інсуліну.
Щоб дослідити вплив HFLCD на внутрішню чутливість до інсуліну, ми оцінили ефект дози-реакції інсуліну на фосфорилювання Akt. Як показано на рис. 6, Вестерн-блот виявив залежність від дієти прогресування ефекту інсуліну на фосфорилювання Akt у діапазоні концентрації інсуліну від фізіологічно низького рівня (5 мкУ/мл), нормального до проміжно високих діапазонів 15 і 100 мкУ/мл, до фармакологічно високого рівня (2000 мкО/мл). З HFLCD відносне фосфорилювання Akt, як правило, було вищим при менших дозах інсуліну, але виявляло притуплену реакцію на підвищення рівня інсуліну порівняно з дієтою CONT (що продемонструвало прогнозоване залежне від дози відносне збільшення p-Akt із збільшенням дози інсуліну; рис. 6 ).
Рис.6.Дозозалежне фосфорилювання Akt інсуліну в міокарді щурів CONT і HFLCD. Вестерн-блот-аналіз рівнів загального Akt та фосфо-Akt (p-Akt) у серцях серця та HFLCD. Наведені дані - p-Akt/загальний Akt, стандартизований таким чином, що група CONT становить 100% для кожної умови. Значення виражаються як середні значення ± SE; n = 5, **P
Вивчення всієї групи даних показало, що як HFLCD, так і I/R збільшують окислення FFA і зменшують окислення CHO або кетонів. Інші групи повідомляли, що стимуляція окислення глюкози захищає від гострого інфаркту міокарда та реперфузійного пошкодження (42), а підвищене окислення FFA асоціюється зі зниженою толерантністю міокарда до ішемії-реперфузії (13); тому будь-яке збільшення FFA та зменшення CHO або окислення кетонів, викликане HFLCD, може призвести до погіршення серцевої функції під час введення/введення. Це призвело до концепції, що придушення окислення FFA міокарда може бути терапевтичною метою для підвищення серцевої ефективності в ішемічному серці (40). Крім того, надлишок поживних речовин при дієті з високим вмістом жиру може призвести до накопичення токсичних проміжних речовин метаболізму жирних кислот внаслідок неповного окислення жирних кислот у мітохондріях (1) та сприяти резистентності до інсуліну, окисному стресу та роз'єднанню окисного метаболізму з переносом електронів (15, 20, 28, 38). Дійсно, ми виявили, що відносний ступінь окислення FFA негативно корелював із відновленням функції після введення/введення.
Хоча наші результати вказують на те, що годування HFLCD до введення/виведення шкідливе, в інших умовах дієта з високим вмістом жиру може бути корисною. Реннісон та ін. (32) встановили, що годування з високим вмістом жиру після перев’язки коронарних артерій покращує мітохондріальну та скорочувальну функції при хронічній серцевій недостатності. Вони також повідомили, що дієта з високим вмістом жиру не призвела до погіршення дисфункції лівого шлуночка при вживанні після експериментального інфаркту міокарда; хоча в тих самих серіях експериментів введення дієти з високим вмістом жиру протягом 2 тижнів перед перев'язкою коронарних артерій призвело до збільшення рівня хірургічної смертності (33). Тому, здається, вживання дієти з високим вмістом жиру перед інфарктом міокарда може бути шкідливим, тоді як вживання цієї дієти після інфаркту може бути корисним.
Конкретний склад жирних кислот може бути важливим для визначення впливу на міокард. Деякі дослідження показали, що високодиетичні поліненасичені жирні кислоти надають кардіопротекцію та покращують серцеву діяльність за допомогою протизапальних та антиоксидантних ефектів (11, 47) та відновлення дихальної діяльності мітохондрій та послаблення перекисного окислення ліпідів (11) під час або після пошкодження В/Р. Однак дуже високі насичені та мононенасичені дієти, що містять жирні кислоти (як у використовуваній нами HFLCD, при 40% насичених та 40% мононенасичених, що відображає дієти, які зазвичай їдять люди), можуть бути шкідливими через підвищений окислювальний стрес (24).
Інсулін може бути важливим зв'язком між метаболізмом міокарда, його функцією та реакцією на ішемічну травму (14, 18). Інсулін зменшує індукований ішемією некроз кардіоміоцитів за допомогою механізму, залежного від Akt/NF-κB (7). Цей захисний ефект може залежати як від рівня циркулюючого інсуліну, так і від специфічної чутливості до інсуліну. У цій роботі ми показали, що серця, що харчуються HFLCD, мали нижче фосфорилювання Akt після I/R у фізіологічному спектрі перфузійного буферного складу (рис. 5), вказуючи, що внутрішня чутливість міокарда до інсуліну нижча при цій дієті в цих умовах перфузії. . Цей ефект не повністю обумовлений впливом на окислення глюкози, оскільки він не залежить від його впливу на засвоєння глюкози в постішемічно ізольованому робочому серці щурів (48). Спостережуване зниження фосфорилювання Akt у HFLCD під I/R, без змін окиснення CHO порівняно з дієтою CONT, узгоджується з попередньою роботою, яка показала, що HFLCD не змінював експресію поглинання глюкози (GLUT4) та генів окислення глюкози під I/R R (25). Таким чином, виявляється, що кардіопротекторні ефекти інсуліну та його вплив на засвоєння глюкози є принаймні частково не пов'язаними.
На закінчення ми виявили, що дієти, використані в наших дослідженнях, але не концентрація інсуліну або кетонів у перфузійних сумішах в наших ізольованих експериментах на серці, мали великий вплив на окислення субстрату міокарда та відновлення постішемічної функції (з гіршим відновленням функції у тварин їдять HFLCD). В умовах I/R відновлення серцевої функції негативно корелювало з окисленням FFA і позитивно корелювало з окисленням кетонів. Ми також продемонстрували, що HFLCD змінює чутливість до інсуліну міокарда. Порушення чутливості до інсуліну та зміни окиснення метаболічного субстрату, які спостерігаються при HFLCD, рухаються у напрямку, який може сприяти зниженню відновлення систолічної функції при реперфузійній ішемії/інфаркті міокарда.
Ця робота була підтримана частково грантом Американської асоціації серця з розвитку вчених 0735212N та Національним інститутом діабету та хвороб органів травлення та нирок P30 DK-056336 .
Ніяких конфліктів інтересів, фінансових чи інших, автор не заявляє.
- Дієта з низьким вмістом вуглеводів сприяє аритмічній смерті та збільшує міокард
- Корейська дієта запобігає ожирінню і покращує стійкість до інсуліну у мишей, які харчуються дієтою з високим вмістом жиру -
- Дієта з низьким глікемічним індексом може покращити чутливість до інсуліну у дітей, що страждають ожирінням
- Чутливість до інсуліну та толерантність до глюкози змінюються внаслідок дотримання кетогенної дієти
- Вплив дієти з високим вмістом жиру на судинозвужувальну реактивність стійкості жирової тканини білих та коричневих кольорів