Відмінності в харчуванні між 19 і 21 століттями; чи можуть вони призвести до інсуліну та лептину
Consulte los artículos y contenidos publicados en este medio, además de los e-sumarios de las revistas científicas en el mismo momento de publicación
Esté informado en todo momento gracias a las alertas y novedades
Acceda a promociones exclusivas en suscripciones, lanzamientos y cursos acreditados
Publicación continuada como Endocrinología, Diabetes y Nutrición. Más información
Indexada en:
Index Medicus/MEDLINE, Excerpta Medica/EMBASE, SCOPUS, Розширений Індекс наукового цитування, Звіти про цитування журналів/Наукове видання, IBECS
Síguenos en:
Ель-фактор, що впливає на засоби масової інформації дель-нумеро-де-цитаціонес-рецибіди-ан-ан-а-по-пор-трабайос-публікас-ен-ла-Публікацій Дуранте-Лос-Дус-Анторіос.
SJR es una prestigiosa métrica basada en la idea que todas las citaciones no son iguales. SJR США та алгоритм аналогічного рейтингу сторінок Google; es una medida cuantitativa y cualitativa al impacto de una publicación.
SNIP permite comparar el impacto de revistas de diferentes campos temáticos, corrigiendo las diferencias en la probabilidad de ser citado que existe entre revistas de distintas materias.
Зростає уявлення про те, що глибокі зміни навколишнього середовища в таких областях, як раціон харчування та спосіб життя, які почалися із впровадження сільського господарства та приручення тварин приблизно 10 000 років тому, насправді відбулися зовсім недавно за еволюційним часовим масштабом. Еволюція від палеолітичної дієти до нашої сучасної схеми споживання також призвела до кількох змін у поведінці годування, включаючи збільшення споживання оброблених продуктів, багатих натрієм та гідрованими жирами та з низьким вмістом клітковини. 1–3 Зміни кількох параметрів їжі, такі як збільшене споживання калорій (переважно продуктів, багатих насиченими/транс-жирними кислотами) та розмірів порцій, включаючи введення їжі “надмірного розміру”, відіграють важливу роль у появі не заразні хронічні захворювання. 4,5
Інтерес до вивчення ліпідів зріс з 19 століття. У 1847 р. Фогель був першим дослідником, який виявив наявність холестерину в атеросклеротичних бляшках. Століття потому Bang & Dyerberg 6 відзначили, що ескімоси мали низький рівень серцево-судинних захворювань, незважаючи на дієту з високим вмістом жирів, і вперше припустили, що омега-3 жирні кислоти відповідають за інгібування захворювань, пов'язаних з ожирінням.
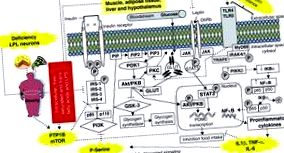
Після Другої світової війни та індустріалізації мережі швидкого харчування почали пропонувати страви, багаті насиченими/транс-жирними кислотами, що може бути причиною високої поширеності ожиріння. 7 Таким чином, у 1994 році, після відкриття лептину, 8 кілька досліджень продемонстрували, що дієти з високим вмістом жиру призводять до ожиріння та викликають запалення в периферичних тканинах та гіпоталамусі, сприяючи резистентності до інсуліну та лептину. 9,10 Ці результати частково можна пояснити накопиченням внутрішньоклітинних жирних кислот (наприклад, ацил-КоА); вільні жирні кислоти (FFA), що виділяються адипоцитами за допомогою ліполізу, можуть спричинити запальні зміни та призвести до порушення сигналізації про інсулін та лептин. 11 Нещодавно Wang et al. 12 продемонстрували, що ліпопротеїн-ліпаза (LPL), серинова гідролаза, яка вивільняє FFA з циркулюючих багатих триацилгліцерином ліпопротеїдів, може сприяти опосередкованому FFA сигналу в центральній нервовій системі. Автори встановили, що нейроспецифічні гомозиготні мутантні (NEXLPL -/-) миші гіперфагічні і страждають ожирінням до 16-тижневого віку (рис. 1).
IRS-1 і 2: субстрат рецепторів інсуліну 1 і 2, IKK-β: інгібітор ядерного фактора-kB кінази, p85: регуляторна субодиниця PI3-K, p110: каталітична субодиниця PI3-K, PI3-K: фосфатидилінозитол 3- кіназа, PIP: фосфатидилінозитол білок, PIP2: фосфатидилінозитол-4,5-бісфосфат, PIP3: фосфатидилінозитол-3,4,5-трифосфат, PDK1: 3-фосфоїнозитидзалежна протеїнкіназа, Akt/PKB: протеїнкіназа B, PKC кіназа C, GSK-3: глікогенсинтаза кіназа-3, GLUT-2,4: транспортер глюкози 2,4, MyD88: мієлоїдний фактор диференціації 88, p50: p50 субодиниця NFκB, p65: p65 субодиниця NFκB, pIKBα: фосфо- інгібуюча субодиниця NF-κBα, pIKKβ: фосфорильований IKKβ, NFκB: ядерний фактор каппа B, IL-6: інтерлейкін 6, IL-8: інтерлейкін 8, IL-1β: інтерлейкін-1β, TNF-α: фактор некрозу пухлини альфа, SOCS3: супресор сигналізації цитокінів-3, TLR4: давальницькі рецептори, LPL: ліпопротеїд-ліпаза, LPS: ліпополісахариди, JAK: кіназа Janus, STAT3: перетворювач сигналу та активатор транскрипції 3.
Ожиріння та насичені/багаті транс-жирними кислотами дієти призводять до резистентності до інсуліну/лептину та запалення в декількох тканинах.
IRS-1 і 2: субстрат рецепторів інсуліну 1 і 2, IKK-β: інгібітор ядерного фактора-kB кінази, p85: регуляторна субодиниця PI3-K, p110: каталітична субодиниця PI3-K, PI3-K: фосфатидилінозитол 3- кіназа, PIP: фосфатидилінозитол білок, PIP2: фосфатидилінозитол-4,5-бісфосфат, PIP3: фосфатидилінозитол-3,4,5-трифосфат, PDK1: 3-фосфоїнозитидзалежна протеїнкіназа, Akt/PKB: протеїнкіназа B, PKC кіназа C, GSK-3: глікогенсинтаза кіназа-3, GLUT-2,4: транспортер глюкози 2,4, MyD88: мієлоїдний фактор диференціації 88, p50: p50 субодиниця NFκB, p65: p65 субодиниця NFκB, pIKBα: фосфо- інгібуюча субодиниця NF-κBα, pIKKβ: фосфорильований IKKβ, NFκB: ядерний фактор каппа B, IL-6: інтерлейкін 6, IL-8: інтерлейкін 8, IL-1β: інтерлейкін-1β, TNF-α: фактор некрозу пухлини альфа, SOCS3: супресор сигналізації цитокінів-3, TLR4: давальницькі рецептори, LPL: ліпопротеїд-ліпаза, LPS: ліпополісахариди, JAK: кіназа Janus, STAT3: перетворювач сигналу та активатор транскрипції 3.
Ці підвищені рівні ацил-КоА/FFA активують протеїнкіназу С серин/треонінкінази С (РКС), яка може фосфорилювати субстрати рецепторів інсуліну (IRS) та активувати платоподібні рецептори (TLR2/4), активуючи комплекс кіназ ядерного фактора κB (IKK-β) та ядерного фактора каппа B (NF-κB P50/p65), а також посилення секреції запальних цитокінів, що призводить до резистентності до інсуліну та лептину. Більше того, насичені/транс-жирні кислоти та кишковорозчинні ліпополісахариди (LPS) можуть діяти як прямі ліганди для TLR2/4, 9,11,13,14, що активують PKC та призводять до резистентності до інсуліну (рис. 1). Однак інші сигнальні шляхи, які беруть участь в резистентності до інсуліну, також можуть регулюватися насиченими/трансжирними кислотами через TLR4; Сюди входять активовані мітогеном білкові кінази (MAPK), аміно-кінцева кіназа c-Jun (JNK), стрес ендоплазматичної сітки (ER), розгорнута реакція білка (UPR) та керамідні шляхи, а також інгібування активованого проліфератором пероксисом сигналізація гамма-адипонектину рецептора (PPAR). 10,14–16 Вживання насичених дієт, багатих жирними кислотами, притуплює лептинову анорексигенну сигналізацію в гіпоталамусі через запальний механізм, ймовірно, шляхом активації TLR4 та фактора диференціації мієлоїдів 88 (MyD88) 17,18 (рис. 1).
Ще однією потенційною причиною захворювань, пов’язаних із ожирінням, є активація білково-тирозинфосфатази (PTP) -1B, ключового ферменту, що бере участь у регуляції оборотного фосфорилювання тирозину. PTP-1B може активуватися насиченими жирними кислотами та запаленням і, коли активується, викликає інактивацію рецептора інсуліну шляхом видалення фосфатів з активного рецептора інсуліну та його субстратів. 19,20 Цікаво, що PTP-1B може також дефосфорилювати кіназу/перетворювач сигналу Janus та активатор транскрипції (JAK/STAT3), зменшуючи ефекти лептину та спричиняючи стійкість до лептину. Крім того, дослідження показують, що стимуляція шляху ссавців рапаміцину (mTOR/p70S6K) пов'язана з фосфорилюванням серину IRS-1/2 та порушенням активації Akt інсуліном 23,24 (рис. 1).
Підводячи підсумок, очевидно, що зміни в режимі харчування та настання індустріалізації, із зростанням ланцюгів швидкого харчування та малорухливого способу життя, збільшили поширеність таких слабко запальних станів, як серцево-судинні захворювання, метаболічний синдром, діабет та ожиріння. Однак у суб'єктів, які не зробили цих дієтичних змін, не спостерігається метаболічних відхилень. Крім того, здорове харчування з низьким вмістом насичених/трансжирних кислот або високим рівнем поліненасичених жирних кислот може частково змінити ці захворювання. Таким чином, слід проводити майбутні дослідження, щоб оцінити наслідки цієї зміни в харчуванні; такі дослідження повинні бути зосереджені на ще нехарактерних аспектах споживання жиру та протизапальних терапіях, які можуть застосовуватися для лікування захворювань, пов’язаних із ожирінням.
- Все, що дотримується помірних дієт, може призвести до погіршення стану метаболізму у дорослих американців - ScienceDaily
- Дієта Дюкана може збільшити ризик захворювань нирок Споживання високих білків може призвести до нирок кальцію
- Споживання проясненого грейпфрутового соку покращує інсулінорезистентність, спричинену дієтою, та
- Екстремальна дієта без кальцію може призвести до гіпероксалурії та рецидиву каменів у нирках - тематичне дослідження -
- Фруїтарна пара каже, що дієта, яка складається лише з фруктів, означає, що їм не потрібно чистити зуби -