‘Від смерті, приведи мене до безсмертя’ - мантра старіння скелетних м’язів
Амарджіт Сайні
1 Школа спорту, фізичних вправ та наук про здоров'я, Університет Лафборо, Лафборо, Великобританія;
Сарабджіт Мастана
1 Школа спорту, фізичних вправ та наук про здоров'я, Університет Лафборо, Лафборо, Великобританія;
Фіона Майєрс
2 Школа біологічних наук, Портсмутський університет, Портсмут, Великобританія
Марк Пітер Льюїс
1 Школа спорту, фізичних вправ та наук про здоров'я, Університет Лафборо, Лафборо, Великобританія;
Анотація
ВСТУП
Наслідки старіння мають серйозні фізіологічні наслідки для скелетних м'язів. Термін «саркопенія» був використаний для опису повільної, поступової втрати м’язової маси з настанням віку [1]. В оперативному порядку саркопенія визначається як апендикулярна скелетна м'язова маса, розділена на висоту в метрах більше ніж на два стандартних відхилення нижче середнього середнього показника молодості. З цим станом пов’язане поступове зниження функціональних властивостей м’язів, включаючи зменшення здатності виробляти силу та максимальну швидкість вкорочення та загальне уповільнення скорочення та розслаблення [1].
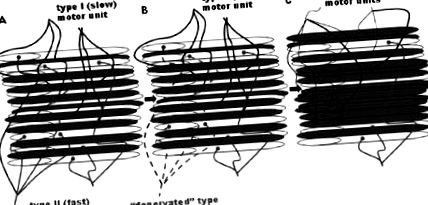
Вважається, що вікове зниження м’язової функції пов’язане зі зменшенням як м’язової кількості (маси), так і зниженням м’язової якості (термін, що охоплює багато факторів, включаючи силу на площу поперечного перерізу м’язів (CSA), пропорції клітковини та метаболічні характеристики). Втрата кількості м’язів відбувається через зменшення вмісту скорочувального білка через втрату окремих м’язових волокон та зменшення розміру інших м’язових волокон (рис. 1 1 ) [2]. Ці зміни впливають на різні типи м’язових волокон вибірково, процес, який називають „віковим реконструкцією рухової одиниці” (рис. 1 1 ) [3]. На додаток до реконструкції застарілих м’язів у напрямку до більш повільного фенотипу, CSA значно знижується у волокнах типу II (швидкі), тоді як волокна типу I (повільні) залишаються відносно незмінними [4]. Подібним чином, здебільшого це волокна типу II, які втрачаються зі старінням, залишаючи більшу частку волокон типу I у м’язі [5].
Вікове ремоделювання рухової одиниці [2]. Вважається, що процес денервації та реіннервації м’язових волокон триває протягом усього життя і прискорюється зі старінням [2, 85]. У міру старіння, як вважають, відбувається селективна втрата швидких моторних одиниць типу II, денервовані волокна або втрачаються, або поновлюються повільними моторними одиницями типу I. Білі волокна - це ті, які недавно денервувались і які або загинуть, або будуть реіннервовані іншим руховим нейроном (типу I). Вважається, що знижується рівень CSA решти волокон. Таким чином, м’язи стають меншими (внаслідок загальної втрати волокон) і повільнішими (через збільшення частки волокон I типу) із збільшенням віку [1, 2]).
Для пояснення зміни загальної м’язової маси було запропоновано різні механізми (див. Табл 1 1 ). Запропоновані механізми, як правило, включають відсутність регулярних фізичних навантажень (сидячий спосіб життя), зміни ендокринної функції (інсулін, тестостерон, гормон росту, кортизол), втрату нервово-м'язової функції (денервація або реіннервація), зміна білкового обміну (дефіцит між синтез білка проти деградації), харчування (насамперед амінокислоти), апоптоз та хвороби або травми [2, 6].
Таблиця 1.
Потенційні причини вікової втрати м’язової маси (адаптовано з [2])
| Посилення сидячого способу життя |
| Знижений рівень тропічних гормонів та сприйнятливість до них |
| Знижений рівень гормону росту |
| Відновлені андрогени (тестостерон) |
| Зниження інсуліноподібного фактора росту-I та сигналізації про фактор росту |
| Знижений дегідроепіандростерону сульфат (DHEAS) |
| Зниження рівня естрогенів (естрон, естрадіол) |
| Знижений 25-гідрокси ергокальциферол (вітамін D) |
| Зниження або дисбаланс білкового обміну |
| Посилення нейродегенеративного процесу |
| Атрофія м’язових волокон |
| Запалення |
| Збільшення поширеності інвалідності |
| Зниження функціональної здатності |
| Зниження швидкості базального метаболізму |
| Зміна експресії генів |
З віком (> 85 років) втрата маси та сили може мати значний вплив на функціональну незалежність [7]. Дані з популяцій для епідеміологічних досліджень людей похилого віку (EPESE) показують, що навіть втрата 10% і більше загальної маси тіла у віці від 50 до 67 років пов'язана зі збільшенням смертності на 60% порівняно з особами зі стабільною вагою [ 8]. У спеціалізованих мешканців будинків престарілих втрата 10% загальної маси тіла протягом 6-місячного інтервалу суворо передбачала смертність протягом наступних 6 місяців [9]. У мешканців, які втратили щонайменше 5% маси тіла, повідомлялося про 5–10-кратний підвищений ризик смерті [10]. Вікова втрата м’язової маси, здається, є досить постійною і становить приблизно 1–2% на рік у віці старше 50 років [11]. Це зниження м’язової маси відбувається як у малорухливих, так і у активних людей, що старіють [6]. На відміну від цього, у здорових молодих людей не спостерігається чистої зміни швидкості синтезу та деградації білка. Хоча наслідки старіння на скелетних м'язах неминучі, незрозуміло, ці внутрішні зміни є незмінними чи оборотними.
РЕМОНТ МІСЦЕВ СКЕЛЕТА
Реакція супутникової клітини на міотравму (адаптована за [86]). Спокійні клітини-супутники в м’язах дорослих характеризуються експресією Pax7. При пошкодженні або навантаженні клітини-супутники активуються і діляться асиметрично, тим самим генеруючи клітину, що самовідновлюється, і відданий родоначальник, який починає виражати м’язовий регуляторний фактор Myf5. Клітини, що експресують Myf5, вступають у клітинний цикл, проходять раунди проліферації, перетворюючись на міобласти, що експресують MyoD, які згодом експресують міогенін і знижують регуляцію Pax7. Цей пул клітин буде диференціюватись і зливатися, утворюючи нові міофібри під час регенерації м’язів дорослих.
ЕПІГЕНЕТИЧНІ ЗМІНИ: ПІВОТАЛЬНИЙ МЕХАНІЗМ ДЛЯ РЕГУЛЮВАННЯ СУПУТНИХ КЛІТИН У РЕГЕНЕРАЦІЇ СКЕЛЕТНИХ М'ЯЗІВ ПІД ВІД СТАРІННЯ?
Вікові зміни стовбурових клітин та їх середовища можна розділити на дві групи: незворотні проти оборотні (табл. 2 2 ) [30]. Незворотні пошкодження старіючих стовбурових клітин включають внутрішні зміни, які можуть бути пов'язані з пошкодженням ядерної/мітохондріальної ДНК та укороченням теломер, які раніше були детально розглянуті [30-35]. На відміну від цього, зміни системного та місцевого середовища сигналізації, які також відбуваються під час старіння, можуть бути оборотними.
Таблиця 2.
Механізми старіння супутникових стовбурових клітин: незворотні та оборотні зміни [30]
| Сигнальні шляхи | |
| Пошкодження ДНК | Активність фактора транскрипції |
| Ерозія теломерів | Хроматин штат |
| Мітохондріальна дисфункція | Метилювання ДНК |
Вважається, що вікові зміни дорослих стовбурових клітин, таких як м’язові клітини-супутники, сильно впливають на фактори зовнішнього середовища під час старіння. Як обговорювалося вище, відсутність регулярних фізичних навантажень (сидячий спосіб життя), зміни ендокринної функції (інсулін, тестостерон, гормон росту, кортизол)/сигналізація про фактор росту, втрата нервово-м’язової функції (денервація або реіннервація), зміна білкового обміну ( дефіцит між синтезом білка проти деградації), харчуванням (переважно амінокислотами), апоптозом та хворобами чи травмами (табл. 1 1 ) [2, 6] може впливати на скелетні м'язи та здатність активації клітин-супутників, що припускає, що вікові залежності змін можуть бути оборотними в цих тканинах, а зменшена регенеративна здатність старіючих скелетних м'язів може бути наслідком старіння скелетного середовища на функцію клітин-супутників а не в основному внутрішнє старіння.
Отже, якщо екологічні ознаки справді грають ключову роль у роботі стовбурових клітин, варто розглянути механізми, за допомогою яких епігенетична модифікація може опосередковувати ці реакції. „Епігенетика”, у суворому визначенні цього терміна, - це вивчення фенотипових чи генних експресійних моделей, що успадковуються через поділ клітин, які не залежать від послідовності ДНК [36]. Зовсім недавно було запропоновано більш широке визначення епігенетики як динамічної регуляції експресії генів за допомогою незалежних від послідовності механізмів, що включає зміни в метилюванні ДНК та модифікації гістонів [37-39]. У наступному розділі цього огляду ми обговорюємо епігенетичну регуляцію супутникових стовбурових клітин із особливим акцентом на регуляцію стану хроматину хроматино-модифікуючими комплексами та роль метилювання ДНК, що є ключовою для проліферації та злиття супутникових стовбурових клітин. Ми припускаємо, що епігенетичні механізми можуть координовано контролювати програми експресії генів стовбурових клітин дорослих під час старіння, і що інтегровані екологічні подразники, що викликають зміни в стовбурових клітинах за рахунок метилювання хроматину та ДНК, можуть бути оборотними і, таким чином, ідеально розташованими як молекулярні ефекти омолодження клітин-супутників 'та регенерація м'язів.
РЕМОДЕЛЮВАННЯ ХРОМАТИНУ В СУПУТНИХ КЛІТИНАХ
При визначенні мережі факторів транскрипції, що беруть участь в активації, проліферації та диференціації клітин супутникових клітин, стало очевидним, що беруть участь різні елементи епігенетичного та хроматинового механізмів. На молекулярному рівні ДНК обертається навколо нуклеосоми, що складається з ядра з чотирьох білків гістонів (гістон 2А, 2В, 3 і 4) (рис. 3 3 ) з утворенням хроматину, який не тільки відіграє роль у хромосомній стабільності, але й регулює експресію оточуючих генів [40]. Механізми експресії генів, регульованих гістоном, можна віднести до посттрансляційних модифікацій хвостів гістонів [40]. Ці модифікації, або „епігенетичні мітки“, включають метилювання, ацетилювання, сумоилювання та фосфорилювання залишків амінокислот у хвостах гістону. Тип мітки та амінокислотний залишок, який мічений, є ключовими детермінантами активації транскрипції або репресії [40].
Розташування нуклеосоми. Хвости гістону, що виступають із субодиниць нуклеосом, дозволяють приєднувати хімічні групи. Метильні групи щільніше конденсують нуклеосоми, запобігаючи транскрипції генів. Ацетилювання послаблює упаковку нуклеосом, піддаючи ДНК РНК-полімеразі та факторам транскрипції, які активують гени.
МЕТИЛУВАННЯ ДНК У СУПУТНИХ КЛІТИНАХ
На додаток до посттрансляційної модифікації гістонів, метилювання динуклеотиду CpG є основним джерелом епігенетичної інформації, а метилювання промоторів, що містять CpG, пригнічує експресію специфічних генів. Метилювання ДНК переважно відбувається в положенні С5 цитозину (рис. 4 4 ) в контексті ХГ, утворюючи незначні основи, 5-метилцитозини, які становлять приблизно 1% у геномі ссавців [56, 57].
- Корекція індукованої дієтою гіперглікемії, гіперінсулінемії та резистентності до інсуліну скелетних м’язів
- Вплив фізичної активності та втрати ваги на мітохондрії скелетних м'язів та взаємозв'язок з ними
- Міркування щодо належного використання релаксантів скелетних м’язів для лікування гострого низького рівня
- Огляд електричної стимуляції м’язів; Я спробував електричну стимуляцію м’язової терапії для відновлення після тренування
- ЕЛЕКТРИЧНА СТИМУЛЯЦІЯ М’яЗІВ - Маріон Міцці