Себорейні кератози та важка гіпоінсулінемічна гіпоглікемія, пов’язана з інсуліном, збільшують секрецію фактора 2 злоякісною одиночною фіброзною пухлиною
Анотація
Рідкісною ознакою деяких злоякісних пухлин є раптове виверження множинних себорейних кератозів, що називається ознакою Лезера-Трелата. Перевиробництво інсуліноподібного фактора росту-2 (IGF2) або його попередника є основним механізмом, пов’язаним з гіпоглікемією пухлини не острівцевих клітин. Синдром Дое-Поттера - це назва паранеопластичної гіпоінсулінемічної гіпоглікемії за наявності одиночної фіброзної пухлини. У цьому звіті описується випадок пацієнта з гіпоінсулінемічною гіпоглікемією та ознакою Лезера-Трелата, пов’язаної зі злоякісною одиночною фіброзною пухлиною із секрецією IGF2. Обидва стани покращилися після висічення пухлини.
Передумови
Шкірну морфологію можуть модифікувати ендокринні та метаболічні захворювання, а ураження шкіри можуть служити вікном для ранньої діагностики та лікування різних гормоносекретуючих пухлин [1]. Прикладом може служити раптове виверження множинного себорейного кератозу, що називається ознакою Лезера-Трелата, і воно більше пов’язане з аденокарциномами, хоча може бути пов’язане з іншими пухлинами, що свідчить про гірший прогноз [2].
Різні пухлини можуть викликати гіпоглікемію. Серед пухлинної етіології найчастішою причиною є інсулінома [3]. Тим не менше, інші пухлини, не пов'язані з β-клітиною, можуть викликати гіпоінсулінемічну гіпоглікемію, виробляючи фактор росту інсуліну-2 (IGF2) або його попередник, названий великим-IGF2 [3–7]. Синдром Дое-Поттера - це паранеопластична гіпоглікемія, спричинена одиночною фіброзною пухлиною [8, 9]. Це рідкісне новоутворення може виділяти попередник IGF2, який є pro-IGF2 або великим IGF2 [9, 10].
Цей випадок описує 81-річного чоловіка без діабету, який мав ознаку Лезера-Трелата та гіпоглікемію, вторинну ретроперитонеальній злоякісній одиночній фіброзній пухлині.
Клінічний випадок
81-річний чоловік із первинним гіпотиреозом скаржився на симптоми, що свідчать про гіпоглікемію протягом 6 місяців, з поступовим погіршенням і болями в животі. Він повідомив про швидко прогресуючу появу коричнево-бородавчастих ушкоджень у всьому тілі, одне з яких вже біоптовано (себорейні кератози).
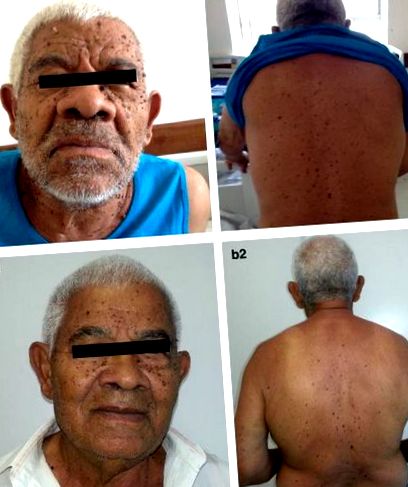
При фізичному огляді він продемонстрував, як важливо, акромегалоїдне обличчя, коричневі бородавчасті ураження на обличчі, тулубі та верхніх кінцівках (рис. 1а) та відчутну масу в правому фланзі. Гематологічна, функція нирок та печінки, оцінка електролітів крові та сироваток були в межах норми. Розвиток його етіології гіпоглікемії наведено в таблиці 1.
Знак Лезера-Трела. Множинні ураження на обличчі (a) і спина пацієнта (b) сумісний із себорейними кератозами
Його магнітно-резонансна томографія на черевній порожнині показала забрюшинну експансивну масу діаметром 18,6 см, надзвичайно закриту для великих черевних судин (рис. 2). Далекі метастатичні ураження були виключені за допомогою томографічного скринінгу.
Одиночна фіброзна пухлина цього пацієнта. a Поява МРТ маси в корональному площині показує 18,6 см в максимальному діаметрі. b МРТ-Т2-зважене зображення в сагітальній області площині демонструє заочеревинне розташування пухлини. c контрастна МРТ поперечна площині вказує на часточкову пухлину з твердими та кістозними компонентами. d На фотографії розрізаного зразка вагою 1,5 кг представлені дві вузликові маси розмірами 14,3 та 13 см з неправильною формою та з'єднані фіброадипозитною тканиною. Були великі ділянки некрозу
Для тестування пухлинної продукції IGF2 були зібрані: гормон росту (GH), IGF1 та IGF2 (радіоімуноаналіз), що підтверджує гіпотезу (табл. 1).
Протягом 2-місячного періоду очікування перед операцією було призначено дробову дієту, пероральний преднізон (30 мг/добу) плюс внутрішньовенну інфузію розчину глюкози протягом доби зі спорадичними епізодами легкої гіпоглікемії. На час операції було проведено резекцію інкапсульованої пухлини (рис. 2). Гістопатологічний та імуногістохімічний аналіз підтвердив злоякісну солітарну фіброзну пухлину.
Пацієнт продемонстрував хороше відновлення здоров’я, його направили додому та в амбулаторне спостереження без гіпоглікемічних кризів та на пероральне лікування преднізолоном, яке було припинено через 6 місяців.
За призначенням амбулаторної клініки він не посилався на гіпоглікемічні епізоди, а його акромегалоїдні особливості та шкірні ураження мали інволюцію (рис. 1б). Він розпочав місцеву променеву терапію, але новий томографічний скринінг показав легеневі вузли, що свідчать про метастатичну хворобу, хоча подальшої гіпоглікемії він не виявляв. Пацієнт прийняв рішення про паліативну допомогу і помер через 18 місяців після встановлення діагнозу.
Обговорення
Гіпоглікемію пухлин, що не є острівцевими, слід запідозрити у будь-якого пацієнта з тріадою Уіппла та гіпоінсулінемічною гіпоглікемією [4], оскільки кілька захворювань, дефіцит гормонів та прийом алкоголю були виключені [1, 11]. У цього пацієнта була пальпувана пухлина та прогресуючі ураження шкіри, що сприяло пухлинній етіології [3, 4, 7, 12].
Наявність себорейного кератозу сприяло підозрі на неопластичний синдром у цього пацієнта. Ця рідкісна ситуація [13] через пухлину відома як знак Лезера-Трелата. Перший опис походить від 1956 року Голландером [2, 14]. Себорейний кератоз зазвичай виглядає як чорні або коричневі бородавчасті папули, різко окреслені, з 3 мм переважно на грудях і спині. Це ознака старілості, але еруптивна та різка форма може бути наслідком запальних захворювань шкіри, побічної реакції на ліки або паранеопластичного синдрому [14, 15]. Ураження з’являються в основному на грудях і спині, більші за звичайні, і вже наявні ураження можуть збільшуватися в розмірах [12].
Частіше (68%) стан шкіри передує діагностиці пухлини [12, 13, 16], і це є результатом вивільнення факторів росту пухлини [12]. Найчастішими пухлинами є аденокарциноми, але описані інші пухлини [2, 16]. Найкращим методом лікування є резекція пухлини, але реакція шкіри змінюється [13]. Хоча саме патогенез не визначений, він включає цитокіни, що виробляються новоутвореними клітинами, як IGF1 та епідермальний фактор росту, які діють на поверхні клітин епідерми [16].
У половини пацієнтів з гіпоглікемією пухлин, що не є острівцевими, гіпоглікемія настає після виявлення пухлини [5], а гіпоглікемія натще та невроглікопенічні симптоми частіше зустрічаються. Ця пухлина найчастіше діагностується на п’ятому чи шостому десятиліттях життя, і симптоми можуть бути присутніми за кілька тижнів або місяців до неї [1, 3, 4, 6, 7, 12]. Втрата ваги, відчутна маса та біль - основні клінічні прояви. У рідкісних пацієнтів є акромегалоїдні особливості [3, 7]. Вперше він був описаний у 1929 р., Але лише в 1988 р. Він був пов’язаний з виробництвом IGF2 [3, 7, 17, 18].
Зазвичай 80% циркулюючого зрілого IGF2 залишається неактивним, зв’язаний з інсуліном, як зв’язуючий фактор росту білок 3 (IGFBP3), та кислотно лабільною субодиницею [7, 19–21]. У пацієнтів з пухлиною не острівцевих клітин пул великого IGF2 збільшується, і 80% цієї молекули обмежується лише IGFBP3, утворюючи нижчу молекулярну масу, яка перетинає ендотеліальний бар'єр і діє на рецептори інсуліну [4, 7, 20, 22 ].
Збільшення поглинання глюкози, зниження секреції інсуліну та глюкагону, зниження ліполізу та глюконеогенезу печінки - це деякі ефекти масивної секреції IGF2, що призводять до гіпоглікемії [3, 5]. Аутокринна та паракринна дія також сприяє росту пухлини. Великий IGF2 пригнічує секрецію GH, і це спричинює зменшення синтезу IGF1, IGFBP2 [1, 3, 18, 20], збільшуючи біодоступність IGF2 [1, 3, 4, 6, 20, 22].
Лабораторні дослідження можуть показати нормальний рівень IGF2, але підвищений коефіцієнт IGF2/IGF1. Співвідношення до трьох вважається нормальним; якщо він вище десяти, за наявності некетотичної гіпоглікемії та пригніченого ГР, повідомляється, що він є фактично патогномонічним для гіпоглікемії пухлини не острівцевих клітин [7, 9, 11]. Вимірювання вільного IGF2 або його попередників не є широко доступними, але відомо, що вільний IGF2 та співвідношення pro-IGF2/IGF1 збільшуються [1, 3, 4, 9]. Наявність нижчих рівнів GH та IGF1 та позитивна відповідь на тест на стимуляцію глюкагоном може підтримати діагностику, коли аналізи IGF2 недоступні [4].
Пухлини, як правило, великі та добре диференційовані, мають епітеліальне або мезенхімальне походження, повільно ростуть, виникаючи в грудній клітці, малому тазу або заочеревині [1, 3, 6]. Найбільш поширеною епітеліальною пухлиною є гепатоцелюлярна карцинома, а мезенхімальною є фібросаркоми та одиночна фіброзна пухлина [3, 5, 7, 10, 23]. Останнє є рідкісним новоутворенням, широко поширеним, за участю плеври, легенів, органів малого тазу та черевної порожнини або заочеревини [9, 10, 23]. Це впливає на чоловіків і жінок однаково, 50% випадків були безсимптомними, а більшість виявлялися як випадкові захворювання при діагностиці. Найбільш симптоматичні пухлини мають позагрудну локалізацію та масові ефекти (затримка сечі, тромбоз вен та біль у животі) [23].
Одиночна фіброзна пухлина зазвичай проходить доброякісний клінічний перебіг, хоча в деяких випадках великих пухлин може спостерігатися прогрес з віддаленими метастазами або місцевим рецидивом. Позагрудне розташування, паранеопластична гіпоглікемія, позитивні межі, висока клітинність та мітотична активність, некроз та ядерний плеоморфізм є провісниками гіршого клінічного результату [10, 23].
Про гіпоглікемію внаслідок одиночної фіброзної пухлини вперше повідомили Додж і Поттер у 1929 р. З тих пір ця знахідка називається синдромом Дое-Поттера, але дуже рідкісна (менше 5% всіх одиночних фіброзних пухлин) [8–10]. Серед 79 випадків одиничних фіброзних пухлин, про які повідомляють Jason et al. лише двоє представили гіпоглікемію [23].
Незалежно від гістології, хірургічна резекція є терапією вибору. Повна хірургічна резекція розв'язує гіпоглікемію [3, 7, 9, 24] і відміняє випадки фенотипу акромегалоїдів [4]. Коли повна резекція неможлива, техніка розвінчання може бути використана для покращення гіпоглікемії або повного її вирішення в деяких випадках [7]. Ад'ювантна терапія, така як емболізація пухлини, променева терапія або хіміотерапія, може принести успіх в інших випадках [3, 7].
Короткотермінові заходи щодо уникнення гіпоглікемії включають споживання кортикоїдів, глюкагону, діазоксиду та глюкози. Коли після хірургічного втручання гіпоглікемія зберігається, застосовуються різні медичні методи. Хоча багато з цих пухлин мають рецептори соматостатину, використання аналогів не було ефективним для контролю гіпоглікемії, і сцинтиграфія аналога соматостатину не могла передбачити відповідь на лікування [3].
Є багато повідомлень про успішне лікування рекомбінантним гормоном росту, хоча він не нормалізує рівень IGF2. Тим не менше, ця терапія є дорогою, вимагає високих доз та має багато несприятливих наслідків [4, 12]. Його використання слід уникати, коли є акромегалоїдні властивості [4].
Найкращий варіант клінічного лікування - використання глюкокортикоїдів з негайним впливом на гіпоглікемію в дозах, еквівалентних 30–60 мг/добу преднізону [3, 4]. Помірні та високі дози також можуть сприяти зменшенню пухлини [7]. Це єдине медичне лікування, яке може придушити вироблення пухлини IGF2, що призводить до нормального рівня С-пептиду, інсуліну та глюкози [7, 14].
Згідно з оглядом англійської літератури, ознака Лезера-Трелата та гіпоінсулінемічна гіпоглікемія одиночною фіброзною пухлиною надзвичайно рідкісні. Тріада Уіппла та гіпоінсулінемічна гіпоглікемія з низьким рівнем GH та IGF1 дозволяють припустити діагноз, а підвищення рівня IGF2/IGF1 підтверджує. Через кілька тижнів після операції пацієнт продемонстрував ремісію гіпоглікемії без використання глюкокортикоїдів та поліпшення себорейного кератозу та особливостей акромегалоїдів.
Список літератури
Ngonga GF, Ferrari D, Lorusso L, Gasparetto C, Neznama E, D’Abramo M, Ricevuti G. Паранеопластичні синдроми: теорії патогенетики, клінічні аспекти та терапевтичний підхід. Ann Ital Med Int. 2005; 20 (1): 28–38.
Бартоло Р.М., Бартоло Т.П., Флоріао Р.А. Leser-Trélat - Um sinal clínico revisitado. Pulmão RJ. 2009; 18 (1): 53–6.
Динкевич Ю, Ротер К.І., Вітфорд І та ін. Пухлини, IGF-2 та гіпоглікемія: дані клініки, лабораторії та історичного архіву. Endocr Rev. 2013; 34 (6): 798–826.
Bodnar TW, Acevedo MJ, Pietropaolo M. Лікування гіпоглікемії пухлини не-острівцевих клітин: клінічний огляд. J Clin Ендокринол Метаб. 2014; 99 (3): 713–22.
Іглесіас П, Діес Дж. Клінічне оновлення щодо індукованої пухлиною гіпоглікемії. Eur J Ендокринол. 2014; 170 (4): R147–57.
Hizuka N, Fukuda I, Takano K, Asakawa-Yasumoto K, Okubo Y, Demura H. Сироваткова високомолекулярна форма інсуліноподібного фактора росту у пацієнтів з гіпоглікемією пухлин неклітинних клітин о-глікозильована *. J Clin Ендокринол Метаб. 1998; 83 (8): 2875–7.
Dutta P, Aggarwal A, Gogate Y, et al. Гіпоглікемія, спричинена пухлиною, яка не є острівцевою: звіт про п’ять випадків та короткий огляд літератури. Endocrinol Diabetes Metab Case Rep.2013, 2013: 130046.
Roy TM, Burns MV, Overly DJ, Curd BT. Одиночна фіброзна пухлина плеври з гіпоглікемією: синдром Доежа-Поттера [реферат]. J Ky Med доц. 1992; 90 (11): 557–60.
Schutt RC, Gordon TA, Bhabhra R, et al. Синдром Дое-Поттера із гіпоінсулінемічною гіпоглікемією у пацієнта зі злоякісною екстраплевральною одиночною фіброзною пухлиною: випадок захворювання. J Med Case Rep.2013; 7 (1): 1.
Хаджу М, Співак С, Макі Р.Г., Шварц Г.К., Кеохан М.Л., Анонеску КР. Надмірна експресія IGF2 в одиночних фіброзних пухлинах не залежить від анатомічного розташування і пов’язана з втратою імпринтингу. Дж. Патол. 2010; 221 (3): 300–7.
Teale JD, Marks V. Невідповідно підвищений інсуліноподібний фактор росту II у плазмі крові у порівнянні з пригніченим інсуліноподібним фактором росту I у діагностиці гіпоглікемії пухлини не острівцевих клітин [реферат]. Клін Ендокринол. 1990; 33 (1): 87–98.
Mohammedi K, Khalil CA, Olivier S, Benabad I, Roussel R, Marre M. Паранеопластична гіпоглікемія у пацієнта зі злоякісною солітарною фіброзною пухлиною. Endocrinol Diabetes Metab Case Rep.2014, 2014: 140026.
Husain Z, Ho JK, Hantash BM. Знак та псевдо-знак Лезера-Трела: повідомлення про випадки та огляд літератури [реферат]. J Препарати Дерматол. 2013; 12 (5): e79–87.
Baxter RC, Holman SR, Corbould A, Stranks S, Ho PJ, Braund W. Регуляція інсуліноподібних факторів росту та їх зв'язуючих білків глюкокортикоїдами та гормоном росту при гіпоглікемії пухлин неклітинних клітин [реферат]. J Clin Ендокринол Метаб. 1995; 80 (9): 2700–8.
Eastman KL, Knezevich SR, Raugi GJ. Еруптивні себорейні кератози, пов’язані із застосуванням адалімумабу. J Dermatol Case Rep. 2013; 7 (2): 60–3.
Silva JA, Mesquita Kde C, Igreja AC, et al. Паранеопластичні шкірні прояви: концепції та оновлення. Дерматол бюстгальтерів. 2013; 88 (1): 9–22.
Nadler WH, Wolfer JA. Гепатогенна гіпоглікемія, пов’язана з первинною клітинною карциномою печінки [реферат]. Arch Intern Med. 1929; 44 (5): 700–10.
Mohammedi K, Khalil CA, Olivier S, Benabad I, Roussel R, Marre M. Синтез та секреція інсуліноподібного фактора росту ii лейоміосаркомою з асоційованою гіпоглікемією [реферат]. N Engl J Med. 1988; 319: 1434–40.
Marks AG, Carroll JM, Purnell JQ, Roberts CT Jr. Діяльність плазми та сигналізація попередників IGF-II. Ендокринологія. 2011; 152 (3): 922–30.
Miraki-Moud F, Grossman AB, Besser M, Monson JP, Camacho-Hüber C. Швидкий метод аналізу сироваткового проінсуліноподібного фактора росту-II у пацієнтів з неізолетково-клітинною пухлинною гіпоглікемією. J Clin Ендокринол Метаб. 2005; 90 (7): 3819–23.
Tsuro K, Kojima H, Okamoto S, et al. Глюкокортикоїдна терапія покращила гіпоглікемію при одиночній фіброзній пухлині, що продукує інсуліноподібний фактор росту-II. Інтерн Мед. 2006; 45 (8): 525–9.
Steigen SE, Schaeffer DF, West RB, Nielsen TO. Експресія інсуліноподібного фактора росту 2 в мезенхімальних новоутвореннях. Мод Патол. 2009; 22 (7): 914–21.
Gold JS, Antonescu CR, Hajdu C, et al. Клінікопатологічні кореляти одиночних фіброзних пухлин. Рак. 2002; 94 (4): 1057–68.
Alkemade GM, Bakker M, Rikhof B, et al. Гіпоглікемія у пацієнта з великою «великою» пухлиною, що продукує -IGF-II. J Clin Ендокринол Метаб. 2013; 98 (8): 3113–4.
Внески авторів
Всі автори були залучені до обслуговування пацієнтів під час госпіталізації. Вони оцінили діагноз, обговорили клінічне ведення та обстежили іспити, необхідні для остаточного діагнозу. ALGM був першим ендокринологом, з яким звернулися під час госпіталізації пацієнтів. Крім того, вона провела огляд літератури та склала цей рукопис. ДМ надав медичну підтримку пацієнту, а також сприяв отриманню необхідних іспитів. Вона також зібрала медичні записи для цього звіту про клінічний випадок. SAD переглянув цей рукопис. JRS координував ведення пацієнта та керував кроками для підтвердження діагнозу. Він брав участь у перегляді цього рукопису. Усі автори стежили за еволюцією пацієнта та затверджували остаточну версію цього рукопису.
Інформація про автора
Приналежності
Ендокринологічний відділ, Ескола Пауліста де Медицина, Федеральний університет Сан-Паулу, Сан-Паулу, Іспанія, Бразилія
Андрія Латанца Гомес Матес, Дебора Морото, Серхіо Атала Діб і Жоао Роберто де Са
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
- Ожиріння та резистентність до інсуліну пов'язані зі зниженням активності в основних областях пам'яті
- Себорейний кератоз Діагностика та лікування
- Себорейні кератози - аюрведична дієта та природні домашні засоби
- Важка спруеподібна ентеропатія, пов’язана з Олмесартаном - ScienceDirect
- Короткочасне годування кетогенною дієтою викликає більш серйозну печінкову резистентність до інсуліну, ніж