Роль гіпертрофії адипоцитів та гіпоксії у розвитку запалення жирових тканин та стійкості до інсуліну, пов’язаних із ожирінням
Пей-Чі Чан та По-Шиуан Ся
Подано: 17 травня 2016 р. Переглянуто: 31 серпня 2016 р. Опубліковано: 22 березня 2017 р
Анотація
Ключові слова
- адипоцит
- гіпертрофія
- гіпоксія
- запалення жирової тканини
- резистентність до інсуліну
інформація про главу та автора
Автори
Пей-Чі Чан
- Національний оборонний медичний центр, Інститут фізіології, Тайбей, Тайвань
По-Шиуан Ся *
- Національний оборонний медичний центр, Інститут фізіології, Тайбей, Тайвань
* Адресуйте всю кореспонденцію за адресою: [email protected]
З редагованого тому
За редакцією Яна Оксгольма Горделадзе
1. Вступ
Вважається, що запалення жирової тканини має вирішальне значення у патологічних механізмах серцево-судинних ускладнень, пов’язаних із ожирінням, включаючи резистентність до інсуліну, діабет 2 типу, атеросклероз та неалкогольну жирову хворобу печінки (НАЖХП). Однак основні механізми цього процесу все ще розслідуються.
Адипоцити в умовах ожиріння, особливо при захворюванні ожирінням, характеризуються гіпертрофією та гіпоксією, і вони є важливими джерелами ініціалізації запалення жирової тканини. Це запалення опосередковується утворенням великої кількості цитокінів та хемокінів, включаючи фактор некрозу пухлини-α (TNF-α), інтерлейкін-6 (IL-6), хемотаксичний білок-1 моноцитів (MCP-1) та регулюється при активації, експресована та секретована Т-клітина (RANTES). Ці цитокіни та хемокіни, що виробляються адипоцитами під час гіпертрофії та гіпоксії, суттєво сприяють розвитку запалення жирової тканини, пов’язаного з ожирінням. Здатність конститутивного та регульованого вивільнення імунних медіаторів з адипоцитів демонструє причинно-наслідковий зв'язок між біологією адипоцитів та імунними клітинами, такими як макрофаги та Т-клітини. Більше того, передбачається, що взаємодія гіпертрофічних, адипоцитів гіпоксиї та імунних клітин жирової тканини відіграє ключову регуляторну роль у розвитку інсулінорезистентності, спричиненої ожирінням.
Цей огляд пропонує оновлені докази, які підкреслюють важливу роль гіпертрофії та гіпоксії адипоцитів у розвитку запалення жирової тканини (АТ), пов'язаного з ожирінням, та резистентності до інсуліну, а також обговорює можливий механізм.
2. Основні предмети
2.1. Запалення жирової тканини вирішально сприяє патогенезу асоційованої з ожирінням резистентності до інсуліну та цукрового діабету 2 типу (ЦД)
З іншого боку, надлишкове накопичення жиру сприяє вивільненню вільних жирних кислот з жирової тканини в кровообіг і впливає на багато інших тканин, включаючи печінку, скелетні м’язи та серце. [11]. Згубний вплив жирних кислот та їх метаболітів, таких як ацил-кофермент А, кераміди та діацигліцерин, на передачу сигналів інсуліну через активізуючі протеїнкінази, такі як протеїнкіназа С, мітоген-активовані протеїнкінази (MAPK), c-Jun N-термінал повідомляється про кіназу (JNK) та інгібітор ядерного фактора κβ-кінази B [12]. Більш того, вільні жирні кислоти служать лігандами для комплексу Toll-подібного рецептора 4 (TLR4) [13] і стимулюють вироблення цитокінів макрофагів [14], модулюючи тим самим запалення жирової тканини, що також суттєво сприяє метаболічним ускладненням, пов’язаним з ожирінням.
2.2. Розвиток гіпертрофії адипоцитів та гіпоксії при запаленні жирової тканини
Жирова тканина може швидко і динамічно реагувати на зміни дефіциту та надлишку поживних речовин через гіпертрофію адипоцитів та гіперплазію [15]. Особливо при хворобливому ожирінні, на відміну від розширення жирової тканини при ожирінні здоров’я, що полягає у збільшенні жирової тканини за рахунок ефективного набору клітин адипогенних попередників до адипогенних програм, патогенне розширення жирової тканини складається з масивного збільшення існуючих адипоцитів та обмеженого ангіогенезу та забезпечення гіпоксія [16]. Наприклад, адипоцити стають гіпертрофічними під час розвитку ожиріння, і їх розмір збільшується до 140–180 мкм в діаметрі, але межа дифузії кисню становить не більше 100 мкм [17]. З іншого боку, не виключено, що кровопостачання адипоцитів може зменшитися під час прогресивного збільшення адипоцитів з наступною гіпоксією [18].
2.3. Гіпотеза та докази впливу гіпертрофії і гіпоксії адипоцитів на розвиток запалення жирової тканини та резистентності до інсуліну
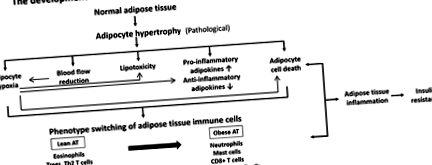
Недавні дослідження показали, що жирова тканина під час розвитку патологічного ожиріння характеризується гіпертрофією адипоцитів з подальшою гіпоксією, інфільтрацією імунних клітин та прозапальними адипоцитокінами під час прогресування хронічного запалення. Крім того, супутній розвиток зниженої перфузії кровотоку, ліпотоксичності та загибелі клітин адипоцитів також ще більше погіршить прогрес запалення жирової тканини (рис. 1).
Фігура 1.
Розвиток нездорового ожиріння та резистентності до інсуліну.
2.3.1. Вплив гіпертрофії адипоцитів на гіпоксію жирової тканини
Ожиріння як надлишок жирової тканини пояснюється гіпертрофією та гіперплазією адипоцитів. Адипоцити мають обмежену здатність до гіпертрофії. Одним із пояснень вважається межа дифузії кисню, який становить не більше 100 мкм [17]. Тому не виключено, що гіпертрофічні адипоцити можуть витримувати менше достатнього надходження кисню. З іншого боку, було продемонстровано, що гіпоксія ожиріних мишей може виникати в зонах усередині жирової тканини в результаті гіпертрофії адипоцитів, що порушує ефективне надходження O2 із судин, а потім ініціює запальні реакції, зазначені аддукцією гідрохлориду пімонідазолу (речові докази) а також концентрація лактату (фізіологічні дані) [19]. Більше того, також повідомлялося, що гіпоксія призводить до запалення жирової тканини та резистентності до інсуліну in vitro та в дослідженнях на тваринах [19–21].
Гіпоксія здатна викликати запалення в жировій тканині шляхом індукції експресії генів, пов'язаних з гіпоксією, в адипоцитах і макрофагах. Важливим і добре охарактеризованим ключовим регулятором адаптаційної реакції на зміни напруги кисню є індукований гіпоксією фактор-1a (HIF-1α), фактор транскрипції, який накопичується під час гіпоксії та активує шляхи ядерного фактора-ββ, що призводить до посилення запалення та стимуляція ангіогенезу [19].
Слід зазначити, що індукований гіпоксією фактор-1a (HIF-1α), який відіграє ключову роль у відповіді на гіпоксію [20], розглядається як головний регулятор гомеостазу O2. HIF-1α був виявлений в жировій тканині людини і, як повідомляється, збільшується при ожирінні [21]. Крім того, кілька досліджень на гризунах показали, що підвищена експресія генів HIF-1α, більше гіпоксичних ділянок та нижчий рівень PO2 були виявлені в білій жировій тканині ob/ob, KKAy та індукованих дієтою мишей з ожирінням [22–24]. Знижена напруга кисню безпосередньо вимірюється в жирових депо із ожирінням у моделей мишей та у людей [23]. Також було доведено, що надмірна експресія HIF-1α в адипоциті є більш профібротичною та прозапальною, ніж проангіогенна [25]. Специфічна для адипоцитів делеція HIF-1α обмежувала індуковане жирною тканиною запалення жирової тканини та резистентність до інсуліну, і тканина була однаково васкуляризована як контролери дикого типу [26]. Таким чином, посилення експресії HIF-1α може сприяти локалізованому запаленню жирової тканини, яке поширює загальне системне запалення, пов’язане з розвитком супутніх захворювань, пов’язаних з ожирінням [27].
2.3.2. Вплив гіпертрофії адипоцитів на вироблення вільних жирних кислот (ліпотоксичність)
Тим не менше, збільшення потоку жирних кислот у жирові клітини також призводить до більшого синтезу FFA у тригліцериди, що призведе до стресу ендоплазматичного ретикулуму (ER), що активує шлях JNK і, таким чином, додатково збільшує резистентність до інсуліну в жирових клітинах [31].
2.3.3. Вплив гіпертрофії адипоцитів на зменшення кровотоку жирової тканини
Зростаюча жирова маса, зокрема жирова тканина черевної порожнини, пов’язана з несприятливими змінами кровотоку жирової тканини та розвитком метаболічних розладів у стані ожиріння. Зменшений кровотік, що спостерігається у збільшеній жировій масі, може в основному пояснюватися розвитком гіпертрофії адипоцитів.
Зниження перфузії жирової тканини є загальною ознакою ожиріння. Вест та ін. [32] продемонстрували, що приплив крові до жирової тканини, виміряний за допомогою міченої радіомікросферою, зменшився у щурів із цукером із цукером Цукер. У людей рівні кровотоку жирової тканини вимірювали за допомогою позитронно-емісійної томографії з використанням води, позначеної [15 O] [33], та методом вимивання 133 Xe [34], і були нижчими для людей із ожирінням порівняно з людьми, що не страждають ожирінням. Крім того, порушення регуляції кровотоку жирової тканини пов’язані з ожирінням та резистентністю до інсуліну [35]. Це дослідження продемонструвало тісний взаємозв'язок між чутливістю до інсуліну та регуляцією кровотоку жирової тканини після їжі, незалежно від ожиріння. Отже, порушення регуляції кровотоку жирової тканини за рахунок гіпертрофії адипоцитів також може бути вагомим та незалежним фактором для розвитку резистентності до інсуліну у стані ожиріння [35].
2.3.4. Вплив гіпертрофії адипоцитів на загибель адипоцитів
Як зазначалося вище, гіпертрофія адипоцитів може прямо та побічно спричинити гіпоксію адипоцитів. Гіпоксія може бути потенційним фактором ризику загибелі адипоцитів у жировій тканині осіб із ожирінням. Повідомлялося про збільшення смертності адипоцитів у жировій тканині осіб, що страждають ожирінням, і пропонувалось викликати інфільтрацію макрофагів [36]. Клітинна загибель може також сприяти ліполізу та викиду FFA в кров при резистентності до інсуліну. Це суттєво сприятиме збільшенню FFA у плазмі при ожирінні. Більше того, було продемонстровано, що частота загибелі адипоцитів була суттєво пов'язана з експресією жирових генів TNF-α, IL-6 та MCP-1 в жировій тканині та розвитком резистентності до всього організму до інсуліну [37].
Макрофаги надзвичайно вміють виводити численні молекули, починаючи від невеликих ліпідів, закінчуючи колоніями патогенних мікроорганізмів і відмерлих клітин. Некроз адипоцитів, зумовлений гіпертрофією та прискорений ожирінням, є яскраво вираженим фагоцитарним стимулом, який приваблює інфільтрацію макрофагів у жирову тканину [18]. Використовуючи трансгенну тваринну модель індуцибельної ліпоатрофії, Pajvani et al. продемонстрував, що масивна загибель адипоцитів дійсно може спричинити швидке накопичення макрофагів жирової тканини (АТМ) як невід'ємного елемента при реконструкції жирових прокладок [38]. Ці спостереження свідчать про важливу роль гіпертрофії адипоцитів у розвитку загибелі адипоцитів та пов'язаних із цим запальних змін при AT та ускладненні ожиріння.
2.3.5. Вплив гіпертрофії адипоцитів на продукцію адипокінів
Підвищення запальних цитокінів у жирі та циркуляції, таких як TNF-α, IL-1, IL-6, MCP-1 та PAI-1, було задокументовано при ожирінні [23,25,39]. Вважається, що збільшення вироблення адипокіну при гіпертрофії і гіпоксії адипоцитів лежить в основі розвитку запальної реакції в жировій тканині, яка виникає в стані ожиріння [11,40]. Чітко було вказано, що розмір адипоцитів є важливим фактором, що визначає секрецію кількох запальних адипокінів, таких як лептин, IL-6 та MCP-1, забезпечуючи тим самим інший зв'язок між розміром адипоцитів та запаленням при ожирінні [41]. У цьому ж дослідженні спостерігалася тенденція до зменшення вивільнення протизапальних адипокінів, таких як IL-10 та адипонектин, із збільшенням розміру адипоцитів [41].
З іншого боку, гіпоксію було запропоновано викликати етіологію некрозу та інфільтрації макрофагів у жирову тканину, що в подальшому призводить до порушення регуляції виробництва пов'язаних із запаленням адипокінів, таких як лептин, адипонектин, TNF-α, IL-6 та судинний фактор росту ендотелію (VEGF) [40,42]. Нещодавно також повідомлялося, що гіпоксія також індукує продукцію PAI-1 та інгібує синтез адипонектину адипоцитами 3T3-L1 [39]. Також повідомляється, що індукує експресію вісфатину в цих клітинах [43]. Вирази інших основних продуктів виробництва адипокіну з мишачих або людських адипоцитів, включаючи ангіопоетиноподібний білок 4 (Angptl4), інтерлейкін-6 (IL-6), інгібуючий фактор міграції макрофагів (MIF) та VEGF [23, 40, 44] стимулюється гіпоксією. Відповідно, Wang et al. імітували гіпоксію в адипоцитах людини протягом 24 год із використанням хлориду кобальту (CoCl2). Показано, що HIF-1α нарівні з маркерами окисного стресу, маркерами запалення та лептином був підвищений, але навпаки, адипонектин знижувався під час гіпоксії [42].
2.4. Взаємодія адипоцитів при гіпертрофії та гіпоксії та інфільтрованих імунних клітинах при розвитку запалення жирової тканини та ускладнень ожиріння
Гіпертрофія адипоцитів та гіпоксія мають вирішальне значення у запаленні жирової тканини шляхом індукції прозапальних цитокінів, а також хемокінів, які залучають імунні клітини на початку розвитку ожиріння. Давно відомо, що жирова тканина при ожирінні знаходиться в підвищеному стані запалення. Нещодавно це перетворилося на знання про те, що імунні клітини, такі як макрофаги та Т-клітини, можуть проникати в жирову тканину і відповідають за більшість вироблення запальних цитокінів та запалення жирової тканини. Також припускають, що адипоцити можуть діяти як антиген-презентуючі клітини до імунних клітин при запаленні жирової тканини [45].
2.4.1. Макрофаги
Деякі наслідки гіпертрофії адипоцитів включають потік жирних кислот, васкуляризацію, посилену секрецію адипокіну, гіпоксію та загибель клітин адипоцитів. Ці наслідки розширення жирової тканини, пов’язані з адипоцитами, є важливим фактором ініціювання вербування макрофагів при патологічному ожирінні. Інфільтрація макрофагів у запалену жирову тканину виникає внаслідок припливу моноцитів крові, головним чином залучених хемокіном MCP-1, який в основному секретується гіпертрофічними адипоцитами [46]. Макрофаги жирової тканини (АТМ) накопичуються як у підшкірних, так і у вісцеральних депо, що розширюються [46]. Окрім збільшення кількості, макрофаги жирової тканини також фенотипово змінюються під час ожиріння з протизапальних макрофагів М2 на прозапальні макрофаги М1, переважно у мишей із ожирінням [5]. Активовані банкомати M1 є основним джерелом прозапальних цитокінів, таких як TNF-α та IL-6, які можуть блокувати дію інсуліну в адипоцитах за допомогою аутокринної/паракринної сигналізації, а також викликати системну резистентність до інсуліну за допомогою ендокринної сигналізації. Слід зазначити, що виробництво адипокіну під час гіпертрофії адипоцитів та гіпоксії, таких як вільні жирні кислоти та TNF-α, сприяє переходу фенотипу M1 у стані ожиріння [47].
2.4.2. Т-клітини
Крім того, нещодавно виявлені клітини Т-хелперів 17 (Th17) представляють нову підмножину CD4 + Т-клітин, що визначаються їх виробленням інтерлейкіну 17 (IL-17) [54]. Цікаво, що рівень IL-17 у сироватці крові підвищується у пацієнтів із ожирінням людини [55], а ожиріння позитивно корелює з посиленою експресією IL-17 у Т-клітинах, виділених із селезінки [56]. Zúñiga та ін. виявив, що IL-17, що секретується Т-клітинами в жировій тканині, є важливим негативним регулятором адипогенезу шляхом пригнічення експресії декількох проадипогенних факторів транскрипції, включаючи PPAR-γ та C/EBP-α [57], а також метаболізм глюкози до посилюють інсулінорезистентність [58]. Таким чином, підвищена секреція IL-17 клітинами Th17 інгібує диференціювання стовбурових клітин, похідних адипоцитів (ASC), до адипоцитів, а також пригнічує реакцію адипоцитів на інсулін. Елджаафарі та ін. [59] надають інтригуючі докази, використовуючи спільну культуру людських АСК з мононуклеарними клітинами людини (МНК), АСК від донорів із ожирінням посилюють диференціацію наївних CD4 + Т-клітин до клітин Th17 і змінюють фенотип МНК за рахунок посилення секреції IFN-γ клітинами Th17. У сукупності ці спостереження свідчать про важливу роль клітин IL-17 і Th17 у пов’язаній з ожирінням дисфункції жирової тканини та системних ускладненнях.
2.4.3. Інші
Крім того, наше недавнє дослідження [63] також продемонструвало, що передача сигналів PGE2 EP3 під час розвитку гіпертрофії адипоцитів та гіпоксії, опосередкована COX-2, важлива для набору та взаємодії з жировими імунними клітинами для посилення запальних реакцій в жировій тканині, що також є причинно пов'язаний з розвитком системної інсулінорезистентності.
2.5. Механізми регуляції гіпертрофії адипоцитів у розвитку ожиріння
Патогенна зміна гіпертрофії адипоцитів під час ожиріння визначається двома різними процесами ожиріння: диференціацією адипоцитів (адипогенез) та ліпогенезом. Вони залежать як від генетичної схильності, так і від навколишнього середовища. Під час стійкого позитивного споживання калорій гіпертрофія адипоцитів може призвести до дисфункції адипоцитів, тоді як адипогенез порушений [64,65].
З іншого боку, механізми диференціації адипоцитів були широко вивчені в останні десятиліття. Виявлено низку ключових факторів транскрипції та адипокінів у диференціації адипоцитів [66]. Наприклад, вони включають білки сімейства, що активуються проліфератором пероксисоми (PPAR) [67], CCAAT/зв'язуючий енхансер білок (C/EBP) [68], фактор 1, що визначає диференціацію адипоцитів (ADD1) [69], і білки сімейства білків 1, що зв’язують елемент стеролу (SREBP 1) [70]. Крім того, було продемонстровано, що фосфорильований тирозин Dok1 також сприяє гіпертрофії адипоцитів, протидіючи інгібуючому ефекту позаклітинної сигнально-регульованої кінази (ERK) на PPAR-γ [71].
Крім того, стійкий надлишок енергії може полегшити накопичення енергії за допомогою ліпогенезу та гіпертрофії існуючих адипоцитів, ніж за рахунок адипогенезу з набором та диференціацією нових адипоцитів від попередніх. Врешті-решт, це призведе до патологічної гіпертрофії адипоцитів, яка сприяє розвитку запалення жирової тканини та метаболічних розладів, пов’язаних із ожирінням [72,73].
2.6. Терапевтичні наслідки
У цій главі ми обговорюємо нещодавні досягнення щодо ролі адипоцитів у контролі розвитку, росту та реконструкції жирової тканини, пов’язаної з ожирінням. У цій оглядовій статті далі висвітлюється важлива роль адипоцитів під час гіпертрофії та гіпоксії у розвитку запалення жирової тканини та подальшої резистентності до інсуліну. Крім того, розуміння регуляторного механізму гіпертрофії адипоцитів під час розвитку ожиріння може забезпечити кращу стратегію для профілактики та лікування ожиріння асоційованого діабету 2 типу та метаболічного синдрому.
Подяки
Автори високо оцінюють підтримку фінансування Міністерством науки і технологій за грантовими номерами. НАЙБІЛЬШЕ 105-2811-B-016-004 та НАЙБІЛЬШЕ 104-2320-B-016-001; Лікарня загального користування Tri-Service під грантом № TSGH-C104-007-007-S01 на Тайвані.
- Роль ліпопротеїнової ліпази у розвитку жирової тканини та метаболізмі Міжнародний журнал
- Роль карагенану та карбоксиметилцелюлози у розвитку запалення кишечника
- Роль адипонектину в асоційованому з ожирінням канцерогенезі для жінок - ScienceDirect
- Пептид-лептин, пов’язаний з ожирінням, викликає гіпертрофію міоцитів шлуночків новонароджених щурів
- Чому Рут Бадер Гінзбург - це моя рольова модель ALS - Новини ALS сьогодні