Пуринові основи в положенні 37 тРНК стабілізують взаємодію кодон-антикодон у ділянці рибосоми А шляхом укладання та взаємодії, залежної від Mg 2+
АНДРЕЙ Л. КОНЕВЕГА
1 Петербурзький інститут ядерної фізики Російської академії наук, 188300 Гатчина, Росія
НАТАЛІЯ Г. СОБОЛЄВА
1 Петербурзький інститут ядерної фізики Російської академії наук, 188300 Гатчина, Росія
ВАЛЕНТИН І. МАХНО
1 Петербурзький інститут ядерної фізики Російської академії наук, 188300 Гатчина, Росія
ЮРІЙ П. СЕМЕНКОВ
1 Петербурзький інститут ядерної фізики Російської академії наук, 188300 Гатчина, Росія
WOLFGANG WINTERMEYER
2 Інститут молекулярної біології ім
МАРИНА В. РОДНІНА
3 Інститут фізичної біохімії Університету Віттена/Гердеке, 58448 Віттен, Німеччина
ВЛАДИМИР І. КАТУНІН
1 Петербурзький інститут ядерної фізики Російської академії наук, 188300 Гатчина, Росія
Анотація
ВСТУП
Взаємодія між кодоном і антикодоном відіграє центральну роль у розшифровці мРНК на рибосомі. Канонічна структура петлі антикодону є важливою для взаємодії як з А, так і з Р-сайтами (Юсупов та ін., 2001) і зберігається в еволюційному відношенні. Петля антикодону визначається наявністю ряду збережених та напівконсервованих нуклеотидів, які утворюють розширений структурний підпис (Auffinger and Westhof 2001). На 5 ′ кінці петлі піримідинова основа знаходиться в положенні 32, а потім інваріант U в положенні 33. Різні модифіковані нуклеотиди знаходяться в положенні 34, які утворюють пари до положення 3 кодону, тоді як nt 35 і 36, які взаємодіють з положеннями 2 і 1 кодону, відповідно, демонструють лише обмежену кількість модифікацій. Основи в положеннях 37 і 38 - це переважно пурини, які в положенні 37 часто гіпермодифіковані. Аналіз послідовності> 3000 генів тРНК різних організмів показує, що А знаходиться в положенні 37 в
80% та G у 20% усіх тРНК (Sprinzl et al. 1998). В
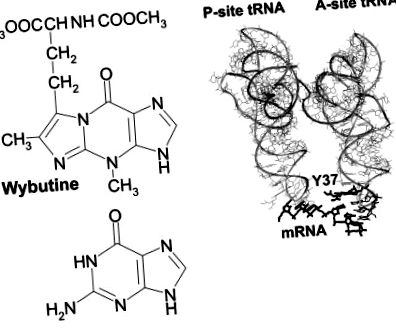
26% тРНК виявлено немодифікованим А; найпоширенішими модифікаціями в положенні 37 є t 6 A і m 1 G. Тип модифікації змінюється залежно від специфіки кодування. Взагалі, тРНК, які мають лише G і C основи в своїх антикодонах, ніколи не мають модифікованого пурину, прилеглого до 3 ′ сторони антикодону, тоді як усі тРНК з принаймні двома основами A або U мають гіпермодифікований пурин у цьому положенні. Наприклад, майже всі фенілаланін-специфічні тРНК (антикодон GAA) мають такі модифікації, найчастіше до вибутину (рис. 1 ▶), пероксивібутину або 2-метилтіо-N 6 -ізопентеніладенину.
(A) Структура основи Y (загальновживаний символ вибутину, систематичний символ yW; База даних модифікації РНК, http://medlib.med.utah.edu/RNAmods) порівняно з G. (B) Розташування бази Y (Y37) у комплексі тРНК дріжджів Phe з U6-мРНК в ділянці A рибосом Thermus thermophilus (Yusupov et al. 2001); Також показана р-сайт тРНК. Виділено Y37 та U6-мРНК.
Дослідження в модельних системах показують, що модифікації баз у положенні 37 стабілізують взаємодію тРНК • мРНК за рахунок поліпшення укладання внутрішньонижкової ланцюга в антикодоновій петлі та міжрядового укладання між кодоном та антикодоновими основами (Grosjean et al. 1998). Використовуючи модельну систему двох тРНК з комплементарними антикодонами, було показано, що комплекс тРНК • тРНК на шість порядків стабільніший, ніж очікувалося, для порівнянної подвійної спіралі з трьома базами пар між тринуклеотидами (Grosjean et al. 1976, 1978). В якості джерел для підвищення стабільності були визначені три структурні особливості: обмеження петлі, загальний вплив звисаючих кінців та особливий ефект модифікованих нуклеотидів, останні сприяють на порядок стабільності комплексу. Утворення комплексів, що містять тРНК з модифікованим нуклеотидом у положенні 37, супроводжувалось більшою зміною ентальпії, порівняно з такими без модифікації або без Y-бази, що свідчить про вплив модифікації на укладання (Grosjean et al. 1976).
РЕЗУЛЬТАТИ
Заміщення основи в положенні 37 впливають на стабільність зв'язування пепт-тРНК в А-сайті
Коли рибосомні комплекси з wt пепт-тРНК Phe інкубували при 37 ° С та 10 мМ Mg 2+, ▶). Навпаки, дисоціація всіх немодифікованих транскриптів пепт-тРНК була набагато швидшою, і існували значні відмінності в стабільності А-ділянки, залежно від природи основи в положенні 37, з періодами напіввиведення комплексів від 1 год ( Y37A) до декількох хвилин (Y37U, Y37C). Це демонструє, що на зв'язування A-сайту сильно впливає природа nt 37 в антикодонній петлі. Далі вивчається термодинамічна основа цих ефектів.
- Схуднення вашого статичного сайту Hugo Allison Letson
- Фанат Скарлет Йоханссон - Ваш найкращий і найдовший сайт Скарлетт в Інтернеті
- Видовий профіль Жовтий окунь, Perca flavescens Рибне місце
- Офіційний сайт Phytodren ™ - Формула втрати ваги максимальної сили
- Соціально-економічне становище та ожиріння серед дітей та їх батьків у Республіці Білорусь