Поліфеноли оливкової олії екстра вірджин сприяють припливу холестерину та покращують функціональність ЛПВЩ
Hicham Berrougui
1 Медичний факультет, Служба геріатрії, Факультет медицини та біологічних наук, Університет Шербрука, 3001 12e Avenue Nord, Шербрук, QC, Канада J1H 5N4
2 Кафедра біології, полідисциплінарний факультет, Університет Султан Мулай Сліман, BP 592, 23000 Бені Меллаль, Марокко
Суад Іхлеф
1 Медичний факультет, Служба геріатрії, Факультет медицини та біологічних наук, Університет Шербрука, 3001 12e Avenue Nord, Шербрук, QC, Канада J1H 5N4
Абделуа Халіл
1 Медичний факультет, Служба геріатрії, Факультет медицини та біологічних наук, Університет Шербрука, 3001 12e Avenue Nord, Шербрук, QC, Канада J1H 5N4
Анотація
Результати цієї роботи свідчать про корисну роль споживання оливкової олії першого віджиму (EVOO) для окисного стресу та серцево-судинних захворювань. Поліфеноли, що містяться в EVOO, відповідають за інгібування окисних ушкоджень ліпопротеїнів та сприяють зворотному процесу транспорту холестерину через шлях ABCA1.
1. Вступ
Ішемічна хвороба серця (ІХС) є основною причиною смертності в західному світі. Окислення ліпопротеїдів низької щільності (ЛПНЩ) є ранньою подією розвитку атеросклерозу, що є основною причиною ІХС [1]. Окислений ЛПНЩ не розпізнається ЛПНЩ-рецептором Apo (B/E), але нерегульовано потрапляє макрофагами по шляху рецептора-поглинача, що призводить до утворення пінистих клітин, що є ознакою артеріосклеротичних уражень [1].
Вважається, що макрофаги-специфічний зворотний транспорт холестерину (РКИ) є одним з найважливіших кардіопротективних механізмів, опосередкованих ЛПВЩ. RCT - це процес, за допомогою якого холестерин у периферичних клітинах витікає у циркулюючий ЛПВЩ і транспортується назад до печінки для виведення з жовчю та калом [2, 3]. Популяризація РКИ вважається основною антиатерогенною функцією ЛПВЩ [4, 5]. Витік холестерину з клітин у ЛПВЩ є першим та обмежуючим швидкість кроком РКИ [6]. Описано два основні шляхи витікання холестерину в макрофагах: опосередкований викид холестерину через рецептори SR-BI та витікання холестерину через ABCA1/ABCG1. ABCA1 сприяє витіканню фосфоліпідів та холестерину до бідного на ліпіди апо-AI за допомогою процесу, який включає безпосереднє зв'язування apo-AI з транспортером ABCA1, тоді як ABCG1 та SR-BI є ключовими медіаторами відтоку холестерину в макрофаги до зрілого HDL [7 ]. Докази недавнього дослідження вказують на те, що запальний процес спричиняє зміни у складі ЛПВЩ та метаболізмі, що погіршує РКТ [8]. Цікаво, що нещодавно ми показали, що РКТ також порушується зі старінням, особливо внаслідок змін ABCA1-опосередкованого шляху відтоку холестерину [9, 10].
Сприятливий вплив поліфенолів, як видається, опосередковується через безліч біохімічних шляхів та механізмів сигналізації, які діють незалежно або синергетично. У цьому дослідженні ми досліджували атеропротекторну дію фенольних сполук у EVOO на витікання холестерину та пошкодження окисного стресу у здорових осіб.
2. Методи
2.1. Предмети
Набрано 24 здорових добровольців (30,92 ± 2,55 років) з нормальним рівнем ліпідних профілів у крові та артеріальним тиском. Всі вони були некурящими і не приймали жодних ліків, включаючи гіполіпідемічні засоби та пероральні антиоксиданти. Жодна з випробовуваних жінок не проходила замісної естрогенної терапії в менопаузі. Жоден з учасників не мав клінічних ознак запалення, ожиріння або діабету. Фізичні та біохімічні показники учасників представлені в таблиці 1. Комітет з етики Інституту геріатричного університету Шербрука схвалив дослідження, і всі суб'єкти надали письмову інформовану згоду перед тим, як бути зарахованими.
Таблиця 1
Клінічні та біохімічні показники учасників.
| n = 24 (в/м) | 14/10 |
| Вік (середнє значення ± SD років) | 30,92 ± 2,55 |
| Індекс маси тіла (кг/м 2) | 23,7 ± 1,65 |
| Артеріальний тиск у системі (мм рт. Ст.) | 127 ± 4,65 |
| Діас. кров'яний тиск (мм рт. ст.) | 78,23 ± 2,09 |
| Загальний холестерин (ммоль/л) | 5,06 ± 0,2 |
| Тригліцериди (ммоль/л) | 1,32 ± 0,15 |
| HDL-c (ммоль/л) | 1,42 ± 0,09 |
| LDL-c (ммоль/л) | 3,05 ± 0,15 |
| Апо А1 (г/л) | 1,56 ± 0,05 |
| Апо B (г/л) | 0,90 ± 0,04 |
| Апо B/Apo A1 | 0,8 ± 0,04 |
| TC/HDL-c | 3,81 ± 0,23 |
| LDL-c/HDL-c | 2,5 ± 0,2 |
| TG/HDL-c | 1,08 ± 0,17 |
| Глюкоза (ммоль/л) | 4,43 ± 0,10 |
| Інсулін (пмоль/л) | 38,32 ± 5,26 |
| СРБ (мг/л) | 3,16 ± 0,13 |
ТС (загальний холестерин); ЛПВЩ-С (ЛПВЩ-холестерин); LDL-C (LDL-холестерин); СРБ (С-реактивний білок).
2.2. Фітохімія
Фенольні сполуки екстрагували з EVOO методом Pirisi et al. [20]. Коротко, EVOO змішували з н-гексаном і метанолом/водою і перемішували у вихровому апараті протягом ночі при 4 ° C. Потім суміш центрифугували, а спиртовий розчин промивали н-гексаном і потім ліофілізували протягом ночі.
2.3. Виділення ліпопротеїдів
Плазму людини натще збирали в гепаринові пробірки, і ЛПВЩ негайно виділяли, використовуючи метод Sattler et al. [21]. Ізольовані ліпопротеїни діалізували протягом ночі при 4 ° С проти 10-2 М фосфатного натрієвого буфера (рН 7,0). Концентрації білка вимірювали за допомогою комерційних наборів для аналізу (Bio-Rad, Канада), використовуючи протокол виробництва.
2.4. Збагачення ліпопротеїнів за допомогою EVOO та EVOO-PC
Плазму людини інкубували протягом ночі з легким перемішуванням при 4 ° C у присутності EVOO (0,2 мг/мл плазми) або EVOO-PC (1,76 мг/мл плазми). Потім LDL та HDL виділяли, як описано вище.
2.5. Мідно-опосередковане окислення ліпопротеїнів
Ліпопротеїди пероксидували, як описано раніше, використовуючи іони перехідних металів як окислювачі [22]. Коротко кажучи, збагачені ліпопротеїни контролю, EVOO та EVOO-PC [(LDL 100 мкг/мл) або (HDL 200 мкг/мл)] суспендували в 10 мМ фосфатному буфері натрію (pH 7) та інкубували протягом 0 - 4 год. при 37 ° С у присутності 10 мкМ сульфату міді. Реакцію окислення зупиняли додаванням ЕДТА. Освіта перекису ліпідів оцінювали шляхом моніторингу утворення кон'югованого дієну при 234 нм.
2.6. Клітинні культури
Моноцити THP-1 людини та макрофаги J774 культивували відповідно у середовищі RPMI 1640 та DMEM. До середовищ додавали 10% інактивованого теплом FBS, 50 мМ 2-β-меркаптоетанолу (лише для THP-1), 2 мМ L-глутаміну, 5 мг/мл глюкози та 100 ОД/мл пеніциліну. Диференціювання моноцитів THP-1 у макрофаги індукували культивуванням моноцитів у присутності 100 мкМ РМА протягом 96 год.
2.7. Вимірювання викидів холестерину
Похідні THP-1 макрофаги та макрофаги J774 інкубували у свіжому ростовому середовищі, що містить 0,2 мкКі/мл [3 Н] -холестерину протягом 48 год або 1 мкКі/мл [3 Н] -холестерину, протягом 24 год відповідно. Завантажені клітини промивали, врівноважували в безсироватковому середовищі, що містить 1% BSA, протягом 12 год, знову промивали і піддавали різній обробці. Похідні THP-1 макрофаги інкубували протягом 24 годин з (1) середовищем, що не містить ЛПВЩ, (2) ЛПВЩ (50 мкг/мл), (3) збагаченим EVOO HDL (OO-HDL) або (4) EVOO -Збагачений ПК ЛПВЩ (ПК-ЛПВЩ).
Навантажені [3 H] -холестерином THP-1 макрофаги піддавали окислювальному стресу, інкубуючи їх з 0,2 мМ залізом/аскорбатом (Fe/Asc) за відсутності або присутності EVOO-PC (320 мкг/мл) протягом 6 год. . Потім їх інкубували з ЛПВЩ протягом 24 годин для оцінки відтоку холестерину в різних умовах.
Вплив EVOO-PC на опосередкований ABCA1 витік холестерину оцінювали за допомогою макрофагів J774. [3 H] -Навантажені холестерином макрофаги J774 інкубували протягом 12 год з 0 до 320 мкг/мл EVOO-PC для генерування збагачених ABCA1 клітин або з 300 мкМ 8-Br-cAMP (позитивний контроль) для стимулювання транскрипції гена ABCA1 і експресія поверхневого білка. Потім макрофаги J7774 інкубували з 25 мкг/мл апо-AI протягом 4 годин.
Щоб краще зрозуміти механізм витікання холестерину, опосередкованого EVOO-PC, ми вивчили вплив двох основних фенольних сполук у EVOO (тирозолу та гідрокситирозолю) на опосередкований ABCA1 витік холестерину. [3 H] -Навантажені холестерином макрофаги J774 інкубували протягом 12 год з 0-25 мкМ тирозолом або гідрокситирозолем для утворення збагачених ABCA1 клітин, а потім інкубували з 25 мкг/мл апо-AI протягом 4 год. 8-Br-cAMP використовували як позитивний контроль.
Витік холестерину визначали методом рідинного сцинтиляційного підрахунку, а відсоток виділеного радіоактивного холестерину (відсоток випливу холестерину) обчислювали за такою формулою: (cpm в середовищі/[cpm в клітинах + середовище]) × 100.
2.8. Вестерн-блот-аналіз
Експресію білка ABCA1 у макрофагах J774 вивчали шляхом інкубації їх протягом 12 год з 0 до 320 мг/мл EVOO-PC або 5 або 10 мкМ гідрокситирозолу або тирозолу. Білки (20 мкг) розділяли електрофорезом на 10% акриламідних гелях і переносили в мембрани полівінілідендіфториду (PVDF). Мембрани блокували 5% молоком у PBS/Tween 20 і інкубували з первинними антитілами (анти-ABCA1), а потім із специфічними кон'югованими IgG-HRP вторинними антитілами. В якості контролю використовували β-актин. Білкові смуги були виявлені за допомогою посиленого хемілюмінесцентного реагенту (ECL) [10].
2.9. Статистичний аналіз
Значення виражаються як середні значення ± SEM. Для багаторазового порівняння використовували односторонній дисперсійний аналіз (ANOVA). Для оцінки зв'язку двох неперервних змінних використовували лінійний регресійний аналіз. Всі статистичні аналізи проводились за допомогою програмного забезпечення GraphPad Prism-5.
3. Результати
3.1. Вплив екстракту оливкової олії та екстрактів фенольних сполук EVOO на окислення ліпопротеїнів
Концентрацію загальних фенольних сполук (41,9 мМ; еквівалент галової кислоти) оцінювали за допомогою методу Фоліна-Чіокальтеу.
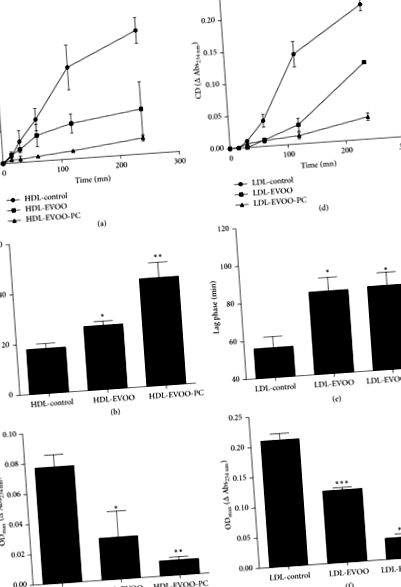
Перекисне окислення CuSO4 поліненасичених жирних кислот (ПНЖК) у ЛПВЩ та ЛПНЩ оцінювали шляхом утворення кон'югованих дієнів. Кінетика перекисного окислення показала, що фаза відставання ЛПНЩ була довшою, ніж фаза відставання ЛПВЩ. За фазою відставання послідували фази розповсюдження та припинення.
У світлі цих результатів ми потім дослідили вплив двох основних фенольних сполук в EVOO-PC (очищений тирозол та гідрокситирозоль) на витікання холестерину та експресію білка ABCA1 в макрофагах J774. Отримані нами результати показали, що тирозол та гідрокситирозол збільшуються залежно від концентрації, вивільнення холестерину, залежне від ABCA1 (Рисунки 4 (а) та 4 (b), відповідно).
Тирозол та гідрокситирозоль збільшують експресію білка ABCA1 та посилюють опосередкований апоА-I холестерин. [3 H] -холестеринові навантажені макрофаги J774 інкубували протягом 12 годин з різними концентраціями (від 0 до 25 мкМ) тирозолу (a) або гідрокситирозолю (b) для утворення збагачених ABCA1 клітин, які потім інкубували з 25 мкг/мл апо-AI протягом 4 год. Результати виражаються як середнє значення ± SEM щонайменше трьох незалежних експериментів.
4. Обговорення
Оливкова олія є основним джерелом жиру в середземноморській дієті. Велика кількість знань дала докази переваг середземноморської дієти та споживання оливкової олії для профілактики атеросклерозу та ІХС [24–27]. У кількох дослідженнях повідомляється, що антиатерогенна дія оливкової олії пов'язана з антиоксидантною та протизапальною дією, що надається різними компонентами, особливо мононенасиченими жирними кислотами (MUFA) та поліфенолами [11, 17, 28–30]. Фенольні сполуки, особливо гідрокситирозол та олевропеїн, залежно від дози пригнічують окислення ЛПНЩ та ЛПВЩ in vitro та in vivo, пригнічують реакції, що зумовлені супероксидом, і порушують ланцюгоподібне розповсюдження перекисів ліпідів [31–34]. Цікаво, що дослідження Коваса та співавт. [17] показали, що споживання EVOO збільшує постпрандіальну концентрацію фенольних сполук у плазмі крові та ЛПНЩ та ЛПВЩ, що може пояснити захисний ефект фенольних сполук.
Рівень холестерину ЛПВЩ у плазмі помітно і обернено корелює з ризиком розвитку атеросклеротичних серцево-судинних захворювань [35]. Існує припущення, що ЛПВЩ сприяє відтоку холестерину з периферичних тканин і транспортує його назад до печінки в процесі, який називається РКИ [36]. ABCA1 сприяє відтоку холестерину з клітин до убогого на ліпіди апо-AI, але не до ЛПВЩ [7, 37], тоді як інший транспортер ABC, ABCG1, як і рецептор SR-BI, бере участь у відпливі холестерину від макрофагів до ЛПВЩ [38, 39]. Деякі дослідження припускають, що харчові речовини та дієта можуть відігравати ключову роль у регуляції РКД [25, 40–42]. Раніше ми показали, що споживання EVOO покращує процес РКД, посилюючи здатність ЛПВЩ опосередковувати витікання холестерину, а макрофаги, отримані від моноцитів людини (HMDM), виводити вільний холестерин [43]. У цьому дослідженні ми досліджували, як споживання EVOO може сприяти відтоку холестерину. Ми зосередились на дії EVOO-PC, особливо таких важливих фенолів, як тирозол та гідрокситирозоль.
Однак мало відомо про молекулярний механізм, за допомогою якого фенольні сполуки сприяють відтоку холестерину. Щоб краще зрозуміти механізм, за допомогою якого EVOO-PC посилює опосередкований ЛПВП витік холестерину, ми досліджували вплив EVOO-PC на клітинні сигнальні шляхи. Наші результати чітко показали, що EVOO-PC, включаючи тирозол та гідрокситирозоль, стимулює експресію білка ABCA1 в макрофагах J774, що може пояснити, як ці феноли сприяють відтоку холестерину до апоА-1. Уто-Кондо та ін. [40] повідомляв, що споживання кави здоровими людьми посилює витік холестерину, опосередкований ЛПВЩ, за рахунок збільшення рівня експресії ABCG1 та SR-BI, але не ABCA1, і що це може бути пов’язано з фенольними кислотами в каві. Це, мабуть, малоймовірне, враховуючи, що фенольні кислоти активують експресію рецептора-α (LXRα) печінки, що в свою чергу трансактивує як ABCA1, так і ABCG1. Однак інші дослідження, включаючи наше, показали, що ресвератрол стимулює LXRα, ABCA1 та ABCG1 [52, 53]. Таким чином, виявляється, що різні фенольні сполуки можуть стимулювати витікання холестерину за допомогою різних механізмів.
На закінчення, наші результати показали, що EVOO-PC підсилює антиатерогенні властивості ЛПВЩ за рахунок зменшення окисних модифікацій ЛПВЩ та за рахунок збереження фізико-хімічних властивостей ЛПВЩ, що, в свою чергу, покращує функціональність ЛПВЩ, особливо здатність сприяти відтоку холестерину. EVOO-PC також захищав клітини від окисного пошкодження та стимулював експресію білка ABCA1, ключовий фактор витікання холестерину та генезу ЛПВЩ. Наші результати узгоджуються з попередніми результатами, які показують, що споживання поліфенолів оливкової олії допомагає зменшити серцево-судинний ризик.
Подяка
Це дослідження було підтримане грантами Канадських інститутів досліджень охорони здоров’я (MOP-89912 та IAO-134212).
- ГЛИБОКА СМАРКА З ЕКСТРА ДІВНОЮ ОЛИВКОЮ МАСЛОЮ - Оливкова олія Giuliana Premium - Оливкова олія Giuliana
- Холестерин Джерело оливкової олії
- Продукти, що покращують ваше ставлення до
- Дієта від коронавірусу 9 Продукти, що сприяють розслабленню, щоб допомогти вам залишатися спокійним; CBS Детройт
- Продукти харчування, які природно знижують рівень холестерину - Медики Нового Заходу Медицина Нового Заходу Охорона здоров’я