Пероральна добавка глутаміну пригнічує утворення асциту при перитонеальній карциноматозній миші
1 відділ гастроентерології, відділення внутрішніх хвороб, Меморіальна лікарня Маккей, Тайвань
2 Маккейський молодший коледж медицини, медсестер та управління, Тайбей, Тайвань
3 Медичний коледж Маккея, Новий Тайбей, Тайвань
4 Відділення променевої онкології, Меморіальна лікарня Маккея, Тайбей, Тайвань
5 Випускник Інституту фармакології, Тайбейський медичний університет, Тайбей, Тайвань
Анотація
Передумови. Перитонеальний карциноматоз (ПК), що супроводжується утворенням асциту, спричиняє кілька тривожних симптомів, що призводить до низької якості життя. Методи. Двадцять оголених мишей BALB/c, отриманих шляхом прямої ортотопічної ін’єкції клітин раку підшлункової залози людини PANC-1, були рандомізовані для отримання або основних лабораторних дієт, або основних дієт, доповнених глутаміном. Половину мишей забивали на 76 день для вимірювання кількості асцитичної рідини та об'єму пухлини підшлункової залози. Решта мишей були піддані аналізу виживання. Рівні альбуміну в сироватці крові оцінювали кожні 2 тижні. Результати. На 76 день середня кількість асцитичної рідини, виміряна у контрольній групі, становила
мл від мишей з глютаміном (
). Обсяг пухлини підшлункової залози був
см 3 в контрольній групі і
см 3 у мишей з добавкою глутаміну (). Середній час виживання мишей, що отримували глютамін, було продовжено з
до днів (). Середній рівень альбуміну в сироватці крові був вищим у групі, яка отримувала глютамін. Висновки. Це доклінічне дослідження показало, що пероральне введення глютаміну може забезпечити зменшення асциту у хворих на рак підшлункової залози з ПК за допомогою клітинно-опосередкованого імунонезалежного механізму.
1. Вступ
Перитонеальний карциноматоз (ПК) добре зарекомендував себе як кінцева ознака розвинених первинних або вторинних новоутворень, що зачіпають очеревину. ПК є складним ускладненням, пов’язаним із поганим прогнозом та обмеженими можливостями лікування [1]. Місцево поширений рак підшлункової залози є одним з найпоширеніших захворювань, що спричиняють ПК та подальший асцит. Середня тривалість виживання хворих на рак у термінальній стадії становить 3–6 місяців [2]. На цьому термінальному етапі якість життя, а не продовження виживання, вважається найважливішим питанням паліативної допомоги. Тим не менше, важливість паліативної допомоги, що продовжує життя, набуває визнання в нову еру лікування раку.
Оскільки асоційований з ПК асцит розвивається внаслідок факторів гідростатичного тиску, а не осмотичних факторів, поточне управління станом включає парацентез черевної порожнини, введення діуретиків та обмеження солі. Підтримка харчування є альтернативною стратегією покращення загального самопочуття після лікування асциту. Однак значення підтримки харчування у хворих на ПК залишається суперечливим з невизначеними перевагами виживання [3] і побоюється, що це може прискорити ріст пухлини [4, 5].
Патогенез утворення асциту у ПК незрозумілий. Вважається, що це кореляція між ендотеліальними клітинами, ангіогенезом та цитокінами, що виділяються в очеревині [6–8]. Взаємодії ендотелію та лейкоцитів, безумовно, відіграють певну роль, що призводить до вивільнення цитокінів та активації ендотелію очеревини. Попереднє експериментальне дослідження припустило, що ін'єкція генетично модифікованих фібробластів, що експресують інтерлейкін-12, є ефектом лікування для ПК мишачої підшлункової залози через активований вроджений імунітет, і це особливо активувало макрофаги M1 [9]. Інше дослідження показало, що ангіопоетин-1, регулятор ендотеліальних клітин, може зменшити утворення асциту, опосередковуючи фактор росту судинного ендотелію [10].
Глютамін (GLN), найпоширеніша вільна амінокислота в циркуляції, служить важливим джерелом енергії для багатьох швидко проліферуючих клітин, особливо ентероцитів, лімфоцитів та фібробластів. Різні рандомізовані контрольовані дослідження на онкологічних хворих показали, що ГЛН покращує метаболізм азоту та підтримує імунну відповідь, покращуючи таким чином результат пацієнта [11, 12].
Метою цього дослідження було оцінити потенційні ефекти перорально введеного GLN у пухлинних господарів з ПК та асцитом.
2. Методи
2.1. Тваринна та експериментальна модель ПК
Самців оголених мишей BALB/c, віком від 6 до 8 тижнів, використовували відповідно до інституційних вказівок. Клітини PANC-1, отримані з низькодиференційованої епітеліоїдної карциноми підшлункової залози людини, були придбані в Американській колекції типових культур (ATCC, Роквілл, штат Меріленд, США). Клітини PANC-1 збирали у концентрації 5 × 10 6/мл із субконфлюентних культур. Експериментальний ПК був створений шляхом прямого ортотопічного введення клітин PANC-1 у хвіст підшлункової залози. Щоб запобігти витоку, ватяну паличку акуратно тримали протягом 1 хвилини над місцем ін’єкції. Потім черевну рану закрили швами. Тваринам проводили лапаротомію для підтвердження зростання пухлини, що досягав 5 мм на 10-й день (рис. 1).
2.2. Протоколи лікування
Двадцять мишей з підтвердженим ростом пухлини на 10 день були рандомізовані в 2 групи з однаковою середньою масою тіла в кожній. Група А (
) отримав основну лабораторну дієту з носієм для глутаміну, а група В () отримала основну лабораторну дієту, доповнену 100% GLN (5 мг/(кг · день)).
2.3. Зростання пухлини, сироватковий альбумін, рівень аспартат-амінотрансферази та показники лейкоцитів, формування асциту та виживання
П’ять мишей від кожної групи приносили в жертву на 76 день. Асцит збирали, проводячи нижній розріз по середній лінії, повністю зливаючи внутрішньочеревну рідину, і кількість аскетичної рідини вимірювали за допомогою 0,5 мл інсулінового шприца. Потім розрізи розширювали, щоб забезпечити спостереження за порожниною очеревини та підтвердити ступінь поширеності ПК. Пухлини вирізали, а об’єм пухлини вимірювали як 1/2 ×
(= максимальний діаметр і = мінімальний діаметр). Потім решту 5 мишей у кожній групі спостерігали до смерті для аналізу виживання. Сироватковий альбумін, рівні аспартатамінотрансферази (AST) та кількість білої крові в крові (WBC) для кожної тварини збирали кожні 2 тижні. Це дослідження отримало схвалення від Інституційного комітету з догляду за тваринами та використання та Інституційного комітету з меморіальної лікарні Маккей, Тайбей, Тайвань.
3. Результати
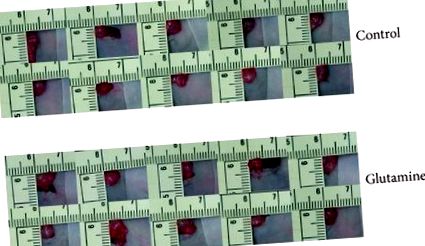
Усі миші добре переносили лікування. Кількість зібраного асциту становила 1,2 ± 0,3 та 0,5 ± 0,5 мл у контрольній та GLN-групі, відповідно, (). На 76 день об'єм пухлини підшлункової залози становив 2,60 ± 0,8 см 3 у контрольних мишей та 1,98 ± 1,3 см 3 у групі, яка отримувала ГЛН (). Потім решту 5 мишей у кожній групі спостерігали до смерті для аналізу виживання. На 85 день лише 1 тварина з контрольної групи була живою порівняно з усіма 5 мишами в групі, яка отримувала GLN. Очеревина живота була очевидно меншою у мишей, які отримували GLN (рис. 2). Середній період виживання мишей () був довшим на 101 ± 2 дні з добавками GLN на відміну від 87 ± 4 днів у контрольній групі (). Середній рівень сироваткового альбуміну був вищим у групі, яка отримувала GLN, для кожного відібраного зразка крові (рис. 3). Не було значущої різниці в рівні циркулюючого лейкоцитів та рівнів AST в обох групах.
4. Обговорення
Імунонутрієнти - це специфічні поживні речовини, які надають імунологічну дію при споживанні на рівні, що перевищує добову потребу. GLN є добре відомим імунонутрієнтом, оскільки він має важливе значення для росту і функції Т-лімфоцитів і природних клітин-кілерів, які, як було показано, пригнічують прогресування раку завдяки своїй цитолітичній активності [13]. Було показано, що пероральне введення добавок GLN запобігає росту пухлини молочної залози шляхом інгібування вироблення антиоксиданту глутатіону, активації передачі сигналів p53 та інгібування передачі сигналів PI3 K/Akt [14, 15]. На моделі атимічних мишей, яка використовувалась у нашому дослідженні, ми продемонстрували корисну роль GLN у зменшенні утворення асциту, уповільнення росту пухлини та продовженні виживання. У цих двох групах не було суттєвої різниці в циркуляції лейкоцитів. Враховуючи, що опосередкований Т-клітинами імунітет недостатній у мишей, що отримують тимус, благотворний вплив добавок GLN, швидше за все, виникає через механізм, незалежний від опосередкованого Т-клітинами імунітету. Однак вплив GLN на імунні клітини, що проникають в асцит, залишається вивчити у компетентних імунних експериментальних тварин.
У цьому попередньому дослідженні пероральне введення добавок GLN зменшило кількість асциту, продукованого у мишей, що несуть пухлину PANC-1, за допомогою ПК. Потенційні механізми дії GLN включають підтримку цілісності слизової оболонки, протизапальну дію в результаті посиленого синтезу глутатіону та індукцію синтезу білка теплового шоку для ослаблення цитокінів та поліпшення імунної компетентності [12].
Попереднє занепокоєння щодо того, що використання харчової підтримки може надмірно стимулювати ріст пухлини, не спостерігалось у нашому дослідженні, оскільки середній обсяг пухлини підшлункової залози був меншим у мишей, які отримували GLN, порівняно з контрольною групою. Більше того, добавки GLN збільшили час виживання. Протягом останніх 2 десятиліть кілька клінічних досліджень оцінювали толерантність та безпеку ГЛН у хворих на рак. У більшості цих клінічних досліджень GLN, що вводився перорально, добре переносився, не маючи ознак посилення росту пухлини. Важливо, щоб вплив добавок GLN на ріст пухлини отримав подальше підтвердження як у тварин, так і в клінічних дослідженнях.
Середній рівень альбуміну в сироватці крові був вищим у групі, яка отримувала ГЛН. Цей результат може підтвердити попередній висновок про те, що дієтичні добавки до GLN позитивно впливали на статус вісцерального білка [16]. Залишається з'ясувати, чи пов'язаний підвищений рівень альбуміну зі зменшенням утворення асциту. Оскільки між цими двома групами не було суттєвої різниці рівнів АСТ у сироватці крові, механізм приросту альбуміну не може бути пов’язаний із поліпшенням або захистом функції печінки. Крім того, ефект приросту альбуміну від ГЛН означає його можливе застосування при лікуванні асциту, пов'язаного з дефіцитом альбуміну, наприклад, цирозом печінки.
Поліпшення лікування асциту у хворих на рак підшлункової залози в термінальній стадії є найважливішим питанням не тільки для поліпшення якості кінця життя, але і для досягнення полегшення життя, що продовжує життя. Це попереднє дослідження демонструє, що пероральне додавання ГЛН у пацієнтів з ПК може представляти перспективний імунонутрієнт для поліпшення контролю асциту. Необхідне подальше з'ясування механізму дії, а також клінічне підтвердження.
Конфлікт інтересів
Автори заявляють, що не існує конфлікту інтересів щодо публікації цієї статті.
Подяка
Це дослідження було підтримане грантами MMH-9700-01, MMH-100-01 та MMH-10016 від Меморіальної лікарні Маккей, Тайвань.
Список літератури
- Л. Сантарпія, Л. Альфонсі, Ф. Пасанісі, К. де Капріо, Л. Скальфі та Ф. Контальдо, “Прогностичні фактори виживання у пацієнтів з перитонеальним карциноматозом при домашньому парентеральному харчуванні” Харчування, вип. 22, ні. 4, с. 355–360, 2006. Переглянути на: Сайт видавця | Google Scholar
- Дж. М. Девіс та Б. О'Ніл, "Перитонеальний карциноматоз шлунково-кишкового походження: природна історія та варіанти лікування", Висновок експерта щодо досліджуваних наркотиків, вип. 18, № 7, с. 913–919, 2009. Переглянути на: Сайт видавця | Google Scholar
- П. Гуд, Дж. Кавена, М. Матер та П. Равенскрофт, “Харчування з допоміжним лікуванням для паліативної допомоги у дорослих пацієнтів” Кокранівська база даних систематичних оглядів, ні. 4, Ідентифікатор статті CD006274, 2008. Переглянути за адресою: Google Scholar
- М. Х. Торосян, "Стимуляція росту пухлини за допомогою підтримки харчування", Журнал парентерального та ентерального харчування, вип. 16, додаток 6, с. 72S – 75S, 1992 р. Переглянути за адресою: Google Scholar
- М. Х. Торосян та Р. Б. Донуей, "Загальне парентеральне харчування та метастазування пухлини", Хірургія, вип. 109, ні. 5, с. 597–601, 1991. Перегляд за адресою: Google Scholar
- J. K. Min, Y. M. Kim, S. W. Kim et al., “Індукований активацією цитокін, пов’язаний з TNF, посилює адгезивність лейкоцитів: Індукція ICAM-1 та VCAM-1 через TNF-рецептор-асоційований фактор та протеїнкіназу C-залежний NF-κАктивація В в ендотеліальних клітинах ” Журнал імунології, вип. 175, ні. 1, с. 531–540, 2005. Перегляд: Google Scholar
- С. Гош, С. Рой, М. Банерджі та П. Мейті, “Модуляція індукованого пухлиною ангіогенезу при асцитній пухлині Ерліха”, Журнал експериментальних та клінічних досліджень раку, вип. 23, ні. 4, с. 681–690, 2004. Перегляд за адресою: Google Scholar
- C. L. Yeh, C. S. Hsu, S. C. Chen, M. H. Pai та S. L. Yeh, "Вплив глутаміну на експресію молекули клітинної адгезії та трансміграцію лейкоцитів в ендотеліальних клітинах, стимульованих плазмою або перитонеальною дренажною рідиною від хірургічного пацієнта" Шок, вип. 25, ні. 3, с. 236–240, 2006. Переглянути на: Сайт видавця | Google Scholar
- J. M. Péron, C. Bureau, P. Gourdy et al., «Лікування експериментального карциноматозу підшлункової залози у мишей фібробластами, генетично модифікованими для експресії IL12: роль вродженого перитонеального імунітету» Кишечник, вип. 56, ні. 1, с. 107–114, 2007. Переглянути на: Сайт видавця | Google Scholar
- O. Stoeltzing, S. A. Ahmad, W. Liu et al., "Ангіопоетин-1 пригнічує ріст пухлини та асцит у мишачій моделі перитонеального карциноматозу" Британський журнал раку, вип. 87, ні. 10, с. 1182–1187, 2002. Переглянути на: Сайт видавця | Google Scholar
- М. Coëffier, O. Miralles-Barrachina, F. le Pessot та ін., “Вплив глутаміну на продукцію цитокінів кишечником людини in vitro”, Цитокіни, вип. 13, № 3, с. 148–154, 2001. Переглянути на: Сайт видавця | Google Scholar
- Y. C. Hou, C. S. Hsu, C. L. Yeh, W. C. Chiu, M. H. Pai і S. L. Yeh, "Вплив глутаміну на експресію молекули адгезії та трансміграцію лейкоцитів в ендотеліальних клітинах, що зазнали впливу миш'яку", Журнал харчової біохімії, вип. 16, № 11, с. 700–704, 2005. Переглянути на: Сайт видавця | Google Scholar
- К. С. Кун, М. Мускарітолі, П. Вішмайер та П. Стеле, “Глютамін як незамінний живильний матеріал в онкології: експериментальні та клінічні дані”, Європейський журнал харчування, вип. 49, ні. 4, с. 197–210, 2010. Переглянути на: Сайт видавця | Google Scholar
- В. К. Тодорова, С. А. Хармс, Ю. Кауфманн та ін., “Вплив дієтичного глутаміну на рівень глутатіону пухлини та пов’язані з апоптозом білки при раку молочної залози щурів, індукованому DMBA” Дослідження та лікування раку молочної залози, вип. 88, ні. 3, с. 247–256, 2004. Переглянути на: Сайт видавця | Google Scholar
- В. К. Тодорова, С. А. Хармс, С. Луо, Ю. Кауфманн, К. Б. Бабб та В. С. Клімберг, “Пероральне додавання глютаміну (AES-14) інгібує передачу сигналів PI-3K/Akt при експериментальному раку молочної залози” Журнал парентерального та ентерального харчування, вип. 27, ні. 6, с. 404–410, 2003. Перегляд за адресою: Google Scholar
- М. М. Рожеро, М. С. Борхес, І. А. де Кастро, І. С. Пірес, П. Бореллі та Дж. Тірапегі, “Вплив дієтичних добавок глютаміну на склад тіла та білковий статус рано відлучених мишей, щеплених Mycobacterium bovis Bacillus Calmette-Guerin, ” Поживні речовини, вип. 3, № 9, с. 792–804, 2011. Переглянути на: Сайт видавця | Google Scholar
- Шипшина пригнічує активність ксантиноксидази та знижує рівень уратів у сироватці крові на миші
- MicroRNA 34a частково пригнічує утворення жиру бежевого та коричневого кольору при ожирінні, пригнічуючи адипоцити
- Дієта із шістьма пакетами Бред Креніг, чоловік чоловічої статі, їсть рис, щоб залишатися струнким
- Постнатальне годування з дієтою з високим вмістом жиру викликає ожиріння та скоростигле статеве дозрівання у мишей C57BL6J
- NephroCare - Головна для пацієнтів - Ваша дієта - Харчування для пацієнтів з перитонеальним діалізом