Переробка хітину і целюлози в низькотемпературній електронно-променевій плазмі †
Тетяна Васильєва
1 Московський фізико-технічний інститут, Інститутський пер., 9, Долгопрудний, 141700 Москва, Росія; ur.liam@veragisaa (А.С.); ur.relbmar@6002veilisavnm (М.В.)
Дмитро Чухчин
2 Базовий центр "Арктика", Північний (Арктичний) федеральний університет, наб. Північна Двіна, 17, 163002, Архангельськ, Росія; ur.liamg@hcstamid
Сергій Лопатін
3 Федеральна державна установа, Федеральний науково-дослідний центр, Основи біотехнології РАН, Інститут біоінженерії, 60 літ Жовтня пр-т, 7/1, 117312 Москва, Росія; ur.ca.igneib@nitapol (S.L.); ur.ca.igneib@vomalrav (В.В.)
Валерій Варламов
3 Федеральна державна установа, Федеральний науково-дослідний центр, Основи біотехнології РАН, Інститут біоінженерії, 60 літ Жовтня пр-т, 7/1, 117312 Москва, Росія; ur.ca.igneib@nitapol (S.L.); ur.ca.igneib@vomalrav (В.В.)
Андрій Сігарєв
1 Московський фізико-технічний інститут, Інститутський пер., 9, Долгопрудний, 141700 Москва, Росія; ur.liam@veragisaa (А.С.); ur.relbmar@6002veilisavnm (М.В.)
Михайло Васильєв
1 Московський фізико-технічний інститут, Інститутський пер., 9, Долгопрудний, 141700 Москва, Росія; ur.liam@veragisaa (А.С.); ur.relbmar@6002veilisavnm (М.В.)
Анотація
1. Вступ
Два природні відновлювані біополімери, а саме целюлоза (лінійний ланцюг від кількох сотень до багатьох тисяч зв’язаних β-1,4-з’єднань г-глюкози) та хітин (лінійний гетерокополімер β-1,4-зв’язаних 2-аміно-2-дезокси- d -глюкопіраноза та 2-ацет-амідо-2-дезокси- d -глюкопіраноза (одиниці), є найбільш поширеними полісахаридами на землі. Похідні целюлози, хітину та хітозану є дуже перспективними для технологічних та промислових застосувань, таких як сільське господарство, мікробіологія, харчова промисловість, медицина, а також підсектор целюлози та паперу [1,2,3,4,5,6].
Незважаючи на те, що полімери мають унікальні властивості (висока біосумісність з живими тканинами, біологічна здатність до розкладання, здатність до комплексоутворення, низька токсичність тощо), вони мають обмежене застосування в багатьох галузях промисловості через їх нерозчинність у більшості розчинників. Наприклад, водорозчинні низькомолекулярні хітоолігосахариди (COS) (менше 10 кДа) зазвичай потрібні в медицині, фармацевтиці та сільському господарстві [5,6,7,8,9,10]. Низькомолекулярні фрагменти целюлози є перспективними субстратами для мікробіології, оскільки вони можуть бути перетворені в моносахариди та низку продуктів, ферментованих цукрів для синтезу біоетанолу шляхом мікробного бродіння серед них [11].
Звичайним методом є простий і відносно недорогий хімічний гідроліз у концентрованих кислотах або лугах при високих температурах. Однак ці методи зазвичай займають кілька годин або навіть днів, а технологічне обладнання пошкоджене внаслідок корозії та необхідні процедури нейтралізації [12,13,14,15]. Більше того, токсичні відходи та забруднення навколишнього середовища властиві хімічній переробці полісахаридів. Ще однією проблемою хімічних методів є утворення продуктів із модифікованою хімічною структурою. Наприклад, хімічна деградація хітину може призвести до утворення деацетильованого COS, але для подальших (біо) хімічних реакцій зазвичай потрібні стабільні N-ацетильні групи, наявні в структурі хітину [12,13].
Ферменти часто переважніші від неорганічних сполук з каталітичною здатністю, оскільки вони екологічно стійкі. Однак ферментативний гідроліз целюлози часто буває неповним, і утворені продукти мають високий індекс полідисперсності [16].
Таким чином, зусилля з розробки нових економічно доцільних та екологічно чистих методів деградації полісахаридів видаються обґрунтованими. Плазмохімічні технології із використанням нерівноважної низькотемпературної плазми можуть бути перспективною альтернативою згаданим вище методам гідролізу. Наші попередні роботи показали, що електронно-променеву плазму (EBP) можна застосовувати для ефективного та контрольованого руйнування хітозану, а високий вихід водорозчинної COS може бути досягнутий шляхом оптимізації процедури обробки EBP [17].
Цілі цього дослідження полягали в наступному:
Вивчити EBP-обробку хітину та целюлози та виявити часову залежність для EBP-стимульованого утворення водорозчинних низькомолекулярних продуктів (LMWP).
Охарактеризувати хімічну структуру та молекулярну масу виробленого НМГ.
Запропонувати можливі механізми дії EBP на полісахариди.
2. Результати
2.1. EBP Обробка полісахаридів
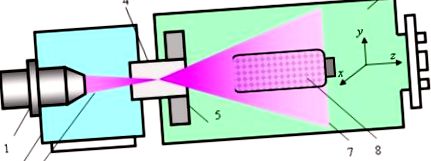
Рисунок 1 ілюструє конструкцію та роботу електронно-променевого плазмохімічного реактора (EBPR). EBPR, його режими роботи та оптимізація схем обробки біоматеріалів, а також властивості EBP були детально описані в [18,19].
Електронно-променевий плазмохімічний реактор та схема процедури обробки: 1 - електронно-променева гармата; 2 - висока вакуумна камера; 3 — електронний пучок; 4 — ін’єкційне вікно; 5 — система електромагнітного сканування; 6 — робоча камера; 7 — хмара EBP; 8 - змішувальний пристрій з полісахаридним порошком, що підлягає обробці.
Коротко кажучи, сфокусований ЕВ 3, генерований електронно-променевим пістолетом 1, який знаходиться у камері високого вакууму 2, впорскується в робочу камеру 6, заповнену плазмоутворюючим газом, через інжекційне вікно 4. При проходженні через газ ЕБ розсіюється при пружних зіткненнях і енергія швидких електронів поступово зменшується при різних непружних взаємодіях із середовищем (іонізація, збудження, дисоціація). В результаті генерується хмара EBP 7, всі параметри плазми є функціями координат x, y та z (z - вісь введення EB).
Електромагнітна система сканування 5, розміщена всередині робочої камери поблизу інжекційного вікна, здатна відхиляти інжектовану вісь EB в напрямках x та y і, отже, контролювати просторовий розподіл частинок плазми у плазмовій масі. Робоча камера попередньо відкачується під тиском
1 Па, а потім заповнюється плазмоутворюючими середовищами - хімічно чистим киснем (Sigma-Aldrich, Мюнхен, Німеччина) до 670 Па.
Полісахаридні порошки обробляли в спеціальному реакторі для змішування 8. Пристрій (рис. 2а) містить циліндричний кварцовий посудину 1а з внутрішніми ребрами 3а; він оснащений кроковим двигуном, що обертає судно в різних режимах (безперервний, переривчастий, зворотний тощо). Коли посудина обертається, порошкоподібний матеріал (4а) перемішується. Пристрій розміщується всередині робочої камери EBPR, заповненої плазмоутворюючим газом при необхідному тиску, і EB 2a впорскується через відкритий кінець реактора. В результаті аерозольна реакційна зона 5а утворюється всередині посудини. Тривалість лікування (τ) полісахаридів варіювала в межах 1–20 хв. Щоб запобігти термічному руйнуванню полісахаридів, їх обробляли при температурі матеріалу Ts = 40 ° C. Температуру зразка під час обробки контролювали за допомогою оптичного ІЧ-пірометра Optris LS (Optris GmbH, Портсмут, Нью-Йорк, США) або за допомогою мініатюрного термодатчика, вставленого в реакційну зону. Температуру матеріалу контролювали, змінюючи струм ЕВ.
Переробка полісахаридних порошків у змішувальному пристрої: (a) Конструкція змішувального пристрою для EBP-обробки полісахаридних порошків: 1а - циліндричний кварцовий посудину; 2a - хмара EBP; 3а - внутрішні перегородки; 4а - порошок полісахаридів; 5а - зона аерозольної реакції. (b) Порошок хітину в зоні реакції EBP фото.
2.2. Характеристика оброблених EBP полісахаридів
2.2.1. Характеристика молекулярної маси
Вихідні полісахариди були нерозчинні у воді, а обробка EBP (τ = 1–10 хв) збільшила їх розчинність у воді та деяких інших розчинниках за рахунок зниження ступеня полімеризації та утворення продуктів з низькою молекулярною масою (LMWP). Таблиця 1 ілюструє зміни розчинності сульфату целюлози, обробленого EBP, у дистильованій воді та 5% NaOH. Вихід розчинної НМГ целюлози збільшувався із тривалістю часу обробки EBP і досягав 77,4% (для водорозчинної НМГ) після 10-хвилинної обробки. EBP-обробка протягом 2 хв значно зменшила ступінь полімеризації нерозчинної фракції.
Таблиця 1
Зміни розчинності сульфату целюлози, обробленого EBP, у дистильованій воді та 5% NaOH.
| 0 | 1.8 | 6.8 | 93.2 | 960 |
| 2 | 22.7 | 45.3 | 54,7 | 460 |
| 10 | 77.4 | 100 | 0 | - |
1 Нерозчинний залишок відповідає продуктам, які не розчиняються ні в 5% NaOH, ні в дистильованій воді.
Суміш продуктів із ступенями полімеризації від 10 і вище до мономерів глюкози була виявлена в екстрактах обробленої EBP целюлози методом хроматографії, іоновиділяючої колони Rezex RSO-олігосахарид Ag + (4%) (Phenomenex, Torrance, Каліфорнія, США). Водорозчинні НМГ мають ступінь полімеризації переважно в діапазоні 3–10. Також спостерігались продукти з меншою (до мономерів глюкози) та вищою молекулярною масою (рис. 3). Спочатку концентрація НМГ падає зі зменшенням ступеня полімеризації до 6, а потім знову підвищується. Розподіл молекулярної маси сформованих продуктів представлений на малюнку 4. Формування LMWP з переважним тетрамером також було підтверджено аналізом 13 C-ЯМР.
Лігандобмінна хроматограма водорозчинної целюлози LMWP, отримана завдяки EBP-обробці: 1 - глюкоза; 2–10 — НМП з різним ступенем полімеризації (цифри відповідають ступеню полімеризації); RI — показник заломлення.
Розподіл молекулярної маси продуктів, що утворюються при EBP-обробці целюлози: 1 - вихідна целюлоза; 2 - целюлоза, оброблена в EBP протягом 2 хв; 3 - целюлоза, оброблена в EBP протягом 10 хв.
Хроматографія виключення обробленого EBP хітину виявила утворення низькомолекулярних хітоолігосахаридів (COS) із середньою масовою молекулярною масою, Mw = 1000–2000 Da та індексом полідисперсності 2,2.
Оскільки формування COS з Mw = 800–2000 Da та ступінь полімеризації, що змінюється від димерів до гептамерів під час стимульованого EBP руйнування хітозану, було доведено раніше [17], той самий механізм стимульованої EBP обробки для всіх полісахаридів може бути передбачається.
2.2.2. Основні особливості переробки полісахаридів EBP
Наші сучасні експерименти виявили залежність водорозчинного виходу ЗМГ від часу обробки, а також були виявлені деякі інші властиві особливості обробки EBP хітину та целюлози:
В оптимізованих умовах обробки (тиск середовища, що генерує плазму, характеристики електронного пучка, конструкція змішувального пристрою) було потрібно лише 2 хв для отримання 85% виходу низькомолекулярної COS із вихідного порошку хітину [17]. Максимальний вихід целюлозного водорозчинного НМГ (77,4%) був отриманий через 10 хв (табл. 1).
Порогова залежність між виходом НМГ та тривалістю лікування EBP. В оптимізованих умовах лікування руйнування хітину та целюлози припинялося, коли час обробки досягав 7 та 15 хв відповідно.
2.2.3. Характеристика хімічної структури
Виявлено 30% зменшення впорядкованої фази в оброблених зразках целюлози щодо вихідної речовини, тоді як вміст аморфної фракції збільшено. Індекс кристалічності целюлози (ДІ) визначали методом XRD. Встановлено, що аморфність зростає після плазмохімічної обробки: ДІ модифікованої целюлози становив 76,4%, тоді як ДІ необробленої речовини 86,4%. Така ж тенденція була показана і для хітину. Попередні експерименти виявили втрату ДІ в таких межах: від 61,1% до 65,9% (вихідний хітин) до 50,9-55,2% після обробки EBP в кисневмісних середовищах.
Низькотемпературний EBP є джерелом кількох активних видів кисню (O, O •, синглетний кисень, OH • та ін.) (Рис. 5), які утворюються в плазмохімічних процесах у дуже високих концентраціях (до 10 10 –10 11 см −3) [18]. Ці частинки можуть бути відповідальними як за руйнування полісахаридів, так і за їх окислення. Для виявлення змін окислення в молекулах полісахаридів внаслідок обробки киснем була застосована FTIR-спектроскопія. Аналіз ІЧ-спектрів целюлози показав інтенсивне поглинання при 1720–1750 см -1 (рис. 6), що можна пояснити значним збільшенням карбонільних C = O груп [20].
Оптичний спектр кисню EBP у видимому та NIR діапазонах; піки, віднесені до різних видів кисню, відповідають [21,22].
- Переробка хітину і целюлози в низькотемпературній електронно-променевій плазмі - PubMed
- Підсумковий звіт Екокомпозити, зміцнені наночастинками целюлози, альтернатива існуючим
- Збір та оцінка реконвалесцентної плазми для лікування COVID ‐ 19, чому і як Tiberghien - 2020
- Підвищений ендотелін-1 у плазмі крові пов’язаний із зменшенням втрати ваги після гастректомії вертикального рукава
- Обробка ваги продукту за допомогою управління складом - Управління ланцюгами поставок Dynamics 365