Окисне деметилювання 3-метилтиміну та 3-метилурацилу в одноланцюговій ДНК та РНК FTO миші та людини
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, штат Іллінойс, 60637, США
Кафедра прикладної хімії Китайського сільськогосподарського університету, Пекін 100094, Китай
Обидва автори внесли однаковий внесок у цю роботу. Цього автора підтримала Китайська рада стипендіатів. Шукайте більше статей цього автора
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, штат Іллінойс, 60637, США
Обидва автори внесли однаковий внесок у цю роботу. Шукайте більше статей цього автора
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, штат Іллінойс, 60637, США
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Кафедра прикладної хімії Китайського сільськогосподарського університету, Пекін 100094, Китай
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Відповідний автор. Факс: +1 773 702 0805. Шукайте інші статті цього автора
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Кафедра прикладної хімії Китайського сільськогосподарського університету, Пекін 100094, Китай
Обидва автори внесли однаковий внесок у цю роботу. Цього автора підтримала Китайська рада стипендіатів. Шукайте більше статей цього автора
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Обидва автори внесли однаковий внесок у цю роботу. Шукайте більше статей цього автора
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Кафедра прикладної хімії Китайського сільськогосподарського університету, Пекін 100094, Китай
Хімічний факультет Чиказького університету, 929 East 57th Street, Чикаго, Іллінойс 60637, США
Відповідний автор. Факс: +1 773 702 0805. Шукайте інші статті цього автора
Анотація
Ген сприйнятливості до ожиріння людини, FTO, кодує білок, гомологічний відновленому ДНК білку AlkB. Білки сімейства AlkB використовують залізо (II), α-кетоглутарат (α-KG) та діоксиген для здійснення окисного відновлення алкільованих нуклеобаз в ДНК та РНК. Ми демонструємо тут окислювальне деметилювання 3-метилтиміну (3-меТ) в одноланцюговій ДНК (ssDNA) та 3-метилурацилу (3-meU) в одноланцюговій РНК (ssRNA) шляхом рекомбінантного людського білка FTO in vitro. Білки FTO як людини, так і миші переважно відновлюють 3-меТ в ssDNA перед іншими випробуваними базовими ураженнями. Вони показали незначну активність проти 3-меТ у дволанцюжковій ДНК (dsDNA). Крім того, ці два білки можуть каталізувати деметилювання 3-меУ в ssRNA з трохи вищою ефективністю порівняно з 3-meT в ssDNA, припускаючи, що метильовані РНК є найкращими субстратами для FTO.
1. Вступ
Алкілуючі агенти з навколишнього середовища або утворені всередині клітин можуть атакувати N- або O-атоми нуклеобаз, що може призвести до ушкодження основи алкілування, що вимагає швидкого відновлення [1]. Майже всі живі організми створили різні механізми для розпізнавання та обробки цих модифікацій. Серед них пряме видалення алкильних аддуктів з пошкоджених основ є однією з найбільш ефективних стратегій відновлення [2]. Сімейство білків AlkB виконує цей тип безпосереднього відновлення, використовуючи механізм окисного деметилювання (рис. S1).
Кишкова паличка Білок AlkB належить до надродини α-кетоглутаратів (α-KG) - та Fe 2+ -залежних діоксигеназ [2-9]. Його гомологи містяться у вірусах, бактеріях та еукаріотах. Хоча до 2007 р. Було виявлено вісім людських гомологів (ABH1‐8) [10, 11], лише ABH2 та ABH3 підтвердили, що мають подібну функцію відновлення до AlkB [4, 5, 12]. Зокрема, було встановлено, що ABH2 головним чином відповідає за відновлення пошкоджень 1-метиладеніну (1-meA) в геномній ДНК, тоді як точна роль ABH3 залишається незрозумілою [13]. ABH2 віддає перевагу субстратам дволанцюжкової ДНК (dsDNA) перед одноланцюговими ДНК (ssDNA); однак як hABH3, так і AlkB є більш активними щодо субстратів ssDNA та одноланцюгової РНК (ssRNA) [4, 14]. Лише нещодавно механізми, що лежать в основі субстратних переваг цих білків, були з’ясовані за допомогою рентгенівських структурних досліджень комплексів AlkB – dsDNA та ABH2 – dsDNA [15]. Білок ABH2 приймає загально спостережуваний механізм гортання основи із залишком пальця, який інтеркалює всередині дуплекса ДНК, щоб заповнити щілину, залишену перевернутою основою [15]. Проте білок AlkB видавлює дуплекс ДНК, щоб усунути щілину, залишену гортанням основи. Це спотворення, накладене AlkB на ДНК, пояснює її перевагу перед гнучкою ssDNA перед порівняно жорсткою дуплексною ДНК [15] .
Всі три ці білки виявляли найвищу активність проти 1-меА і 3-метилцитозину (3-меС) [4-7], але при меншій активності вони також можуть переробляти 1-метилгуанін (1-меГ) і 3-метилтимін (3 ‐MeT) [16, 17]. Крім того, показано, що AlkB, ABH2 та ABH3 відновлюють екзоциклічні ураження основи ДНК: 1,N 6-етеноаденин (εA) та (або) 3,N 4-етеноцитозин (εC) [18-20] .
2 Матеріали та методи
2.1 Побудова, експресія та очищення mFTO та hFTO
Послідовності кДНК, що кодують повну довжину mFTO (ID зображення: 4237261) та hFTO (GenBank Accession No. NP_001073901.1), були субклоновані в pET28a для отримання злитого білка His-tagged. Плазміди трансформувались в Кишкова паличка BL21 Star (DE3) та бактерії вирощували на пластинах LB ‐ агару, що містять 50 мг/л канаміцину. Попередні культури протягом ночі, які вирощували аеробно при 37 ° C зі швидкістю струшування 190 об/хв, використовували для інокуляції середовища LB LB 50 мг/л канаміцину і вирощували при 37 ° C і 250 об/хв, поки OD600 не досяг 1,0. Потім бактеріальні клітини індукували ізопропіл-β-d-тіогалактопіранозидом (IPTG) (0,5 мМ) при 15 ° C і вирощували протягом ночі при 15 ° C і 250 об/хв. Клітини збирали центрифугуванням, заморожували рідким азотом і зберігали при -80 ° C. Всі наступні етапи проводили при 4 ° C. Клітинні гранули ресуспендували в буфері А (50 мМ імідазолу, 300 мМ NaCl, 50 мМ фосфату натрію, рН 8,0), обробляли ультразвуком на льоду і центрифугували при 12000 об/хв протягом 22 хв. Відфільтрований супернатант очищали за допомогою хроматографії Ni-NTA (GE Healthcare). Фракції, зібрані з колонки, додатково очищали за допомогою гель-фільтраційної колони (GE Healthcare). Фракції аналізували за допомогою денатурації SDS – PAGE.
2.2 Відновлення метильованої ДНК та РНК за допомогою mFTO та hFTO
Типова реакційна суміш (100 мкл) містила ДНК/РНК (1 нмоль), FTO (0,05–0,5 нмоль), (NH4) 2Fe (SO4) 2 · 6H2O (283 мкМ), α-KG (300 мкМ), L‐ аскорбінова кислота (2 мМ), бичачий сироватковий альбумін (BSA, 50 мкг мл -1) та 50 мМ 2‐ (N-Морфоліно) буфер етансульфонової кислоти (MES) (рН 6,0). Це інкубували протягом 12 годин при 16 ° C. Реакцію гасили додаванням етилендіамінтетраоцтової кислоти (EDTA) до 5 мМ.
2.3 Аналіз перетравлення ферментів обмеження
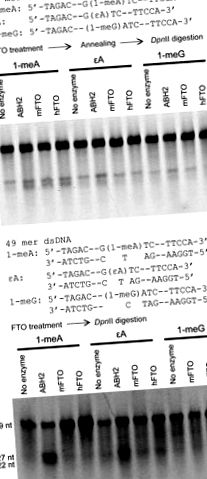
Раніше опублікована процедура [13, 15] була використана для оцінки відновлення 49-мерного олігонуклеотиду, що містить 1-meA, 1-meG та εA в послідовності розщеплення DpnII. Послідовність була [5′ ‐ TAGACATTGCCATTCTCGATAGG (замінено 1 ‐ меГ) A (замінено на 1 ‐ меА або εA) TCCGGTCAAACCTAGACGAATTCCA ‐ 3 ′ доповнює 5′ ‐ TGGAATTCGTCTAGGTTTGACCGGATCCTATCGAGAATGGCAATGTCTA ‐ 3 ′]. Реакції проводили при 37 ° C протягом 1 години та 16 ° C протягом 12 годин з 0,2 нмоль FTO і 0,2 нмоль субстратів. Для ssDNA субстрати відпалювали до комплементарної ланцюга для аналізу травлення після інкубації з білком FTO та кофакторами.
2.4 Перетравлення ДНК/РНК та аналіз ВЕРХ
Після реакції відновлення 15-мерна ssDNA/ssRNA перетравлювалася в нуклеозиди з нуклеазою P1 (Sigma, N8630) та лужною фосфатазою (Sigma, P4252), на основі попередньої процедури [27]. Розчин для розщеплення аналізували в ізократичній високоефективній рідинній хроматографії (ВЕРХ), оснащеній колоною поділу С18 (150 × 4,6 мм), збалансованою буфером А (водний розчин класу ВЕРХ, що містить 50 мМ ацетату амонію) і буфером В (50 мМ амонію ацетату, 50% ацетонітрилу, 50% води та 0,1% трифтороцтової кислоти (TFA) при співвідношенні 95: 5 (об/об) зі швидкістю потоку 1 мл хв -1 при кімнатній температурі. Довжина хвилі виявлення була встановлена на 266 нм (для 3-меТ) або 261 нм (для 3-меУ).
2.5 Кінетика mFTO та hFTO
Щоб визначити К м і К значення котів для реакцій відновлення, початкові показники отримували, підтримуючи концентрацію ферменту постійною та змінюючи концентрацію субстрату. Реакції коригували, щоб гарантувати, що було витрачено менше 20% субстрату. Всі реакції проводили при 20 ° C у трьох примірниках та аналізували за походженням 8.0 за рівнянням Майкеліса – Ментена.
3 Результати та обговорення
Повну довжину mFTO та hFTO клонували, експресували та очищали (рис. S2). Аналіз перетравлення ендонуклеазного розщеплення з використанням DpnII був прийнятий для оцінки відновної активності як hFTO, так і mFTO щодо 1-meA, 1-meG і εA в ssDNA або dsDNA [13, 15, 28]. Модифікована 49-мерна ДНК з 1-meA, 1-meG або εA, включеною в послідовність GATC, стійка до розщеплення DpnII. Видалення базового ураження FTO дозволяє DpnII розщепити 49-мерний зонд ДНК на два фрагменти, забезпечуючи аналіз відновної діяльності (рис. 1). Як повідомлялося раніше [21], ми виявили дуже низьку активність обох білків щодо відновлення 1-меА в 49-мерній ssDNA (рис. 1А). Обидва білки не змогли відновити 1-меА в dsDNA (стехіометрична кількість) після 12-годинної інкубації при 16 ° C (рис. 1B) або 1 години при 37 ° C (дані не наведені); тоді як очищений ABH2 виявляв хорошу ремонтну активність 1-meA та εA в dsDNA за тих самих умов (рис. 1B). Крім того, ми не спостерігали жодної помітної активності mFTO або hFTO щодо εA та 1-meG ні в ssDNA, ні в dsDNA. Основне ураження 3-меТ, включене до послідовності розщеплення DpnII, не може блокувати ферментативне перетравлення зонда ДНК. Таким чином, для оцінки відновлення цього базового ураження був використаний інший аналіз.
Для зондування 3-меТ-деметилювання білками FTO синтезовано та очищено 15-мерну ssDNA [5′-CTTGTCA (3-меТ) CAGCAGA-3 '] із 3-меТ, включеною в середину. Цю ДНК перетравлювали в нуклеозиди за допомогою нуклеази Р1 та лужної фосфатази, а потім аналізували за допомогою ВЕРХ. Як показано на рис. 2 А, нуклеозиди dC, dG, dT, dA та 3-medT можуть бути чисто розділені. Зміна інтенсивності піку 3-medT моніторили з використанням інших піків нуклеозидів як внутрішніх еталонів. 3-meT-містить ssDNA інкубували або mFTO, або hFTO при 16 ° C протягом 12 годин. Після гасіння реакції вміст 3-меТ вимірювали за допомогою аналізу травлення та аналізу ВЕРХ. Результати показали повне деметилювання 3-меТ в ssDNA як mFTO, так і hFTO (рис. 2А). Коли 15-мерну 3-meC-вмісну ssDNA піддавали такому ж репараційному аналізу, лише ~ 15% 3-meC деметилювали через 12 годин за тих самих умов (рис. 2B), демонструючи сильну перевагу білків FTO щодо 3 ‐MeT понад 3 ‐ меС.
Однак майже незначна активність деметилювання ([29] (рис. S5) та 300 мкМ α-KG було обрано для подальших досліджень. Далі були оцінені профілі активності pH для деметилювання 3-meT в ssDNA та 3‐ meU в ssRNA. У випадку mFTO спостерігалося зниження активності деметилювання із збільшенням pH як для ssDNA, так і для субстратів ssRNA (рис. 3 A і B). Однак hFTO виявляв найвищу активність при pH 6,0 як для ssDNA, так і для субстрати ssRNA (рис. 3C і D). Таким чином, ми вибрали pH 6,0 для детального кінетичного аналізу.
Кінетичні дослідження проводили при 20 ° C з різними концентраціями ssDNA або субстратів ssRNA. Результати показані на рис. 4 та зведені в таблиці 1. Білок mFTO продемонстрував вищу активність щодо субстратів ssDNA та ssRNA, ніж hFTO. Слід зазначити, що цей результат може не відображати активності in vivo цих білків, оскільки очищений рекомбінантний mFTO видається більш стабільним, ніж очищений рекомбінантний hFTO in vitro. Кінетичні дослідження показали, що як mFTO, так і hFTO виявляють подвійну перевагу 3-меУ в ssRNA як субстраті перед 3-meT в ssDNA. Експерименти повторювались у трьох примірниках з одержанням подібних результатів.
| mFTO | ssDNA (3 ‐ меТ) | 1,92 ± 0,43 | 0,089 ± 0,008 | 0,046 ± 0,019 |
| ssRNA (3 ‐ меУ) | 2,08 ± 0,31 | 0,199 ± 0,009 | 0,096 ± 0,029 | |
| hFTO | ssDNA (3 ‐ меТ) | 0,95 ± 0,12 | 0,007 ± 0,0002 | 0,007 ± 0,002 |
| ssRNA (3 ‐ меУ) | 8,51 ± 3,13 | 0,115 ± 0,022 | 0,014 ± 0,007 |
Підводячи підсумок, це дослідження вперше встановило активність деметилювання ДНК/РНК рекомбінантного hFTO (рис. 5). Як mFTO, так і hFTO не виявляли помітної активності щодо εA та 1-meG в ssDNA. Для цих двох білків спостерігалася дуже низька активність деметилювання 1-меА в ssDNA. Вони також можуть каталізувати деметилювання 3-меС в ssDNA, але з набагато меншою ефективністю порівняно з 3-meT в ssDNA. Як mFTO, так і hFTO не змогли відновити базові ураження в dsDNA, настійно припускаючи, що вони беруть участь в обробці ssDNA або ssRNA.
Важливо, що ми показали, що як рекомбінантний hFTO, так і mFTO можуть деметилювати 3-meU в ssRNA in vitro (рис. 5). Активність деметилювання РНК білка FTO дещо ефективніша, ніж деметилювання 3-меТ в ssDNA, опосередкованому тими ж білками. Беручи до уваги незначне відновлення субстратів dsDNA білками FTO та їхні незначні переваги щодо 3 µU в ssRNA порівняно з 3 µM у ssDNA, привабливо запропонувати FTO як РНК-деметилазу [21]. Можливо, це каталізує зворотну реакцію раніше нерозпізнаного метилювання РНК і здійснює функцію регуляції генів на рівні РНК. Порушення цієї регулюючої ролі FTO може призвести до фенотипу ожиріння, пов'язаного з цим білком. Звичайно, для подальшої перевірки цієї гіпотези потрібні детальні експерименти in vivo. Ця поточна робота служить першою всебічною оцінкою діяльності як mFTO, так і hFTO in vitro і забезпечує основу для подальшого дослідження ролі цієї дуже цікавої деметилази нуклеїнової кислоти.
- Дієта з одним інгредієнтом; sassyfitnesschick
- Простота інгредієнтів - шавлія без глютену
- Дослідження разової зростаючої дози AMG 133 у пацієнтів з ожирінням - Повний текст
- Дослідження одноразової та багаторазової висхідної дози AMG 171 у пацієнтів із ожирінням - Повний текст
- Оксидативний стрес, патології, пов'язані зі старінням плаценти, та несприятливі наслідки вагітності - Султана -