Хвороба Лі: Гострий клінічний перебіг дворічної дитини з підгострою некротизуючою енцефаломієлопатією
1 Інститут юридичної медицини Мюнхенського університету, Nussbaumstraße 26, 80336 Мюнхен, Німеччина
Анотація
Ми повідомляємо про нетиповий клінічний перебіг раніше здорової дворічної дівчинки, яка раптово та несподівано померла після епізоду блювоти. На судово-медичному розтині неможливо діагностувати жодних інших патологічних знахідок, крім множинних червонуватих, опущених ділянок в стовбурі мозку, довгастому мозку та мозку. Гістологічно вони представлені як ділянки спонгіозу нейропіла з помітною гіперплазією ендотелію та судинною проліферацією, тоді як нервові клітини добре збереглися. На підставі характерних невропатологічних висновків у поєднанні з віком дитини, нам довелося взяти до уваги, що дитина могла померти від підгострої некротизуючої енцефаломієлопатії (хвороби Лі), незважаючи на нетиповий фульмінантний клінічний перебіг.
1. Вступ
Зазвичай підгостра некротизуюча енцефаломієлопатія має клінічний перебіг щонайменше кілька місяців та вражаючі клінічні ознаки. Але, можливо, є недокументовані несподівані смерті, які можна було б діагностувати як підгостру некротизуючу енцефалопатію лише при посмертному обстеженні, якщо воно проводиться через нетипове прогресування.
2. Звіт про справу
Раніше здорова 24-місячна дівчина із супутнім косоокістю, пов’язаною з ністагмом, потрапила до дитячої лікарні. Крім того, мати дівчинки повідомила про неспецифічні симптоми, такі як дефіцит уваги, зниження пильності, підвищена нервозність та "проблеми взаємодії".
Під час огляду дівчина виявила загальний стан здоров’я з належним харчуванням. Зафіксовано, що фізичний та психомоторний розвиток є нормальним. Клінічні обстеження, включаючи лабораторні обстеження, а також неврологічне обстеження з магнітно-резонансною томографією (МРТ), яке проводилось як запобіжний захід для виключення внутрішньочерепного захворювання, були визнані нормальними. Електроенцефалографія показала незначне зниження пильності, пов’язане з різкохвильовою та тета-ритмовою активністю. Офтальмологічно діагностовано косоокість, супутню дивергенцію. Дитині дозволили повернутися додому, але рекомендували офтальмологічне спостереження.
Через три місяці дитину почало блювати вдома. Нарешті викликали фельдшерів, оскільки дівчина втратила геморагічний слиз із носа. Незабаром після цього вона втратила свідомість, а коли прибули санітари, вона вже була клінічно мертва. Реанімація була невдалою. Смерть приписували аспірації під час передбачуваного епілептичного нападу.
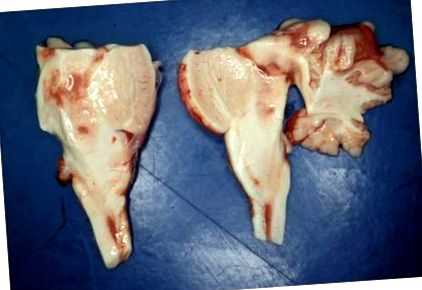
Судово-медична експертиза дівчини показала мало порушень; зокрема серце та легені не мали патологічних виявів. Лабораторні дослідження метаболізму глюкози, а також хіміко-токсикологічні дослідження показали нормальні результати, за винятком підвищеної концентрації лактату в крові (47,9 ммоль/л; посилання: Рисунок 1
Після фіксації мозок гістологічно досліджували (гематоксилін та еозин, крезил-фіолетовий, Luxol-Fast-Blue, ван-Гісон Еластика, PAS та Прусський синій).
Зрізи товщиною м були імуно забарвлені методом ABC. Для маркування астроцитів використовували моноклональне антитіло проти гліозного фібрилярного кислого білка (GFAP, розведення 1: 100, DAKO, Німеччина); для мікроглії використовували моноклональні антитіла проти антигену HLA-DP, DQ, DR (CR 3/43, розведення 1: 100, DAKO, Німеччина, перетравлення мурашиною кислотою). Антигени були виявлені за допомогою набору пероксидази Histostain-Plus (Zytomed, Німеччина).
Під час гістологічного дослідження було поширене гіпоксично-ішемічне пошкодження нервових клітин у основних частках, зубчастому ядрі та клітинному шарі Пуркіньє. На зрізах хвостатих ядер, таламуса, гіпоталамуса, довгастого мозку, моста та довгастого мозку були поширені вогнища спонгіозу нейропіла з помітною гіперплазією ендотелію та судинною проліферацією. Окрім гіпоксично-ішемічних змін, нервові клітини були відносно добре збережені (рис. 3). Імунофарбування для GFAP виявило помітний астрогліоз. Біла речовина півкуль головного мозку, утворення гіпокампа, довгастий мозок та тіла соскоподібних органів були нічим не примітними.
3. Обговорення
Рідкісна підгостра некротизуюча енцефаломієлопатія була вперше описана Leigh [1] як клінічно та етіологічно сильно мінливий прогресуючий синдром, який спостерігається особливо у педіатричної популяції, хоча відомо кілька випадків неповнолітніх та дорослих [2, 3].
Неспецифічні, гетерогенні та, мабуть, вікові зміни клінічних симптомів та перебігу можуть бути пов’язані з виявленням різних ферментних дефектів при цій хворобі. Вже були виявлені дефекти мітохондрій, а також ядерних ферментів ДНК [2, 4, 5], які визначають подібні клінічні перебіги, але трапляються в різному віці. Клінічні симптоми також визначаються тим, яка область мозку уражена.
Інфантильна форма зазвичай починається протягом перших двох років життя з неспецифічними симптомами та уповільненням психомоторного розвитку. Інші симптоми включають дефіцит уваги, гіпотонію кінцівок, порушення зору, включаючи ністагм, слабку силу, блювоту, небажання їсти та втрату ваги [2, 4, 6]. Нерідко розвиваються такі неврологічні симптоми, як атаксія, дефіцит пірамідного тракту, апраксія та міоклонія, а потім офтальмоплегія та респіраторні труднощі як ознака ураження стовбура мозку [2].
Відомо, що вроджена недостатність цитохром-с-оксидази, дефіцит піруват-дегідрогенази, а також дефіцит біотинідази викликають ці клінічні симптоми [4, 7, 8]. Ці стани, ймовірно, мають аутосомно-рецесивне успадкування, хоча мітохондріальне та материнське успадкування обговорюється, а епізодичні випадки відомі [3, 4]. Генетичні порушення можна виявити лише приблизно у 50% усіх пацієнтів, що свідчить про те, що існує багато інших біохімічних порушень, які можуть призвести до клінічного синдрому хвороби Лі [8].
Спеціальних біохімічних тестів все ще бракує, однак майже завжди виявляється лактатний ацидоз та підвищений коефіцієнт лактат-піруват у плазмі та лікворі [4]. Пошуки мутацій мітохондріальної ДНК як загальної причини хвороби Лі і біохімічне дослідження біоптатів м’язів досі залишаються золотим стандартом у діагностиці [9, 10].
При невропатологічному дослідженні головного мозку можна макроскопічно визначити центральні ураження червоно-коричневого кольору в областях стовбура мозку, путамен, базальних гангліїв, таламуса та заднього рогу спинного мозку [6].
На ранній стадії нейропіл пошкоджується спонгіозом, а потім проліферацією капілярів, астрогліозом та збільшенням кількості макрофагів. У процесі захворювання відбувається демієлінізація, яка залишає нейрони та аксони майже цілими. Це дозволяє, наприклад, диференціювати від ішемічних/гіпоксичних уражень [1, 2, 6, 7]. Зокрема, уражаються довгастий мозок, понс, хвостатий, довгастий мозок, центральні черепно-мозкові ядра, нижчі яєчні ядра, мозочок, базальні ганглії та зоровий нерв [6].
Деструкція мозкової тканини спричинює прогресуючу неврологічну дисфункцію, яка регулярно закінчується смертю приблизно через два роки після діагностики через параліч центрального дихання. В даний час не існує лікувальної терапії [3, 4, 6].
МРТ показує симетричне, гіподенсне (T1) та гіперденсоване (T2) ураження в базальних гангліях, що зачіпає особливо область хвостатої частини та путамен. Подібні ураження спостерігаються також при енцефалопатії Верніке, розсіяному склерозі, хворобі Вільсона, сечовині амінокислот, мітохондріальних енцефаломієлопатіях та різних формах інтоксикації [3]. На відміну від енцефалопатії Верніке, сосочкові тіла позбавлені патологічних змін [3]. Диференціація хвороби Вільсона можлива шляхом лабораторних досліджень крові [4].
На даний момент більшість симптоматичних методів лікування намагаються поліпшити окислювальні та біоенергетичні можливості мітохондрій [6]. Застосування коензиму Q10, тіаміну та карнітину в декількох випадках може спричинити зменшення вираженості симптомів [6]. Cacic та співавт. повідомляють, що симптоми у 19-річного чоловіка підтримували стабільність протягом принаймні чотирьох років завдяки терапії, що включала леводопу, карбідопу та моногідрат креатиніну [8].
4. Висновки
У представленому випадку діагноз хвороби Лі можна було отримати лише після смерті, хоча за три місяці до смерті проводили МРТ та лабораторні дослідження. Вони показали нормальні результати, крім того, інших типових симптомів, таких як затримка психомоторного розвитку, слабкість, труднощі з харчуванням або типові неврологічні симптоми, не спостерігалося. Клінічні симптоми у день смерті, ймовірно, мали переважно гостре мозкове походження. Однак післясмертне обстеження показало морфологічні дані мозку дитини, які є специфічними для хвороби Лі. Підвищена концентрація лактату в крові та лікворі може бути підтверджена при посмертному дослідженні, що є типовим для хвороби Лі, але це можна побачити на багатьох розтинах через генералізовану агональну клітинну гіпоксемію.
Передбачається, що у цьому звіті описується незвичний, "гострий" перебіг нормально підгострої некротизуючої енцефаломієлопатії з вражаюче коротким і переважно непомітним клінічним перебігом.
Подяки
Автори висловлюють подяку пану А. Нерліху, директору Інституту патології лікарні Мюнхен-Богенгаузен та пану В. Фейдену, директору Інституту невропатології Університетської лікарні Саарської області за надані консультації.
Список літератури
- Д. Лі, "Підгостра некротизуюча енцефаломієлопатія у немовляти", Журнал неврології, нейрохірургії та психіатрії, вип. 14, с. 216–221, 1951. Переглянути за адресою: Google Scholar
- Р. Дж. Хантсман, Д. Б. Сінклер, Р. Бхаргава та А. Чан, “Нетипові презентації синдрому Лі: серія випадків та огляд”, Дитяча неврологія, вип. 32, ні. 5, с. 334–340, 2005. Переглянути на: Сайт видавця | Google Scholar
- М. Шпрангер, С. Шваб, М. Вібель та К.-М. Беккер, “Das adulte Leigh-syndrome”, Нервенарц, вип. 66, ні. 2, с. 144–149, 1995. Перегляд за адресою: Google Scholar
- Р. Томчак, А. Рібер, Х. Цайтлер та Х.-Ж. Brambs, "Neugeborenes mit zerebraler simptomatik", Рентгенолог, вип. 36, ні. 7, с. 591–592, 1996. Перегляд за адресою: Google Scholar
- С. Саваста, Г. П. Комі, М. П. Періні та ін., “Хвороба Лея: клінічне, нейрорадіологічне та біохімічне вивчення трьох нових випадків з дефіцитом цитохром-оксидази”, Журнал дитячої неврології, вип. 16, № 8, с. 608–613, 2001. Перегляд за адресою: Google Scholar
- A. A. S. R. Mannan, M. C. Sharma, P. Shrivastava et al., “Синдром Лі”, Індійський журнал педіатрії, вип. 71, ні. 11, с. 1029–1033, 2004. Перегляд за адресою: Google Scholar
- М. Кримі, А. Пападімітріу, С. Гальбіаті та ін., "Нова мутація мітохондріальної ДНК у гені ND3, що викликає важкий синдром Лі з ранньою летальністю", Дитячі дослідження, вип. 55, ні. 5, с. 842–846, 2004. Переглянути на: Сайт видавця | Google Scholar
- М. Качич, Е. Віліховскі, В. Меяскі-Бошняк та співавт., "Часткова недостатність цитохрому с-оксидази, пов'язана з хворобою Лея, що проявляється як екстрапірамідний синдром" Журнал дитячої неврології, вип. 16, № 8, с. 616–619, 2001. Перегляд за адресою: Google Scholar
- Е. Пронічка, Д. Пієкутовська-Абрамчук та М. Проніцький, „Хвороби метаболізму у дітей, включаючи синдром Лі - біохімічний та молекулярний фон”, Постепи Біохімія, вип. 54, ні. 2, с. 161–168, 2008. Перегляд за адресою: Google Scholar
- К. Naess, C. Freyer, H. Bruhn et al., "Мутації MtDNA є частою причиною важких фенотипів захворювання у дітей з синдромом Лі", Biochimica et Biophysica Acta, вип. 1787, ні. 5, с. 484–490, 2009. Переглянути на: Сайт видавця | Google Scholar
- Вплив надмірної ваги та ожиріння на функціональні та клінічні результати ранньої хвороби Паркінсона
- Хвороба Лі або синдром UMDF
- Довгострокові результати після гострого некротизуючого панкреатиту Що відбувається з підшлунковою залозою та
- Сторінка інформації про хворобу Ліга Національний інститут неврологічних розладів та інсульту
- Заходи способу життя при лікуванні шлунково-стравохідної рефлюксної хвороби, клінічної та