Інгібування цитохрому P450 3A ацетоксильованими аналогами ресвератролу в в пробірці і in silico моделі
Предмети
Анотація
Вступ
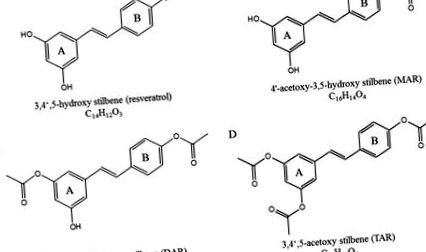
Хімічні структури ресвератролу (A), моноацетокси ресвератрол (B), ди-ацетокси-ресвератрол (C.) і три-ацетокси-ресвератрол (D).
Результати
Метаболізм тестостерону в клітинній лінії Caco-2/TC7
Окислення тестостерону CYP3A4 супроводжувалося вимірюванням залишкового тестостерону в реакційному середовищі під час інкубації з клітинами Caco-2/TC7 (рис. 2). В експериментальних умовах протягом перших 6 год інкубації спостерігали лінійну швидкість реакції. Кількісно визначали тестостерон за допомогою ВЕРХ-аналізу та калібрувальної кривої.
Метаболізм тестостерону в клітинній лінії Caco-2/TC7.
Дані є середніми ± S.E. з трьох копій.
Інгібування опосередкованого CYP3A4 метаболізму тестостерону в клітинній лінії Caco-2/TC7 ацетокси стильбенами
Вплив MAR, DAR та TAR на життєздатність клітин Caco-2/TC7 вимірювали, як описано. Жодна із сполук не спричинила зниження життєздатності клітин Caco-2/TC7 при застосуванні до рівня 100 мкМ, за винятком 100 мкМ TAR, що спричинило незначне зменшення проліферації клітин (рис. 3). Концентрація 100 мкМ була обрана як найвища концентрація, яка буде включена в пізніші експерименти, враховуючи незначне зниження життєздатності клітин, спричинене 100 мкМ TAR.
Життєздатність клітин Caco-2/TC7, коли в середовищі були різні концентрації моно/ді/три-ацетокси-ресвератролу.
Метаболізм тестостерону клітинами Caco-2/TC7 у культурі був використаний для вивчення взаємодії ацетокси стильбенів з CYP3A4. Усі досліджувані ацетокси стильбени пригнічували метаболізм тестостерону залежно від дози, суттєво відрізняючись від контролю, і максимальне інгібування було досягнуто застосуванням 50 мкМ (рис. 4). Однак TAR мав найслабшу здатність інгібувати всі досліджувані сполуки. Вираження результатів застосування 10 мкМ кожної сполуки у відсотках від контролю виявило подібну тенденцію, коли порядок здатності до інгібування становив DAR> MAR> TAR, з розрахунковими показниками 45%, 24% та 10% відповідно (рис. 5). Ресвератрол виявляв сильнішу здатність до інгібування, ніж усі ацетоксистильбени, при цьому 10 мкМ ресвератролу зменшували ферментативне окислення тестостерону більш ніж на 80% через 2 години інкубації. Це пригнічення було подібним до спостереження для кетоконазолу, добре відомого специфічного інгібітора CYP 3A (рис. 5). Через 2 години інкубації швидкість інгібування знижувалася у всіх обробках, але все ще була значно нижчою, ніж контрольна, виміряна під час кожного інкубаційного часу.
Інгібування метаболізму тестостерону в клітинах Caco2/TC7 різними концентраціями моноацетокси стильбена (A), ді-ацетокси стильбене (B) та триацетокси стильбену за час інкубації порівняно з контролем. Дані є середніми ± S.E. з трьох копій.
Інгібування метаболізму тестостерону в клітинах Caco2/TC7 за допомогою аналогів ацетокси, ресвератролу та кетоконазолу, у концентрації 10 мкМ порівняно з контролем за часом.
Інгібування активності мікросомального CYP3A ацетокси стильбенами
Було показано, що всі випробувані стильбени пригнічують мікросомальну активність CYP3A, вимірювану як зменшення вивільнення тритійованої води за рахунок гідроксилювання тестостерону [1,2,6,7–3 H (N)] (рис. 6). Швидкість інгібування, виражена у відсотках щодо контролю, вказувала на те, що найсильніше інгібування спостерігалося після застосування кетоконазолу, який мав значення IC50 14 мкМ. В цій системі IC50 ресвератролу, як оцінювали з кривих концентрація-відповідь, виявився 28 мкМ. Значень IC50 для MAR, DAR та TAR у цій системі неможливо розрахувати через низький рівень інгібування, викликаний цими речовинами. Згідно з результатами, отриманими для клітин TC7, TAR показав найнижчу здатність до інгібування, а застосування 10 мкМ TAR призвело до того ж ступеня інгібування, що і 100 мкМ. DAR та MAR демонстрували подібні потенції при застосуванні в концентрації 100 мкМ, їх потенції (44% та 48% інгібування відповідно) були подібними до потенціалу ресвератролу (рис. 6).
Інгібування опосередкованого CYP3A утворення тритійованої води.
Обчислювальний аналіз
Орієнтація та залишковий зв'язок кетоконазолу, виведені з рентгенівської структури людського CYP3A4 (код PDB 2V0M), послужили моделлю для обчислення взаємодій ресвератролу та синтезованих тут молекул. Щоб перевірити придатність обраної моделі стикування, ми спочатку стикували кетоконазол та забезпечили відновлення його зв’язку із сайтом зв'язування CYP3A4 до початкового стану, як у вихідній структурі 2V0M. Згідно з моделюванням стикування кетоконазолу, сайт зв'язування можна описати з точки зору трьох основних ознак: тверда гідрофобна область, донори/акцептори Н-зв'язків та електростатичні взаємодії. Гідрофобний кластер включає алкіл та алкіл-пі взаємодії між залишками CYP3A4 Leu210, Phe241, Ile301, Ala305 та Leu482 та хлорованим ароматичним кільцем та імідазольним кільцем молекули кетоконазолу. Основним залишком донора Н-зв’язку є CYP3A4 Arg372, який взаємодіє з кетоновим атомом кисню кетоконазолу; тоді як атоми кисню Ala370 служать акцепторами Н-зв’язків. Атом азоту гемової групи забезпечує подальше прикріплення до молекули завдяки її електростатичним взаємодіям (аніон-пі) з імідазольним кільцем кетоконазолу (рис. 7А та 8А, В).
Результати стикування лігандів у місці зв'язування CYP3A4, що показують взаємодіючі залишки: кетоконазол (A, Енергія CDOCKER = -40,752 ккал/моль; Енергія взаємодії CDOCKER = -60,612 ккал/моль) і ресвератролу (B, Енергія CDOCKER = -25,504 ккал/моль; Енергія взаємодії CDOCKER = -33.960 ккал/моль). Ліганди позначені сірими паличками, а залишки рецепторів - зеленими паличками. Зв'язки показані штриховими лініями, кодовані таким чином: гідрофобні взаємодії в пурпуровому кольорі, електростатична взаємодія в коричневому кольорі та водневі зв'язки в зеленому.
Карти гідрофобності (A, C) та водневі зв'язки (B, D) у місці зв'язування CYP3A4, стикованому різними лігандами: кетоконазолом (A, B); ресвератрол (C, D). Ліганди позначені сірими паличками, а залишки рецепторів - зеленими паличками.
Результати стикування лігандів у місці зв'язування CYP3A4, що показують взаємодіючі залишки: MAR (A, Енергія CDOCKER = -21,741 ккал/моль; Енергія взаємодії CDOCKER = -29,358 ккал/моль, DAR (B, Енергія CDOCKER = -25,733 ккал/моль; Енергія взаємодії CDOCKER = −34,376 ккал/моль) і TAR (C., Енергія CDOCKER = -29,487 ккал/моль; Енергія взаємодії CDOCKER = -36,707 ккал/моль). Ліганди позначені сірими паличками, а залишки рецепторів - зеленими паличками. Зв'язки показані штриховими лініями, кодовані таким чином: гідрофобні взаємодії в пурпуровому кольорі, електростатична взаємодія в коричневому кольорі та водневі зв'язки в зеленому.
Карти гідрофобності (A, C, E) та водневі зв'язки (B, D, F) у місці зв'язування CYP3A4, стикованому різними лігандами: MAR (A, B), DAR (C, D) та TAR (Е, Ж). Ліганди позначені сірими паличками, а залишки рецепторів - зеленими паличками.
Обговорення
В останніх дослідженнях накопичено доказів, які свідчать про те, що між CYP3A4 та дієтичними поліфенолами існують потужні клінічно важливі взаємодії, включаючи флавоноїди, фенольні кислоти, фенольні спирти, стильбеноїди та лігнани 4. Інгібуючі ефекти т-ресвератрол на CYP3A4, обидва в пробірці і в природних умовах, добре задокументовані в літературі 15,16,17,18,19,37, а клінічні випробування виявили, що введення ресвератролу збільшує концентрацію деяких препаратів у плазмі крові 20,27. Кілька досліджень QSAR та фармакофорних карток вказують на важливість ліпофільності, а також на роль Н-зв'язків у визначенні взаємодії різних молекул з CYP3A4 28,29,31,33 .
Попереднє дослідження описувало вплив ліпофільності молекули на її взаємодію з CYP3A4 з використанням синтетичних модифікацій ресвератролу. Це дослідження показало, що метокси-стильбени мають нижчі значення IC50 і більшу спорідненість до CYP3A4, порівняно з вихідним ресвератролом та його глюкозидами 17. Наша недавня робота показала, що введення альдегідної групи в кільце А ресвератролу знижує його здатність інгібувати CYP3A4, як було продемонстровано в пробірці і in silico моделі. Ця знахідка підкреслює важливість електростатичних взаємодій молекули в активному центрі ферменту, крім гідрофобних та Н-зв’язків 37. На відміну від гідроксильної групи, ацетоксигрупа є великою і є сильним акцептором Н-зв’язку 39. Таким чином, поступове заміщення гідроксильних груп ацетокси-групами може не тільки збільшити ліпофільність молекули, але й ввести в молекулу акцептори Н-зв’язків. Тут ацетоксильовані стильбени служили для диференціації ліпофільності від взаємозв’язків між структурою та активністю при інгібуванні CYP3A4, використовуючи дві різні біологічні моделі та програмне забезпечення для моделювання.
Метаболізм тестостерону, опосередкований CYP3A4, з використанням клітин Caco-2/TC7 був розроблений так, щоб тривати 8 годин, щоб оптимально відображати проходження через кишечник. Лінійну криву спостерігали протягом 2-6 год інкубаційного періоду, що призвело до вибору цього інтервалу часу для дослідження інгібування кишкового CYP3A4 людини. Ми контролювали споживання субстрату, і, в цьому контексті, обробки значно відрізнялись від контролю протягом усіх досліджуваних періодів інкубації. Ресвератрол інгібував CYP3A4 способом, подібним до кетоконазолу, з розрахунковими значеннями IC50 відповідно до тих, що були представлені в попередніх роботах 16,40,41,42,43. Підвищення ліпофільності для досягнення вищого гальмування виявилося правильним для трансформації MAR у DAR, але не для ресвератролу в MAR або для додаткового ацетилювання з отриманням TAR. Дійсно, ми не могли розрахувати значення IC50 для ацетокси стильбенів, оскільки ми не змогли досягти достатнього інгібування в клітинах TC7 або в аналізі RLM. Наведені вище результати наочно демонструють важливість структурних властивостей для визначення інгібуючої здатності близькоспоріднених поліфенолів проти CYP3A4.
У недавньому дослідженні, дослідження стикування кетоконазолу, ресвератролу та ресвератрол-альдегіду в місці зв'язування продемонстрували роль, яку відіграють гідрофобні та електростатичні взаємодії у взаємодії поліфенолів з CYP3A 37. Подібним чином, обчислювальні засоби слугували для опису взаємодії харчових барвників з людським сироватковим альбуміном 44. Тут, використовуючи імітаційне моделювання, ми показали, що кетоконазол бере участь у сильних гідрофобних взаємодіях в активному центрі, на додаток до його електростатичної взаємодії з гемом та кількома Н-зв’язками (рис. 7А та 8А, В). Важливість ліпофільності ліганду CYP3A4 та його здатність встановлювати гідрофобні взаємодії добре задокументовані 4,17,31. Ресвератрол має менше гідрофобних взаємодій, ніж кетоконазол, що може пояснити його вищу енергію CDOCKER. Однак ресвератрол має сильні гідрофобні та електростатичні взаємодії з гемовою групою та її атомами заліза/азоту та Н-зв'язками з більшою кількістю залишків, ніж кетоконазол в активному центрі (рис. 7В та 8С, Г). Роль гемозаліза в метаболічному режимі дії ферментів CYP добре встановлена 45,46,47,48, як і внесок електростатичних взаємодій з гемовою групою у спорідненість лігандів до CYP3A4 37 .
На закінчення, ця робота вперше демонструє, що індукована субстратом модифікація активного центру CYP3A4 може бути передбачена за допомогою імітаційних моделей. Ці прогнози узгоджуються з результатами, досягнутими за допомогою кристалографії для рясного лікарського засобу, наприклад еритроміцин та його взаємодія з CYP3A4 49. Дійсно, низька здатність інгібування TAR як в клітинній лінії людини, так і в мікросомах печінки щурів може бути пояснена цими результатами моделювання. Отже, такі результати можуть надати унікальну ілюстрацію важливості близькості ліганду до активного центру ферменту. Загалом, використання програмних прогнозів разом із всебічним знанням способу дії ферменту та біологічних аналізів дозволяє глибше зрозуміти складні взаємодії фермент-субстрат.
Методи
Стандарти та хімікати
т-Ресвератрол (транс-3,4 ′, 5-тригідроксистильбен, 99%), тестостерон (99%) та кетоконазол (98%) були придбані у Sigma Aldrich, Ізраїль. Тестостерон [1,2,6,7- 3 H (N)] був придбаний у (Perkin Elmer, США). Всі інші хімічні речовини та реагенти були придбані у Sigma Aldrich, якщо не зазначено інше.
Ацетилювання ресвератролу
Синтез ацетоксильованих аналогів ресвератролу проводили за допомогою реакцій ацетилювання, як описано в 50. Розчин ресвератролу (0,6 г, 2,63 ммоль), ацетилхлориду (0,56 мл, 7,88 ммоль) і триетеламіну (1,009 мл, 7,88 ммоль) перемішували в 50-мл колбі з круглим дном з ацетоном (20 мл), діючи як розчинник. Після перемішування розчину протягом ночі його підкислювали (1 ЯМР ЯМР і 13 С ЯМР-спектри продуктів отримували 200-МГц ЯМР-спектрометром Bruker (Bruker Biospin GmbH, Rheinstetten, Німеччина).
ЯМР-аналіз
Моно-ацетокси-ресвератрол (MAR)
(4′-ацетокси-3,5-гідрокси-стильбен): 1 H ЯМР (200 МГц, MeOD, ppm): δ 2,26 (с, 3Н), 6,21 (т, J = 2,2 Гц, 1Н), 6,49 (д, J = 2,2 Гц, 2Н), 6,99–7,08 (м, 4Н), 7,49–7,54 (м, 2H). 13 З ЯМР (200 МГц, MeOD, ppm): δ 20,9 (CH3), 103,2, 106,1, 116,5, 122,9, 128,3, 130,2 (CH), 135,1, 136,6, 148,0, 151,6, 159,7, 171,2, 178,2 (C).
Діацетокси-ресвератрол (DAR)
(3,4'-ацетокси-5-гідрокси-стильбен): 1 H ЯМР (200 МГц, MeOD, ppm): δ 2,27 (с, 6Н), 6,45 (т, J = 2,2 Гц, 1H), 6,78 (q, J = 1,8 Гц, 1H), 6,86 (t, J = 1,8 Гц, 1H ), 7,04–7,15 (м, 4Н), 7,51–7,57 (м, 2Н). 13 З ЯМР (200 МГц, MeOD, ppm): δ 20,9 (CH3), 109,3, 111,8, 111,9, 124,8, 127,6, 129,2, 129,5 (CH), 136,9, 140,8, 151,7, 153,4, 157,1, 159,6, 171,1 (C).
Триацетокси-ресвератрол (TAR)
(3,4 ′, 5-ацетоксистилбен): 1 H ЯМР (200 МГц, MeOD, ppm): δ 2,30 (с, 9H), 6,83 (t, J = 2 Гц, 1H), 7,07–7,26 (m, 6H), 7,56–7,61 (m, 2H). 13 З ЯМР (200 МГц, MeOD, ppm): δ 20,9 (CH3), 115,7, 118,1, 120,4, 123,1, 128,1, 128,7 (CH), 130,7, 137,7, 151,9, 152,9, 170,7, 171,1, 174,8 (C).
Технічне обслуговування клітин Caco-2/TC7
Caco-2/TC7, субклон Caco-2, експресує високий рівень ферменту CYP3A4, який досить часто зустрічається в кишечнику людини 51,52,53. Клітинна лінія TC7 зазвичай використовується для вивчення метаболізму, опосередкованого CYP3A4, 54,55,56. Клітини Caco-2/TC7, використані в цьому дослідженні, були подарунком доктора М. Руссе (INSERM U505, Париж) 52. Протягом експерименту ці клітини підтримувались в асептичних умовах у модифікованому Дульбекко середовищі Eagle (DMEM) при 37 С з 5% СО2 та 95% повітря. DMEM доповнювали 20% фетальної бичачої сироватки, 100 одиниць/мл пеніциліну (Biological Industries, Ізраїль), 100 мкг/мл стрептоміцину (Biological Industries), 1% розчином незамінних амінокислот (концентрований 100X, Biological Industries) та 1 % Розчин L-глутаміну (200 мМ, Biological Industries). Середовище попередньо нагрівали до 37 ° C перед контактом з клітинами. Клітини Caco-2/TC7 використовували між пасажами 25 і 35 і вирощували в 75-сантиметрових колбах. Нові колби висівали в концентрації 3–4 × 10 4 клітин/см 2 .
Метаболізм тестостерону в клітинах Caco-2/TC7
ВЕРХ-аналіз
Аналіз рідинної хроматографії високого тиску (ВЕРХ) проводили на системі ВЕРХ Surveyor (Thermo Finnigan, США) з використанням колонки RP-C18 Luna 250 мм × 4,6 мм × 5 мкм (Phenomenex, США). Елюювання проводили водою (розчинник А) та ацетонітрилом (розчинник В) зі швидкістю потоку 0,7 мл/хв. Градієнт рухомої фази модифікували наступним чином: B в A (об/об), від 5–25% протягом 5 хв, від 25–75% протягом 10 хв, від 75–95% протягом 5 хв з наступним утриманням протягом 2 хв, знову знизився до 5% протягом 1 хв і утримувався протягом 4 хв. Зразки досліджували за допомогою детектора фотодіодних масивів при 244 нм для тестостерону та його метаболіту та при 280 нм та 306 нм для ресвератролу та його похідних. Піки сканували між 196 і 450 нм.
Аналіз життєздатності клітин
Вплив аналогів ацетокси стильбену на проліферацію клітин Caco-2/TC7 оцінювали методом МТТ. Клітини висівали на 96-лункові планшети щільністю 10 4 клітин на лунку та інкубували протягом 24 годин. Потім клітини обробляли DMEM (контроль) та аналогами ацетокси стильбену MAR, DAR та TAR при різних концентраціях (5, 10, 25, 50, 100 мкМ) протягом додаткових 8 годин. Клітини інкубували з 3- (4,5-диметилтіазол-2-іл) -2,5-дифенілтетразолію бромідом (МТТ, 0,5 мг/мл) протягом 1 год і проводили подальшу інкубацію з ДМСО протягом 20 хв. Утворення кольорового барвника формазану оцінювали колориметрично при 550 нм у зчитувачі мікропланшетів ELX 808 Ultra (BIO-TEK Instruments, Лондон, Великобританія) за допомогою програмного забезпечення KCJunior (Йорк, Великобританія).
Препарат мікросом печінки щурів
Метаболізм тестостерону мікросомальним CYP3A
Програмне забезпечення для обчислювального моделювання та моделювання
Додаткова інформація
Як цитувати цю статтю: Basheer, L. та ін. Інгібування цитохрому P450 3A ацетоксильованими аналогами ресвератролу в в пробірці і in silico моделі. Наук. Респ. 6, 31557; doi: 10.1038/srep31557 (2016).
- Інгібування транспортера сечовини покращує уремічну кардіоміопатію при хронічній хворобі нирок - Кума
- Вміст лютеїну та антиоксидантна активність in vitro у різних сортах квітки календули індійської
- Як підготуватися до запліднення in vitro 13 кроків
- М’ясні аналоги «Велика можливість» для поліпшення якості
- Дослідження in vitro показує позитивний вплив кетогенної дієти на функцію мітохондрій при синдромі Лі