Хронічний вплив дієти з високим вмістом жиру спричиняє порушення мієліну та регуляцію інтерлейкіну-33 в гіпоталамусі
Анотація
Передумови
Гіпоталамічне запалення, включаючи астрогліоз та активацію мікроглії, виникає після прийому дієти з високим вмістом жиру (HFD) у моделей гризунів або у людей із ожирінням. Однак ефект хронічного HFD-харчування на олігодендроцити (OLG) - гліальну популяцію мієліну в центральній нервовій системі (ЦНС) - залишається незрозумілим. У цьому дослідженні ми використовували 8-тижневих самців мишей C57BL/6, яких годували HFD протягом 3–6 місяців, щоб викликати хронічне ожиріння.
Результати
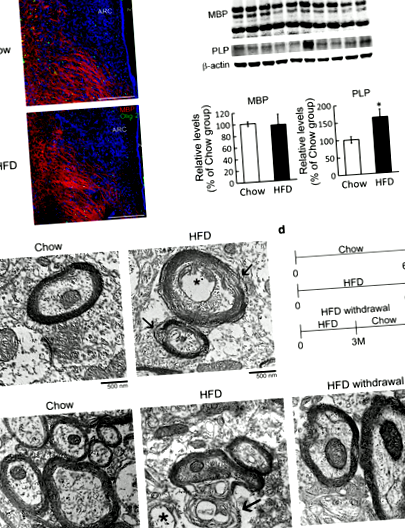
Аналіз візуалізації трансмісійної електронної мікроскопії показав, що цілісність гієталамічного мієліну була порушена після годування HFD протягом 4 та 6 місяців. Більше того, накопичення Iba1 + -мікроглії з амебоїдною гіпертрофічною формою постійно спостерігалося в дугоподібному ядрі мишей, що годувались HFD, протягом усього періоду годування. Інтерлейкін-33 (IL-33), тканинний тривожник при пошкодженні ЦНС, був виявлений із підвищеним рівнем у гіпоталамусі після годування HFD протягом 3 та 4 місяців. Крім того, дослідження in vitro показало, що вплив зрілих OLG на IL-33 порушує структуру клітин OLG разом із зниженням експресії основного білка мієліну.
Висновки
Загалом, наші висновки демонструють, що хронічне годування HFD спричиняє порушення гіпоталамічного мієліну, супроводжуючись регуляцією IL-33 та тривалою активацією мікроглії в гіпоталамусі. Враховуючи, що додавання екзогенного IL-33 було шкідливим для дозрівання OLG, збільшення IL-33 при хронічному годуванні HFD може сприяти індукції порушення гієталамічного мієліну.
Передумови
Ожиріння, спричинене надмірним споживанням їжі та недостатніми витратами енергії, стало основним критичним фактором розвитку серцево-судинних захворювань та метаболічного синдрому. Індуковане ожирінням пошкодження нейронів центральної нервової системи (ЦНС) та цілісності гематоенцефалічного бар'єру (ВГБ) збільшує ризик індукції інсульту та хвороби Альцгеймера [1, 2]. З огляду на те, що гіпоталамус відповідає за регулювання споживання їжі та витрат енергії завдяки дії лептину та інсуліну [3], підтримка в гомеостазі функцій нейронів та глій гіпоталамуса є важливою для запобігання розвитку захворювань, пов’язаних із ожирінням.
Запалення низького ступеня у периферичних тканинах осіб, що страждають ожирінням, добре розглядалося [4,5,6,7]. Запалення гіпоталамуса також виникає у генетично модифікованих тваринних моделей ожиріння або тварин з високим вмістом жиру (HFD) [5, 8,9,10]. Повідомлялося, що збільшення прозапальних цитокінів та хемокінів (тобто IL-1β, TNF-α та IL-6) спостерігалось у гіпоталамусі у гострий (години) та підгострий (тижні) періоди після годування HFD [11, 12]. Відомо, що активація мікроглії та астроцитів, яку називають гліозом, відіграє вирішальну роль у регуляції індукованої HFD резистентності до лептину та інсуліну в компанії з порушенням енергетичного гомеостазу [11,12,13,14]. Втрата олігодендроцитів (OLG), гліальної популяції мієліну в центральній нервовій системі (ЦНС), була виявлена в спинному мозку через 7 тижнів після годування HFD [15]. Тим не менше, мало відомо про реакцію гіпоталамусових OLG на хронічне годування HFD.
Метою цього дослідження було вивчення реакції гіпоталамусових OLG на хронічне годування HFD, використовуючи встановлену нами тварину модель метаболічних розладів, годуючи HFD для індукції резистентності до інсуліну та порушення обміну ліпідів [16]. Дослідження вперше показало порушення мікроструктури мієліну в задній бічній ділянці гіпоталамуса в пізніші моменти годування HFD. В якості альтернативи інтерлейкін-33 (IL-33) діє як клітинний сигнал тривоги [17], і повідомляється, що IL-33 є критичним фактором для розвитку РС через інгібування мієлінізації ЦНС [18]. Цікаво, що ми виявили, що IL-33 був підвищений в OLG та астроцитах гіпоталамусу після хронічного годування HFD. У поєднанні з нашим дослідженням in vitro, що вплив зрілих OLG на IL-33 спричинило пошкодження морфології OLG, результати свідчать про те, що порушення мікроструктури мієліну в гіпоталамусі після годування HFD може бути спричинене частково дією молекул IL-33, збільшеною на хронічне годування HFD.
Результати
Хронічна зміна мікроструктури гієталамічного мієліну, спричинене годуванням HFD
Проте порушена мієлінова оболонка постійно виявлялася в гіпоталамусі через 6 місяців після годування (рис. 1д, стрілки). Оскільки цілісність структури мієліну в гіпоталамічній області менше постраждала від годування HFD через 3 місяці (додатковий файл 1: Рис. S2), ми були наступними, щоб вивчити, чи скасування HFD в цей момент часу може запобігти порушенню структури мієліну в гіпоталамусі . Таким чином, ми провели експерименти, на яких мишей у групі, яка виводила HFD, годували HFD протягом перших 3 місяців, а потім Chow ще 3 місяці (рис. 1г). Вага їх тіла значно зменшилася після того, як їх дієту змінили на чау (додатковий файл 1: рис. S3A). Більше того, їх споживання води та споживання їжі повернулись до рівня групи Чау набагато пізніше (Додатковий файл 1: Рис. S3B та C). Крім того, структура мієліну в гіпоталамусовій тканині, отриманій із групи, що виводить HFD, була такою ж компактною, як і в групі Чоу (рис. 1д). Ці результати показують, що хронічне годування HFD може пошкодити мікроструктуру мієліну гіпоталамусу, і це порушення можна запобігти, змінивши HFD на звичайний раціон у попередній момент часу.
Активація мікроглії в ARC гіпоталамусу шляхом хронічного живлення HFD
Посилення IL-33 в гіпоталамусі шляхом хронічного живлення HFD
IL-33, один із членів надсімейства гена IL-1, який виконує подвійні функції при багатьох запалених захворюваннях, таких як серцево-судинні захворювання, алергія, розсіяний склероз (РС), інсульт та хвороба Альцгеймера [20, 21]. Білки IL-33 в основному виявляли в ядрах клітин гіпоталамусових GFAP + -астроцитів (рис. 3a, стрілки) та Olig2 + -OLG (рис. 3a, стрілки), але не Iba1 + -мікроглії. Далі ми виявили, що годування HFD протягом 3 та 4 місяців призвело до підвищення регуляції білків IL-33 у гіпоталамусі (рис. 3b). Паралельно результати імунофлюоресценції показали, що IL-33 + -експресуючі клітини, збільшені в гіпоталамусі, були Olig2 + -OLG через 4 місяці після годування HFD (рис. 3d, стрілки), а також GFAP + -астроцити (рис. 3c, стрілки). Ми також помітили, що астроцити гіпоталамуса виявляли гіпертрофічну форму у відповідь на хронічне живлення HFD (рис. 3в, наконечники стріл). Враховуючи той факт, що OLG та астроцити вивільняють IL-33 як сигнал тривоги у відповідь на пошкодження ЦНС [22, 23], наші результати свідчать про те, що хронічне харчування HFD викликає підвищену експресію гіпоталамусу IL-33 в OLG та астроцитах, що може бути критичний фактор для опосередкування реактивності мікроглії в гіпоталамусі.
Вплив IL-33 призводить до порушення олігодендроцитарних процесів
Як повідомляється, IL-33 інгібує мієлінізацію ЦНС та регулює розвиток РС [18]. Відповідно, наші висновки in vivo підняли ймовірність того, що рівень IL-33 в гіпоталамусі після хронічного годування HFD може опосередковувати порушення цілісності гієталамічного мієліну під час хронічного годування HFD. Таким чином, експерименти in vitro з використанням зрілих OLG, отриманих з первинних OPC мишей, проводились для вивчення того, чи IL-33 викликав морфологічні зміни зрілих OLG. Як і очікувалось, результати показали, що вплив IL-33 протягом 24 год зменшив складність взаємопов’язаної фігури OLG (рис. 4а, стрілки). Крім того, IL-33 суттєво зменшив кількість MBP + -OLG у культурах та зменшив розмір клітин MBP + -OLG (рис. 4а). Більше того, рівень білка MBP був знижений у культурі після обробки IL-33 (рис. 4b). Подібним чином, вплив зрілих OLG щурів на IL-33 спричинив значні зміни у взаємозв'язку MBP + -OLG (додатковий файл 1: рис. S5). Отримані дані показують, що IL-33 є руйнівною молекулою для морфологічної організації зрілих OLG.
Обговорення
Наші дані показують, що цілісність мікроструктури мієліну в гіпоталамічній області була пошкоджена після хронічного годування HFD, вказуючи на те, що пошкодження мієліну відбувається в більш пізній момент часу після годування HFD, ніж спостерігалася активація мікроглії. Більше того, збільшення IL-33, яке в основному виражається в астроцитах та OLG, було індуковано в гіпоталамусі через 3 та 4 місяці після годування HFD. Додавання IL-33 до зрілих OLG у культурі послаблювало розмір клітин OLG та експресію MBP.
Висновки
Підводячи підсумок, це перше дослідження, яке продемонструвало, що порушення гієталамічного мієліну та підвищення регуляції гліо-похідного IL-33 були пов’язані з ожирінням, спричиненим HFD. Наше майбутнє дослідження полягає в аналізі ролі IL-33 у гіпоталамічному нейропатогенезі, пов’язаному з хронічним годуванням HFD.
Методи
Тварини
Усі експерименти на тваринах проводились відповідно до рекомендацій ARRIVE (Animal Research: Reporting In Vivo Experiments). Догляд та використання тварин було затверджено Національним комітетом з догляду та використання тварин університету Ченг Кунга, Тайнань, Тайвань (номер затвердження IACUC: 106060). Вісім тижнів самців мишей C57BL/6 (19,91 ± 0,29 г) були отримані з Національного лабораторного тваринного центру університету Ченг Кунга (http://www.ncku.edu.tw/animal/eng/nckulac.html) і поміщені в окремі клітини (пара в клітці) із вільним доступом або до звичайного раціону (лабораторна дієта для гризунів # 5001; LabDiet, Сент-Луїс, Міссурі, США) або HFD (дієта для очищення гризунів # 58Y1; TestDiet, Сент-Луїс, Міссурі, США). Мишей годували звичайною дієтою або HFD (Додатковий файл 1: Таблиця S1) протягом певних періодів часу (3, 4 та 6 місяців). HFD містить 61,6% ккал з жирів, 18,1% з білків і 20,3% з вуглеводів. Тварин розміщували (2 тварини в клітці) у стандартних кімнатних умовах (кімнатна температура: 23 ± 2 ° C; вологість: 58 ± 2%; 12-годинний цикл світло/темрява) з вільним доступом до їжі та води за умови необхідності. Тварин забивали в різні моменти часу (додатковий файл 1: Таблиця S1), шляхом внутрішньочеревної (внутрішньовенної) ін’єкції Zoletil 50 (Virbac Taiwan Co., Ltd; 5-кратне розведення у фізіологічному розчині, 0,05–0,06 мл/10 г).
Підготовка первинних клітин-попередників олігодендроцитів (OPC)
Вестерн-блот-аналіз
Клітини лізували в буфері для лізису (1% тритонХ-100, 0,05% Твін-20 у PBS), що містить коктейль інгібітора протеази (Thermo Scientific, Cat # 78443). Тканини гіпоталамуса видаляли у тварин і лізували за допомогою реагенту для екстракції білка тканини T-PER (Thermo Scientific, Cat # 78510), що містить коктейль-інгібітор протеази. 100 мкг загальних білків завантажували на 10 або 15% SDS-PAGE і переносили на нітроцелюлозну мембрану. Нітроцелюлозні мембрани імуноблотували протягом ночі при 4 ° C первинними антитілами (табл. 1). Потім мембрану інкубували із вторинними антитілами, кон'югованими з пероксидазою, протягом 60 хв при кімнатній температурі. Імунореактивні білки виявляли за допомогою регенту ECL та візуалізували за допомогою плівок Super RX-NC (Фудзі, Японія). Підсилений хемілюмінесцентний субстрат Western Lightning ® Plus-ECL був від PerkinElmer Life Sciences (Бостон, Массачусетс, США).
Імунофлюоресценція
Тканини головного мозку фіксували 4% PFA протягом ночі, а потім кріозахищали 30% (мас./Об.) Сахарози в PBS. Тканини вбудовували в суміш оптимальної температури різання Tissue Tek (Electron Microscopy Sciences, Торранс, Каліфорнія, США), розрізану товщиною 20 мкм. Вільно плаваючі коронкові відділи мозку обробляли 1% TritonX-100 у PBS при 4 ° C протягом ночі та інкубували з первинними антитілами до PBS, що містять 0,1% TritonX-100 та 1% кінської сироватки при 4 ° C протягом ночі. Потім тканини інкубували з відповідними біотинільованими вторинними антитілами протягом 1 год з подальшим Alexa488/Cy3-avidin (1: 200) протягом 45 хв. Для подвійної імунофлюоресценції після інкубації з другим первинним антитілом протягом 1 год додавали вторинні антитіла Alexa488/Alexa594 (1: 200). В якості альтернативи клітини фіксували 4% PFA протягом 10 хв і інкубували в PBS, що містив 0,1% Triton-X100, протягом 30 хв. Культури інкубували протягом ночі при 4 ° C з первинними антитілами. Потім імунозабруднені тканини та OLG піддавали ядерному фарбуванню DAPI. Фарбування спостерігали під конфокальним лазерним скануючим мікроскопом Olympus FLUOVIEW FV1000 (Olympus, Японія) лазерами 405, 488 або 594 нм. Антитіла та біотинільовані вторинні антитіла, використані в дослідженні, були перелічені в таблиці 1.
Зображення ПЕМ
Мишей перфузували 0,9% фізіологічним розчином і фіксуючим розчином, що містить 2% глутаральдегіду і 2% PFA в 0,1 М фосфатному буфері. Шматочки тканини гіпоталамуса розміром 1 мм 3, приготовлені з допоміжної області до області ARC гіпоталамуса (додатковий файл 1: Рис. S1), були розділені на товщину 100 нм для системи візуалізації електронної мікроскопії Hitachi HT-7650 (Токіо, Японія) експлуатується основним закладом Національних науково-дослідних інститутів охорони здоров’я (NHRI, Тайвань).
Кількісне визначення кількості мікроглії та тіла клітини
На додаток до морфологічних спостережень мікроглії Iba1 + або CD11b + у гіпоталамусі, активацію мікроглії оцінювали шляхом вимірювання кількості мікроглії та розміру тіла клітини за допомогою програмного забезпечення для аналізу NIH ImageJ. П’ять випадково відібраних зображень на кожну ділянку мозку були об’єднані, зроблені за кілька кроків товщиною 1 мкм за допомогою конфокального лазерного скануючого мікроскопа Olympus FLUOVIEW FV1000. П'ять відділів головного мозку, що містять ділянки ARC гіпоталамусу, були зібрані у двох тварин у кожній групі в кожен момент часу. Кількість Iba1 + мікроглії та середній розмір тіла клітини Iba1 + мікроглії в областях ARC гіпоталамуса (Додатковий файл 1: Рис. S1) були кількісно визначені.
Оцінка морфологічних змін олігодендроцитарних
З кожної культури було зафіксовано п’ять випадково відібраних зображень за допомогою епіфлуоресцентного мікроскопа з об’єктивом 40X. Крім того, кількісно визначали MBP + -OLG у культурах (загалом 1000 клітин на обробку), а також вимірювали розмір клітин MBP + -OLG у культурі (загалом 100 клітин за обробку) за допомогою програмного забезпечення для аналізу NIH ImageJ (RRID: SCR_003070). Результати представлені як відсоток даних, отриманих у культурі, обробленій цитокінами, над культурою носія.
Кількісна ланцюгова реакція полімерази в режимі реального часу (QPCR)
Статистичний аналіз
Наявність значущих відмінностей між двома групами (Chow та HFD) в один момент часу, що спостерігався у цьому дослідженні, визначали за допомогою двосторонніх т тест. Кожне значення є середнім значенням ± SEM від п’яти тварин на групу (експресія MBP та PLP), трьох тварин за кожну точку часу на групу тварин (експресія IL-33), п’яти відділів мозку, що містять області ARC гіпоталамусу (імунофлюоресценція Iba1 та CD11b), і три повторні експерименти з використанням культур OLG, приготованих трьома препаратами (дослідження in vitro). Статистична значимість була встановлена як *стор
Наявність даних та матеріалів
Набори даних цього дослідження доступні у відповідного автора за запитом.
- Хронічна дієта з високим вмістом жиру викликає у мишей гіпертрофію серця та фіброз
- Доктор Бернштейн; Дієта з високим вмістом білка і жирів, вуглеводів ні на кого не брала. Щоденні форуми
- Дієтна схема для пацієнтів з високим кров'яним тиском, Дієтна схема з високим кров'яним тиском Лібрат
- Вибір дієти та фактори способу життя, пов’язані з чоловіками з хронічними тазовими болями - інтерстиціальні
- Дієта Дюкана - план дієти з високим вмістом білка, який допоможе вам схуднути і не тримати його на все життя Вільямсом,