Гестаційне програмування: наслідки посухи та голоду на виживання населення під час вагітності
Анотація
Програмування - це процес, при якому стимул або стрес у критичний або чутливий період розвитку має тривале або все життя значення. Недавні дослідження на людях і тваринах дали переконливі докази того, що внутрішньоутробне середовище може впливати на процеси розвитку плода і може змінювати гомеостатичні регуляторні механізми серед нащадків. Одним із принципів гестаційного програмування є спостереження, що фізіологічні ефекти внутрішньоутробної перестановки можуть змінюватися залежно від періоду розвитку плода чи новонародженого та від виду. Програмування може призвести до зміни кількості клітин, структури органів, гормональних значень та експресії генів, серед іншого. Ефекти можуть бути постійними або виражатися лише у віці окремих дітей (наприклад, новонароджених, дорослих) і можуть залежати від внутрішньоутробного середовища (наприклад, харчування, глюкокортикоїди). Крім того, вираження фізіологічних відхилень може бути присутнім під час базальних умов або обмежуватися стресовим станом навколишнього середовища або захворюваннями у нащадків.
Загальновизнано, що генетичні мутації всередині популяцій видів можуть забезпечити перевагу виживання як для сприяння приросту популяції в статичних умовах навколишнього середовища, так і для забезпечення виживання при тривалій зміні довкілля. Генетичні мутації, як правило, вимагають тривалих еволюційних періодів часу, щоб впливати на популяцію видів. Крім того, мутації навряд чи будуть оборотними або швидко адаптованими до змін умов навколишнього середовища. І навпаки, перинатальне програмування може забезпечити вигоду для виживання видів, полегшуючи різні фенотипи потомства, які пристосовуються до змін стану навколишнього середовища, що може часто зникати або змінюватись.
Протягом еволюції та розвитку люди та тварини зазнавали екологічних стресів, а посуха та голод представляли дві найбільш часті умови. Якщо посуха або голод трапляються протягом гестаційного періоду, програмування розвитку конкретних фенотипів потомства може бути корисним для адаптації потомства до виживання в цьому середовищі. Наприклад, харчові обмеження протягом внутрішньоутробного життя, які можуть призвести до затримки внутрішньоутробного розвитку (IUGR) та низької ваги при народженні, були пов’язані з розвитком нащадків “ощадливого фенотипу” (3, 4). Ці нащадки краще здатні набувати та використовувати поживні речовини - фенотип, який служить перевагою виживання в умовах відносного голоду.
У той час як гестаційне програмування, можливо, склалося з метою вигоди для виживання видів, етіологія певних фенотипів потомства різко змінилася за останні ери. Наприклад, у сучасному суспільстві потомство IUGR зазвичай виникає внаслідок інших факторів, крім обмеження харчування, включаючи захворювання, які, можливо, не дозволяли плодючості матері до лікування 20-го століття (наприклад, аутоімунне захворювання) або є унікальними для сучасної епохи [наприклад, плацентарний недостатність, пов’язана з попереднім кесаревим розтином (68); або багатоплідні гестації вищого порядку, пов’язані із заплідненням in vitro]. Оскільки етіологія змінилася, а умови навколишнього середовища предків уже не існують, механізми програмування можуть дати потомство з неадаптивними фенотипами в сучасному суспільстві. Наприклад, потомство з обмеженим ростом ("ощадливий фенотип"), яке зазнає західних дієт з високим вмістом жиру, демонструє підвищений ризик ожиріння, гіпертонії та діабету у дорослих (3).
В даний час у Сполучених Штатах Америки та західних суспільствах спостерігаються серйозні епідемії ожиріння, гіпертонії та діабету. У США приблизно 65% дорослих мають надлишкову вагу, а 31% страждають ожирінням. Дитяче ожиріння є серйозною кризою в галузі охорони здоров'я, оскільки 20% дітей класифікуються як ожиріння. Разом із показниками ожиріння частота гіпертонії зростає. Серед дорослих людей у Сполучених Штатах майже 30% населення страждають на гіпертонічну хворобу. Подібним чином, діабет ІІ типу різко зріс у західному суспільстві. Всесвітня організація охорони здоров’я прогнозує зростання поширеності діабету II типу з 1995 по 2025 рік на 170% (84–228 мільйонів) у індустріальному світі.
Зростає інтерес до асоціації розвитку «метаболічного синдрому» з наслідками гестаційного програмування. Парадоксально підвищений ризик ожиріння дорослих, гіпертонії та діабету серед новонароджених малого для гестаційного віку був переконливо продемонстрований в епідеміологічних дослідженнях на людях та дослідженнях на тваринах серед видів, включаючи щурів, овець та інших. Як обговорювалося вище, екологічні стреси, які загрожують виживанню населення, включають голод, який створює поживний стрес, та посуху, яка створює осмотичний стрес. Примітно, що спричинене посухою депривація води та супутня гіперплана гіперметрії плазми пов’язані з дегідратацією-анорексією і, отже, супутнім потенційним поживним стресом. Під час досліджень, проведених у нашій лабораторії, ми висунули гіпотезу про те, що як поживний, так і осмотичний стрес незалежно сприяють новонародженим малого для гестаційного віку та програмуванню фенотипів нащадків, які можуть продемонструвати пристосованість до наступних умов голоду чи посухи. Однак під впливом західних дієт ці фенотипи можуть сприяти програмуванню ожиріння та/або гіпертонії у нащадків.
Щоб гестаційні стреси програмували реакцію нащадків, уражені фізіологічні системи повинні бути піддані впливу протягом періоду функціонального розвитку. Наша лабораторія та інші підтвердили, що як осморегуляційна, так і орексигенна системи стають функціональними, хоча і не повністю зрілими, протягом останньої половини вагітності та/або періоду новонародженості.
Хоча осмоляльність плазми плода підтримується паралельно рівням матері (за допомогою рівноваги плаценти), функціональні механізми осморегуляції розвиваються внутрішньоутробно у овець та людей, і, можливо, як у період внутрішньоутробного розвитку, так і у новонароджених у високих видів (наприклад, щурів) (76). Вірт та Епштейн (76) постулювали, що реакції спраги розвиваються протягом неонатального періоду у порівняно високих видів щурів. Однак нещодавно ми продемонстрували центральну осмотичну реакцію у короткотермінових плодових щурів (80). У більш докоциального плода овець системний та центральний осмотико-дипсогенні механізми функціонують на короткий термін, оскільки ковтальна активність та секреція аргінінового вазопресину (AVP) викликаються у відповідь на передбачувані дипсогени (61, 64). На розвиток осморегуляції також свідчить метаболічна активність у вибраних областях мозку новонароджених, включаючи супраоптичну та паравентрикулярну (PVN) частини передньовентрального третього шлуночка (33). Незважаючи на те, що осмотико-дипсогенні реакції плода є незмінними на найближчий термін, рівень осмотичної чутливості свідчить про функціональну незрілість, оскільки для стимулювання прийому всередину плоду потрібно значно більше збільшення осмоляльності плазми порівняно з дорослим (13, 79).
Наша лабораторія провела дослідження серед вагітних тварин, в яких ми імітуємо умови посухи через зневоднення матері та умови голоду за допомогою відносного обмеження поживних речовин. Ми вивчали реакції нащадків як у щурів, високорослих видів, так і у овець, докосових видів, що мають тенденції розвитку, більш схожі на людські.
Імітаційна посуха: зневоднення матері.
Для вивчення ефекту обмеження води у вагітних щурів матерям-матерям обмежили воду, щоб збільшити вміст натрію в плазмі на ~ 6 мекв/л з 10 днів вагітності до терміну (18). Обмеження води зберігалося протягом усього періоду лактації до відлучення новонародженого у віці 21 дня. Новонароджених відлучували від їжі та води за умови необхідності та вивчали як у віці 1 день, так і у 12 тижнів. Споживання їжі матерями помітно зменшилось (на 40%) як під час вагітності, так і під час лактації у відповідь на обмеження води у матері. Подібним чином збільшення маси тіла матері зменшувалося більшою мірою під час вагітності (64%), ніж лактація (24%), що відповідає ефектам дегідратаційної анорексії. Як і слід було очікувати, натрієва плазма у матері значно зросла протягом обох періодів вагітності та годування груддю порівняно з контрольними дамами, так що відносне зниження натрію та осмоляльності плазми крові, що спостерігалося під час вагітності щурів, було запобігано на дамах з обмеженою водою. Як і передбачалося, потомство щурів з обмеженими водою дамбами важило на 17% менше при народженні. Крім того, 1-денне потомство мало підвищену осмоляльність натрію та гематокрит у плазмі крові, частково в результаті доставки з внутрішньоутробної гіпернатріємії (18).
Як дорослі у віці 12 тижнів, ці нащадки продовжували демонструвати суттєво зниження маси тіла, причому чоловіки демонстрували 11%, а жінки - 19% зниження порівняно з контролем. Що ще важливіше, незважаючи на 9 тижнів їжі та води ad libitum, чоловіче потомство продемонструвало стійкі та значно підвищені рівні натрію в плазмі, осмоляльність та гематокрит. На відміну від цього, у жіночих нащадків рівень натрію та осмоляльність у плазмі крові був подібним, хоча постійно підвищений гематокрит (15).
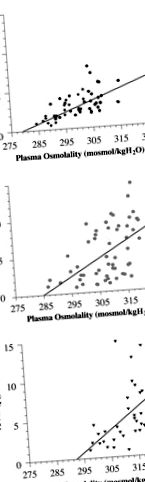
Рис.2.Лінійна регресійна залежність між плазмовою осмоляльністю (POsm) та плазмовим рівнем AVP (PAVP) у контролі одиночного (A), контроль близнюків (B), і зневоднений одиночний (C.) новонароджені. Рівняння лінійної регресії були розраховані для всіх наборів даних 3 груп і вирішені для порогового значення з використанням нульового перехоплення. Поріг секреції AVP: зневоднений одиночний [PAVP = 0,27 (POsm - 290); р = 0,79; P
Таким чином, виявляється, що гестаційна гіпертонічність як у щурів, так і у овець призводить до потомства з підвищеним вмістом натрію в плазмі та осмоляльності та гематокриту. Дослідження нащадків щурів також вказують на збереження цих гендерно-специфічних змін у дорослому віці, тоді як дослідження на вівцях демонструють, що зневоднені одиночні ягнята, що знежилилися, також свідчать про підвищення артеріального артеріального тиску. Крім того, у цих ягнят спостерігається змінений поріг осмоляльності для секреції АВФ. У сукупності дослідження обох видів ілюструють, що осморегуляційні гомеостатичні механізми можуть бути запрограмовані ще внутрішньоутробно.
Модельований голод: обмеження поживних речовин для матері.
Внутрішньоутробне середовище вже давно визнано таким, що сприяє поведінці нащадків, хоча лише наприкінці 1980-х Баркер та ін. (4) розширив концепцію внутрішньоутробного програмування до асоціації низької ваги при народженні з ризиками серцево-судинних захворювань дорослих, цукрового діабету та дисліпідемії (57). Кров'яний тиск у дорослих людей підвищений серед плодів із затримкою росту (46). Дослідження на щурах, овечках, поросятах та бабуїнах у різні періоди гестації, ступеня та типи дефіциту поживних речовин (17, 40, 67, 73, 77) підтвердили зв'язок, хоча іноді і суперечливий, між IUGR та гіпертонією дорослих або метаболічне захворювання. Подібним чином підвищений артеріальний тиск було продемонстровано у дорослих нащадків щурів після гестаційного обмеження білка (42, 51, 53, 67). Незважаючи на те, що рідко вимірювали осмоляльність плазми або натрію, не було змін у вмісті натрію в плазмі матері у дам, що страждають від харчування (45).
Дослідження недоїдання овець демонструють різні фенотипи потомства в залежності від періоду вагітності. На початку гестації до середнього терміну недоїдання зазвичай збільшує ріст плаценти, тоді як недоїдання пізнього терміну зменшує ріст плода. У відповідь на 15% зменшення материнського харчування між гестацією днів 0 і 70, артеріальний тиск знижується у плодів, що перебувають на короткому терміні, але зростає у новонароджених нащадків (36, 39). Таким чином, механізми програмування, що виробляють постнатальну гіпертензію, можуть призвести до зниження артеріального тиску в житті плода за допомогою незрозумілих до цього часу механізмів. На відміну від цього, 15% обмеження їжі протягом останніх 30 днів вагітності підвищувало середній тиск плода (25). На відміну від досліджень раннього недоїдання вагітності, зниження поживних речовин у матері на 50% зі 115 днів до закінчення терміну підвищило тиск у плода. Крім того, плоди на 115-125 днів демонстрували підвищену реакцію пресора на ANG II, хоча це не було продемонстровано в термін. Порівняно з дослідженнями на щурах, було значно менше подальших досліджень потомства недоїджених овець.
Таблиця 1. Базальні показники сечі у контрольних одноплодних, контрольних близнюків та пренатально зневоднених одноосібних
Значення є середніми ± SE. ШКФ, швидкість клубочкової фільтрації. Істотна різниця, контроль одиночного та контрольного близнюків:
* P † P
Рис.3.Маса тіла та відсоток жиру в організмі 3-тижневого потомства (чоловіки та жінки разом; зверху) та у 9-місячних чоловічих (суцільні бруски) та жіночих (відкриті бруски) нащадків (знизу) від контрольних [пренатальних/постнатальних: дозвільне годування (AdLib)/AdLib], негайне зростання наздоганяючого (обмеження їжі (FR)/AdLib) та затримка зростання наздоганяючих груп (FR/FR). Значення є середніми ± SE. *P
Рис.4.Рівень лептину у плазмі крові у 3-тижневих нащадків (чоловіки та жінки разом; A) та через 9 міс (B) у чоловіків (суцільні бруски) та жіночих (відкриті бруски) нащадків від контрольної групи (AdLib/AdLib), негайного зростання наздоганянь (FR/AdLib) та відстроченого зростання наздоганянь (FR/FR). Значення є середніми ± SE. *P
Щоб запобігти стрімкому зростанню серед щурячих щенят з низькою вагою, новонароджених вигодовували дами, яким протягом 21 дня лактації забезпечували дієту з обмеженим харчуванням на 50%. Ці нащадки демонстрували подальше уповільнення росту під час лактації, важивши значно менше (55%), ніж контролі, зі зниженим відсотком жиру в організмі, у віці 3 тижнів (14). Однак до 9 місячного віку ці нащадки досягли маси тіла та жиру в організмі, що еквівалентно контролю (рис. 3). Крім того, рівні лептину в плазмі були еквівалентні контролю через 3 тижні та 9 місяців (рис. 4).
Ці результати підтверджують, що обмеження поживних речовин під час вагітності може призвести до зменшення ваги при народженні. Швидке зростання наздоганяння, яке забезпечується нормальним харчуванням та лактацією, призводить до зростання наздоганянь поза контролем на 9 місяців у щурів, при цьому у нащадків спостерігається збільшення жиру в організмі та підвищення лептину в плазмі. Підвищення лептину в плазмі очевидно перед збільшенням відсотка жиру в організмі і, отже, передбачає програмування розвитку стійкості до лептину. Затримка зростання наздоганяння, спричиненого обмеженням їжі під час лактації, призводить до зростання наздогнання до значень, подібних до контрольних, але з нормальним вмістом жиру та лептину в плазмі. Ці результати дозволяють припустити, що програмування ожиріння у нащадків може залежати від часу зменшення поживних речовин та/або наявності поживних речовин. Можна припустити, що запобігання негайному швидкому зростанню новонароджених може знизити ризик ожиріння у людей у дорослих.
Серед додаткових систем активація симпатичної нервової системи (СНС) може мати вирішальне значення для запрограмованої гіпертензії, пов’язаної з хронічною гіпертонічністю, подібним чином до гіпертонії, пов’язаної зі збільшенням споживання натрію (8). У стані спокою симпатичні нерви проявляють тонічну активність, що сприяє підтримці артеріального артеріального тиску. І гіпертонус, і ANG II діють як симпатозбудливі фактори через осмо- або ANG II AT1-рецептори в OVLT та/або SFO. Нейронні шляхи від серединного преоптичного ядра та PVN до рострального вентролатерального мозку та хребетного інтермедіолатерального клітинного стовпа і, нарешті, симпатичні прегангліонарні нейрони (2, 52, 72) збільшують активність SNS. Вагомі дані свідчать про те, що абсолютний рівень симпатичного тонусу змінюється в умовах підвищеного споживання солі або гіпертонусу плазми (8). У нормальних людей підвищене споживання солі знижує рівень плазмового ANG II, хоча артеріальний артеріальний тиск підтримується за рахунок рівноваги зниженої активності SNS, опосередкованої ANG II, та підвищеної активності осмо- або натрієвих рецепторів. Однак у чутливих до солі особин або тварин домінуючі гіпертонусом симпато-збудливі дії досягають, можливо, через зниження рівня або дії ANG II.
Рис.5.Обмеження материнської води чи поживних речовин під час вагітності та/або лактації та її вплив на потомство. Цифра підсумовує наші результати досліджень як на моделях овець, так і на щурах. АТ, артеріальний тиск; Осм, осмоляльність; Dif, різниця; Молотьба, поріг.
Таким чином, гестаційне програмування, здається, сприяло адаптації видів та виживанню популяції. Ці реакції та процеси розвитку все ще функціонують у людей і, ймовірно, сприяли поточній епідемії гіпертонії, ожиріння та діабету. Потрібні узгоджені наукові зусилля, щоб зрозуміти механізми та регулювання гестаційного програмування. Існує потенціал для модифікації стану вагітності та/або новонародженого, щоб оптимізувати переваги та уникнути шкідливих наслідків гестаційного програмування.
Цю роботу підтримали гранти від Маршу Даймс (MG Ross), Американської асоціації серця (MG Ross) та Національних інститутів охорони здоров’я [5-R01-DK-4331112 (MG Ross), 1-R03-HD-3967102 ( MG Ross), 5-R01-HL-4089912 (MG Ross), 1-R03-HD-044482 (MG Ross) і K01-DK-06399401 (M. Desai)].
- Гестаційний діабет Американська асоціація вагітності
- Ранні наслідки дієти з високим вмістом жиру на нервово-судинну функцію та вогнищеву ішемічну травму мозку американець
- Плач під час вагітності; Це; s Вплив на дитину
- Цефтріаксон - побічні ефекти, застосування, дозування, передозування, вагітність, алкоголь RxWiki
- Вживання листя бетеля (Паан) під час переваг вагітності; Шкідливі ефекти