Дієта з високим вмістом жиру у матері погіршує фолікулярний розвиток нащадків через внутрішньояєчну систему кісспептину/GPR54
Анотація
Передумови
Надмірна гестаційна надбавка у вазі (GWG), яка пов’язана з несприятливими довгостроковими наслідками для здоров’я потомства, стала основною клінічною проблемою. Накопичувальні дані вказують на те, що система кісспептину/GPR54 яєчників безпосередньо бере участь у ряді фізіологічних заходів. Ми використовували модель дієти з високим вмістом жиру (HFD) під час гестації, щоб дослідити функцію яєчників нащадків та чи задіяна система кісспептину/GPR54.
Методи
Після введення самця та підтвердження спаровування шляхом перевірки вагінального сперматозоїда, самки щурів були рандомізовані на дві групи: контрольна дієта під назвою NCD-група та дієта з високим вмістом жиру під назвою HFD-група. Після народження всіх щурів змінили на контрольний раціон, і розмір посліду було відрегульовано до 12 цуценят на послід. Яєчники збирали для оцінки в післяпологовий день (PND) 4 та PND 30. Записували час розкриття піхви, і циклічність естрозу контролювали негайно протягом 2 тижнів поспіль. Первинні гранульозні клітини та яєчники, взяті з PND 4, були зібрані для визначення прямого ефекту кісспептину-10 (kp-10) in vitro.
Результати
У новонароджених щурів, підданих дії HFD під час гестації, була менша кількість вторинних фолікулів в яєчнику. Експресія фолікулостимулюючого гормонального рецептора (FSHR) та кісспептину не змінювалася. У препубертатному віці кількість антральних фолікулів та преовуляторних фолікулів була підвищеною із зменшенням фолікулів III типу у групі HFD. Хоча експресія генів, пов'язаних з овуляцією, була знижена, рівні експресії генів, пов'язаних з ростом фолікулів, і генів, пов'язаних із синтезом стероїдогенезу, були підвищені. Значне збільшення в поцілунок1 мРНК та білок кісспептину виявлено без змін у поцілунок1р мРНК та GPR54. Дієта з високим вмістом жиру у матері під час гестації призвела до значного настання статевого дозрівання та нерегулярного естрального циклу у щурів-потомків. Крім того, введення kp-10 призвело до збільшення життєздатності первинних гранульозних клітин та збільшення розміру ооцитів.
Висновки
Вплив HFD під час виношування матері мав тривалий вплив на репродуктивну функцію у потомства, і може бути задіяна підвищена система яєчників кіспептину/GPR54.
Вступ
Раннє середовище життя, включаючи стан харчування, відіграє важливу роль у формуванні багатьох аспектів фізіології та патології у розвитку організму, і ці зміни зберігаються протягом усього життя [1]. ГРГ, яка відрізняється від ожиріння матері (ожиріння до вагітності), стала основною клінічною проблемою, оскільки багато вагітних дотримуються точки зору на те, що плід потребує більше харчування та споживає велику кількість продуктів з високим вмістом жиру. Очевидно, що ГРГ буде спричиняти внутрішньоутробне «обезогенне» середовище під час вагітності та пов'язане з несприятливим довгостроковим впливом на здоров'я потомства через процес, відомий як програмування розвитку [2]. Крім того, попередні дослідження показали, що ожиріння матері, спричинене дієтою, або HFD після відлучення від грудей можуть спричинити раннє настання статевого дозрівання та порушення еструсного циклу у жіночих нащадків [3,4,5]. Однак доступні обмежені дослідження щодо програмування хвороби нащадків під впливом HFD лише під час вагітності матері, особливо щодо функції яєчників та пов'язаних з ними механізмів.
Протягом останніх кількох десятиліть нові дослідження виявили, що кісспептин (поцілунок1), що експресується в антеровентральному перивентрикулярному ядрі та дугоподібних ядрах нейронів, виступає ключовим регулятором гіпоталамо-гіпофізарно-яєчникової осі у гризунів та людини. Кісспептин відіграє незамінну роль у розмноженні, включаючи диференціацію статі мозку, початок статевого дозрівання, секрецію гонадотропіну, овуляцію та метаболічну регуляцію фертильності [6,7,8,9]. Однак кілька досліджень продемонстрували, що кисспептин та передбачуваний G-білковий рецептор GPR54 (поцілунок1р) виражаються в різних типах тканин, включаючи систему розмноження, яка здійснює свої дії прямими або непрямими способами [9]. Що стосується яєчників, кисспептин/GPR54 безпосередньо бере участь у ряді фізіологічних заходів (розвиток фолікулів, дозрівання яйцеклітин, овуляція та стероїдогенез) та патологічний статус (передчасна недостатність яєчників, синдром полікістозних яєчників та ендометріоз) [10, 11].
При PND 4 у гризунів ооцити повністю оточуються одним шаром сплощених клітин гранульози, утворюючи первинні фолікули. Кількість спочатку встановлених фолікулів називається фолікулярним пулом, що вказує на репродуктивний потенціал ссавців. PND30 - ще один критичний момент часу під час розвитку яєчників у щурів. У цей період піхва ще не розкрилася, і фолікули ростуть без овуляції [12, 13].
Необхідно дослідити вплив HFD під час гестації на програмування функції яєчників нащадків та те, чи задіяна система kisspeptin/GPR54. Щоб зрозуміти ризик хронічного надмірного харчування у внутрішньоутробному розвитку, ми обрали два важливі моменти часу новонародженого та передпубертатного періоду, щоб вивчити, чи може HFD матері, застосовуваний до щурів протягом усього періоду вагітності, змінювати функцію яєчників нащадків.
Матеріали та методи
Тварини та експериментальний дизайн
Морфометрія
Імуногістохімічний аналіз
Кількісна ПЛР в режимі реального часу
Оцінка початку статевого дозрівання та естральної циклічності
Починаючи з PND30, нащадків щодня перевіряли на вагінальне розкриття (ознака репродуктивної зрілості), а вагінальні мазки проводили щодня о 08:00 год, як тільки розкриття піхви відбувалося протягом 14 днів поспіль, щоб визначити еструсну циклічність. Стандарт регулярного естрального циклу був таким же, як і в попередньому дослідженні [17]. Коротше кажучи, регулярний естроальний цикл складається щонайменше з двох послідовних регулярних естральних циклів, і стадію естрозу визначали відповідно до відносної кількості ядерних клітин піхвового епітелію, клітин ороговілих епітеліальних клітин та лейкоцитів у вагінальних мазках під світловим мікроскопом.
Первинна культура клітин гранульозних яєчників
Незрілим (21–25-денним) самкам щурів Спрег-Доулі вводили в м’язи 40 МО сироватки гонадотропіну про ін’єкцію (PMSG) (solarbio, p9970). Через 48 год щурів знеболювали, а яєчники негайно видаляли і поміщали в стерильний PBS без кальцію та магнію. Після промивання PBS яєчники розрізали на невеликі шматочки, а потім розщеплювали 0,1% колагеназою при 37 ° С протягом 5 хв. Клітини гранульози у фолікулах були виділені та підтримувались у DMEM/F12 (Gibco), що містить антибіотики та 10% плодової бичачої сироватки (FBS) при 37 ° C та 5% CO2.
Імунофлуоресцентний аналіз
Коли культура клітин виросла до 90–95% злиття, предметні стекла в 6-лункових планшетах виймали, промиваючи PBS. Використовуючи 4% параформальдегіду для фіксації клітин та 0,5% Triton X-100 як проникнення клітин, предметні стекла блокували 5% BSA протягом 30 хв при 37 ° C. Після інкубації з первинним антитілом протягом ночі при 4 ° C зрізи поєднували зі специфічним флуоресцентним вторинним антитілом протягом 30 хв при 37 ° C. Нарешті, клітинні ядра фарбували DIPA і візуалізували за допомогою флуоресцентного мікроскопа.
Оцінка проліферації клітин за допомогою набору для підрахунку клітин-8 (CCK-8)
Первинні гранульозні клітини висівали (10 4 клітин на лунку) на 96-лункові планшети протягом 24 годин і обробляли різними дозами кісспептину-10 (kp-10, Phoenix Pharmaceuticals, Inc., Белмонт, Каліфорнія, США). Після інкубації протягом 24 годин ми замінили середовище та додали середовище, вільне від FBS, 100 мкл з ще 10 мкл CCK-8. Через чотири години зчитувач мікропланшетів спостерігав поглинання 450 нм.
Аналіз інкубації яєчників
Яєчники відбирали у щурів при PND4 та обробляли протягом 4 днів kp-10 (100 нМ) або інкубаційним середовищем in vitro. Всі яєчники інкубували протягом 24 годин при 37 ° С з 95% киснем та 5% СО2, як описано раніше [18, 19]. Використаним інкубаційним середовищем було DMEM/F12, 0,1% альбомакс (Gibco), 0,1% BSA, 0,05 мг/мл L-аскорбінової кислоти (сигма), 1% інсулін-трансферин-селен (сигма), доповнене 250 ОД/мл пеніцилін-стрептоміцин. Через 4 дні інкубації яєчники фіксували у 4% параформальдегіді для морфометричного аналізу фолікулів.
Статистика
Результати виражали як середні значення ± SEM, а аналізи проводили за допомогою програмного забезпечення PRISM версії 7.00 (GraphPad). Для порівняння між двома групами використовували двовибірковий t-тест або непараметричний тест. Вплив HFD на регулярність еструозного циклу перевіряли за допомогою тесту Хі-квадрат. P значення
Результат
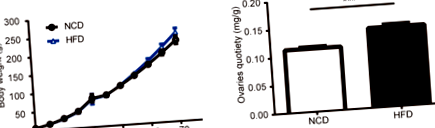
Вплив HFD під час гестації на масу тіла та масу яєчників
На рисунку 1а показані ваги групи HFD та групи NCD. Після пологів на розмір посліду істотно не впливав вплив материнської дієти. Коли щури виросли до PND70, маса тіла все ще не досягала статистичної значущості між щурами HFD та контрольними щурами. Починаючи з 56-денного віку, щури в групі HFD демонстрували тенденцію до вищої маси тіла, хоча між двома групами не було суттєвої різниці (0,05 рис. 1
Вплив HFD під час гестації у ранньому фолікулярному розвитку
Ранній фолікулярний розвиток оцінювали за допомогою морфометричного аналізу яєчників новонароджених при PND4. На малюнку 2 показані репрезентативні мікрофотографії яєчників від НИЗ (A) та HFD (B). Підрахувавши всі види фолікулів (рис. 2 г), ми виявили, що яєчники контрольної групи мали більшу частку вторинних фолікулів, ніж яєчники щурів HFD. А в групі HFD спостерігалося більш високе співвідношення первинних фолікулів, хоча воно не досягало статистичної значущості (стор = 0,1431). Однак первинний фолікул та аретичний фолікул не виявили диверсифікації між цими двома групами. Ми припустили, що зміна співвідношення первинних фолікулів та вторинного фолікула відбулося внаслідок змін кісспептину та FSHR. Кісспептин в основному експресувався в ооцитах (рис. 2 c-d), а FSHR знаходився в клітинах гранульози (рис. 2 e-f). Однак, за напівкількісною статистикою не було значної різниці в інтенсивності фарбування кісспептину та FSHR між групою HFD та групою NCD (рис. 2 год).
Вплив HFD під час гестації на фолікулярний розвиток у препубертатному віці у жіночих нащадків
Для аналізу фолікулярного розвитку на передпубертатному етапі ми вивчали яєчники контрольних та HFD щурів на PND30 методом морфометрії та пов'язували це з деякими рівнями експресії мРНК. Ми не підрахували кількість первинних фолікулів та первинних фолікулів, оскільки ці фолікули важко виявити, а не основну частину яєчника.
На рис. 3 a-b були показані загальні фотографії яєчників (40X), а на рис. 3 c-d (100X) відповідає збільшенню рис. 3 a-b, відповідно. Підрахувавши всі види фолікулів (рис. 3, і), ми виявили, що кількість фолікулів атрезії, як правило, зростало у щурів з HFD (стор = 0,0982), тоді як кількість вторинних фолікулів мала тенденцію до зменшення (стор = 0,1252). Крім того, у групі HFD у віці 30 днів спостерігалось збільшення кількості преовуляторних фолікулів та антральних фолікулів. Однак у групі HFD фолікули типу III були зменшені.
Існувало кілька відмінностей між групами НИЗ та HFD у експресії мРНК яєчників. По-перше, яєчник контрольних щурів мав вищий рівень експресії мРНК в генах, пов’язаних з овуляцією, ніж яєчник щурів HFD (рис. 3 л). По-друге, у щурів HFD спостерігалося збільшення генів фолікулярного росту, пов'язаних з ростом GDF9, AMH і BMP15, тоді як вираз FSHR не постраждав (рис. 3 к). Дієта HFD для матері також була основною причиною збільшення експресії генів, пов'язаних із синтезом стероїдогенезу, в яєчниках потомства (рис. 3 м).
Вплив HFD під час гестації на систему кісспептину/GPR54 яєчників у передполовому дозріванні у жіночих нащадків
Експресія генів яєчників поцілунок1 і поцілунок1р в препубертатному віці аналізували. Результати показали помітно підвищену експресію поцілунок1 мРНК у яєчниках щурів HFD порівняно з щурами NCD, в той час як істотної різниці в поцілунок1р Експресія мРНК між двома групами (рис. 3 н). Імуногістохімічне фарбування кисспептину та GPR54 проводили для виявлення експресії та розподілу білка в яєчниках. Ми виявили, що кісспептин сильно експресується в ооцитах та клітинах гранульози з меншим фарбуванням у клітинах тека (рис. 3 e-f). Аналіз середньої оптичної щільності показав, що рівні кисспептину регулювались вгору в групі HFD порівняно з контрольною групою (рис. 3 j). Крім того, розподіл GPR54 (рис. 3 г-год) був подібним до кислоспептину, тоді як не було значної різниці в інтенсивності фарбування між двома групами (рис. 3 j).
Вплив HFD під час гестації на вік розкриття піхви та естральну циклічність у жіночих нащадків
Піхвовий отвір є маркером настання статевого дозрівання. Щури, що зазнали впливу HFD під час виношування плоду, мали статеве дозрівання (рис. 4, d). За збігом обставин, HFD негативно вплинув на естральну циклічність. Малюнки 4 a-b були репрезентативним естрозним циклом для кожної групи. Приблизно 83,3% контрольних щурів досягли нормальної активності на циклі, яка тривала протягом 4–5 днів після розкриття піхви, порівняно з менш ніж 20% нащадків матерів, які зазнали HFD під час гестації (рис. 4 в).
Прямий вплив kp-10 на первинні клітини гранульози та яєчники новонароджених
Як показано на фіг. 5, первинні гранульозні клітини, виділені з незрілих самок щурів SD, були імунофарбовані FSHR, виробник експресувався лише в гранульозних клітинах. На малюнку 5 також показано, що в первинних культивованих клітинах є флуоресцентне фарбування кісспептину, що свідчить про експресію кісспептину в клітинах гранульозних щурів. Порівняно з контрольною групою, 100 нМ та 1000 нМ kp-10 мали подібний ефект і обидва суттєво підвищували життєздатність гранульозних клітин через 24 години лікування, тоді як 10 нМ kp-10 були неефективними (рис. 6, е).
Імунофлуоресцентний аналіз у клітинах гранульози яєчників. Імуногістохімічне фарбування FSHR та кісспептину в культивованих клітинах гранульози яєчників щурів (50x). Позитивні сигнали фарбування специфічним антитілом до FSHR та кісспептину. Негативний контроль інкубували з PBS. (n = 3)
Яєчники відбирали у щурів при PND4 та обробляли протягом 4 днів kp-10 (100 нМ) або інкубаційним середовищем in vitro. Як яєчники контрольної групи, так і яєчники, які отримували kp-10, виявляли велику кількість первинних фолікулів, а також містили деякі первинні та вторинні фолікули без антральних фолікулів. Переважна більшість первинних фолікулів і вторинних фолікулів були розташовані в центрі тканини яєчника, тоді як первинні фолікули в основному розподілені по периферії тканини яєчників (рис. 6, а-г). Після вимірювання розміру ооцитів група, яка отримувала kp-10, досягла більш високого діаметру в порівнянні з ооцитами контрольних яєчників (рис. 6 f).
Обговорення
Для програмування захворювань дорослих були визначені різні типи харчового статусу матері [2]. І численні докази продемонстрували, що вплив матері на ВЧД під час гестації та лактації шкідливо впливає на потомство [20, 21]. У цьому дослідженні ми зосередили увагу на впливі матері на ВЧД під час гестації лише для імітації надмірного збільшення ваги вагітності та досліджували репродуктивний потенціал жіночих нащадків при PND4 та PND30. Ми виявили, що ранній фолікулярний розвиток у новонароджених та перед пубертатом фолікулярний розвиток у нащадків був порушений HFD матері під час гестації. Точний механізм залишається незрозумілим, однак, схоже, що може бути задіяна система kisspeptin/GPR54.
Вплив HFD під час гестації на масу тіла
Перинатальне середовище, включаючи лактацію, також є дуже важливим вікном програмування, яке, як вважається, відіграє вирішальну роль у розвитку нащадків [1]. Хоча на грудне молоко в основному впливає дієта для лактації, неминуче, щоб гестаційна дієта також мала певний вплив на склад [40]. Тому важливо вивчити склад поживних речовин і гормонів у грудному молоці, чим ми нехтували, розробляючи експеримент. Хоча в цьому дослідженні є певні обмеження, ми вважаємо, що це не змінить наших основних висновків та домислів.
Висновок
На закінчення, це дослідження показало, що HFD під час гестації призводив до змін у фолікулярному розвитку в неонатальному періоді та до статевого дозрівання у жіночих нащадків. Ми також продемонстрували, що група HFD демонструвала прогресивний початок статевого дозрівання та порушувала естральну циклічність. Однак довгостроковий вплив HFD матері на функцію яєчників нащадків, такий як дорослий та період старіння, слід додатково розкрити. Хоча ми припускаємо, що локальний кисспептин яєчника може частково пояснити зміну фізіологічних процесів у яєчнику та продемонструвати пряму роль kp-10 у розвитку фолікулів, механізм не встановлений.
- Дієта з високим вмістом жиру у матері призводить до розширення ILC3 в мікробіоті у нащадків мишей
- Дієта матері під час вагітності та зріст потомства, зріст сидячи та довжина ніг
- Харчування матері та реакція на стрес нащадків - наслідки для майбутнього розвитку
- Дієта матері під час вагітності щодо екземи та алергічної сенсибілізації у нащадків при
- Дієта матері та ризик гострого лімфобластного лейкозу в дитинстві