Дефіцит головного мозку 5-HT запобігає антидепресантним ефектам дієти з високим вмістом жиру та блокує фосфорилювання GSK3β, спричинену високим вмістом жиру, в гіпокампі
Пов’язані дані
Набори даних, створені для цього дослідження, доступні за запитом до відповідного автора.
Анотація
Вступ
Метод
Тварини
Чоловічі гомозиготні WT та гомозиготні KI тварини з лінії мишей Tph2R439H, що використовувались для цього дослідження, були отримані шляхом гетерозиготного розведення в Університеті Вілланова. Ця лінія була перекреслена до лінії C57BL/6 протягом 10 поколінь, і одноколесники використовувались як засоби контролю. Дорослих мишей використовували для всіх експериментів, і вплив HFD починався, коли мишам було 2–4 місяці. Не було відмінностей середнього віку мишей в жодній з груп лікування. Усі дослідження проводились відповідно до протоколів, затверджених Інституційним комітетом з догляду та використання тварин (IACUC).
Дієта та житло
Всіх мишей годували Tevid Global Diet (стандартна дієта з натуральних компонентів: ID # 2019, 19% білка, 9% жиру та 3,3 ккал/г) з моменту відлучення до початку впливу HFD. Групи HFD годували Tevid Custom Diet від Envigo (відкоригована жирова дієта: ID # 95217, 18,8% білка, 39,7% жиру та 4,3 ккал/г) протягом 22 тижнів, тоді як групи стандартної дієти (SD) продовжували отримувати Envigo # 2019 дієта протягом усього дослідження. Їжа та вода були доступні за бажанням, а тварини розміщувались у приміщенні з контролем температури та вологості. Мишей утримували у групі (від трьох до п’яти в клітці), витримували 12-годинний цикл світло-темрява і зважували щотижня протягом експерименту. Тестування поведінки розпочалося після того, як миші були на ВЧС (або СД) протягом 20 тижнів. Порядок тестування був таким: тест на відкритому грунті (OFT), 20 тиждень, п’ятниця; підвищений плюс лабіринт (EPM), 21 тиждень, понеділок; і тест на примусове плавання (FST), 21 тиждень, п’ятниця. Тестування поведінки проводили під час світлової фази циклу світло-темрява, як правило, починаючи
За 5 год до початку темної фази.
Окремі когорти мишей WT та KI були розміщені поодиноко, щоб забезпечити вимірювання споживання їжі. Двадцятичотиригодинне споживання SD та HFD вимірювали один раз на тиждень.
Тест на відкритому полі
Для OFT дослідження та рухову активність оцінювали в камерах активності з оргскла розміром 40 см × 40 см БУДЬ-ЯКИХ коробок (Stoelting, Wood Dale, IL, США), з центральним квадратним розміром 20 см × 20 см. Кожну мишу поміщали в кут відкритого поля, і її рух та розташування реєстрували протягом 20 хв за допомогою цифрових фотокамер. Загальна пройдена відстань, пройдена відстань у центрі, кількість входів до центру та час перебування в центрі розраховувались за допомогою БУДЬ-ЯКОГО програмного забезпечення-лабіринту.
Підвищений плюс лабіринт
Для EPM місцезнаходження та активність мишей в апараті вимірювали за допомогою БУДЬ-ЯКОГО програмного забезпечення для відстеження тварин. Для кожної миші визначали витрачений час та пройдену відстань у розкритих обіймах, у закритих руках та в цілому апараті.
Тест на примусове плавання
FST проводився по суті, як ми вже повідомляли (Sachs et al., 2014a). Коротко кажучи, мишей поміщали в склянку об'ємом 4 л, наповнену приблизно 2500 мл води з температурою 25 ° C, де вони залишались протягом 6 хв. Поведінка кожної миші реєструвалася згори за допомогою камери, підвішеної над мензуркою. Будь-яке програмне забезпечення з лабіринтом використовувалося для вимірювання кількості часу, який кожна миша проводила нерухомо, і кількості нерухомих епізодів.
Аналіз експресії генів
Через тиждень після FST мишей вбивали вивихом шийки матки та обезголовленням, після чого мозок видаляли та розподіляли на ділянки товщиною 1 мм за допомогою матриці мозку. Двосторонні пуансони тканини (діаметром 1,5 мм і товщиною 1 мм) були взяті з гіпокампа [з центром приблизно ± 1,0 мм середньо-латерального (ML), -2,0 мм передньо-заднього (AP), -1,7 мм дорсо-вентрального (DV ) щодо Bregma] і негайно заморожують на сухому льоду і переносять у морозильну камеру -70 ° C до подальшої обробки. РНК виділяли із зразків тканин, зібраних з гіпокампу лівої півкулі, за допомогою Міні-набору Ambion PureLink RNA Mini Kit, відповідно до інструкцій виробника. РНК заморожували при -70 ° C до подальшої обробки.
Зворотну транскрипцію виконували за допомогою набору синтезу кДНК Thermo Scientific Maxima First Strand відповідно до інструкцій виробника. Ланцюгову реакцію полімерази в режимі реального часу (RT-PCR) проводили, як ми вже описали раніше (Sachs et al., 2018), використовуючи набір rt-PCR PowerUp Sybr Green Master Mix (Applied Biosystems, Фостер-Сіті, Каліфорнія, США) відповідно до інструкції виробника. Послідовності праймерів були обрані з PrimerBank (Wang et al., 2012): GAPDH вперед: 5′-CATGTTCCAGTATGACTCCACTC-3 ′; GAPDH реверс: 5′-GGCCTCACCCCATTTGATGT-3 ′; доповнення C4A вперед: 5′-GATGACAAGAACGTGAGTGTCC-3 ′; доповнення C4A реверс: 5′-CCCTTTAGCCACCAATTTCAGG-3 ′; IL-1β вперед: 5′-TTCAGGCAGGCAGTATCACTC-3 ′; Зворотний IL-1β: 5′-GAAGGTCCACGGGAAAGACAC-3 ′; Іл-6 вперед: 5′-TCTATACCACTTCACAAGTCGGA-3 ′; Реверс ІЛ-6: 5′-GAATTGCCATTGCACAACTCTTT-3 ′; іонізована молекула адаптера зв’язування кальцію 1 (IBA1) вперед: 5′-ATCAACAAGCAATTCCTCGATGA-3 ′; IBA1 реверс: 5′-CAGCATTCGCTTCAAGGACATA-3 ′; GSK3β вперед: 5′-ACAGGCCACAGGAGGTCAGT-3 ′; GSK3β реверс: 5′-GATGGCAACCAGTTCTCCAG-3 ′.
Вестерн-блотинг
Проколу тканини гіпокампа з правої півкулі обробляли на вестерн-блотинг, як ми вже описали раніше (Sachs et al., 2014b). Коротко, зразки лізували в крижаному буфері для лізису (1% тритон, 1 мМ ЕДТА, 150 мМ NaCl і 20 мМ трис-HCl) з додаванням інгібіторів протеази та фосфатази. Невелику аликвоту використовували для визначення білка за допомогою наборів для аналізу біцинхонінової кислоти (BCA) (Boston Bio Products, Ashland, MA, USA). Рівні кількості білка завантажували в гелі TGX для електрофорезу. Потім білки переносили в мембрани полівінілідендіфториду (PVDF), і проводили вестерн-блоттінг з використанням таких антитіл: кролячий антифосфорильований GSK3β (Cell Signaling, №9323, розведення 1: 300), мишачий антитотальний GSK3β (Cell Signaling, # 9832, розведення 1: 300) та кролячий анти-GAPDH як контроль завантаження (Cell Signaling, № 5174, розведення 1: 300).
Статистичний аналіз
Для збільшення ваги було використано програмне забезпечення SPSS для проведення трифакторного ANOVA з двома факторами між суб’єктами (тобто генотипом та дієтою) та одним фактором повторних вимірювань (тобто часом). Всі інші дані були проаналізовані двостороннім ANOVA з генотипом та дієтою як фактори за допомогою програмного забезпечення JMP.
Результати
Набір ваги з високим вмістом жиру та дієти
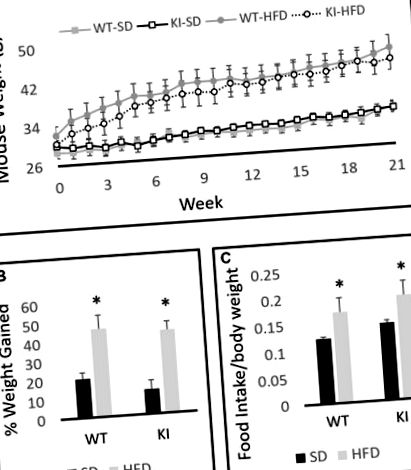
Двома-двома ANOVA між суб'єктами з дієтою та генотипом як факторами виявлено значний вплив дієти на вагу (F (1,30) = 19,6, p Малюнок 1A), але жодного ефекту генотипу (F (1,30) = 0,001, p = 0,97, рисунок 1А). Аналіз повторних вимірювань у пацієнтів виявив значний вплив часу на масу тіла (F (21,10) = 69,2, p Рисунок 1A) та значний час за допомогою дієтичної взаємодії (F (21,10) = 15,0, p Рисунок 1А). Хронічний вплив HFD призвів до значно більшого збільшення маси тіла як у тварин із ЗТ, так і у КІ, ніж при тривалому впливі на СД, але жодної суттєвої різниці генотипів у масі тіла не спостерігалося ні в один момент часу (рис. 1А). Як і очікувалося, тварини, які отримували HFD, збільшували свою вагу на значно вищий відсоток, ніж миші, що годували SD, протягом експерименту (F (1,30) = 34,98, p Малюнок 1B). Порівняння 24-годинного прийому їжі у мишей WT та KI, які споживали SD або HFD, не виявило значних відмінностей у споживанні генотипів, але миші з’їли значно більше HFD на масу тіла порівняно з SD (основний ефект дієти двостороннім ANOVA, F ( 1,24) = 5,88, р = 0,023, рисунок 1С).
Вага тіла мишей дикого типу (WT) та нокаутів (KI) на стандартній дієті (SD) та дієті з високим вмістом жиру (HFD). (A) Кількісне визначення середньої ваги тіла для кожної групи в часі. (B) Розрахунок середнього відсотка приросту маси тіла протягом 21 тижня для кожної групи. (C) Середнє щоденне споживання їжі у мишей на SD або HFD. Результати виражаються як середнє значення, а стовпчики помилок означають стандартну помилку. “*” Позначає основний ефект дієти двостороннім ANOVA, p Рисунок 2A) та зменшення кількості входів, зроблених в центр поля (основний ефект дієти; F (1,35) = 6,29, p = 0,019, Малюнок 2B). Однак не було суттєвого загального впливу дієти на рухливу активність (F (1,35) = 1,20, p = 0,28, малюнок 2C), що свідчить про те, що спостережувані ефекти на відстань у центрі та кількість входів до центру є не лише результатом зниження рухової активності. Незважаючи на зменшення кількості входів до центру та відстані в центрі, не було значного впливу дієти на кількість часу, проведеного в центрі відкритого поля (F (1,35) = 2,86, p = 0,099, рис. 2D ). Істотних ефектів генотипу та генотипу внаслідок дієтичних взаємодій не спостерігалося.
Тест на примусове плавання
Щодо FST, то не спостерігалось значних основних наслідків дієти та генотипу. Однак існували значні генотипи за дієтичними взаємодіями за кількістю нерухомих епізодів (F (1,35) = 6,91, p = 0,013, малюнок 2I) та за час перебування нерухомого (F (1,35) = 6,31, p = 0,017, малюнок 2J). Post-hoc t-тести показали, що HFD призвів до значного зменшення нерухомих епізодів у мишей WT, але не мав значного ефекту на тварин KI (Фігура 2I). Не було значущих відмінностей у генотипі поведінки FST у мишей на SD, але миші KI, які годували HFD, демонстрували значно більше нерухомих епізодів і значно більше часу, проведеного нерухомими, ніж миші WT, які годували HFD (малюнки 2I, J).
Експресія гена гіпокампа
HFD суттєво підвищував експресію в гіпокампах гена IL-1β (основний ефект дієти, F (1,32) = 5,3, p = 0,028, малюнок 3A), але не мав значних ефектів генотипу, а взаємодій не спостерігалося. На відміну від цього, ніяких значущих основних ефектів дієти чи генотипу та значних взаємодій не спостерігалося для експресії IL-6 (рис. 3B) або IBA1 (рис. 3C). Аналіз експресії генів показав, що HFD призвів до значного збільшення експресії гіпокампа гена комплементу 4A (C4A) (основний ефект дієти, F (1,32) = 6,99, p = 0,013, малюнок 3D). Крім того, спостерігалося, що миші KI демонстрували значно нижчий рівень C4A, ніж миші WT (основний ефект генотипу, F (1,32) = 4,33, p = 0,046, малюнок 3D), але взаємодій не спостерігалося.
Вплив хронічного HFD на мишей WT та KI на експресію генів, пов’язаних із запаленням, в гіпокампі. (A) Гіпокампальна експресія інтерлейкіну-1β (IL-1β). (B) Експресія інтерлейкіну-6 (IL-6) у гіпокампах. (C) Гіпокампальна експресія IBA1. (D) Експресія гіпокампа C4a. Усі дані нормалізовані до GAPDH. Результати виражаються як середнє значення, а стовпчики помилок вказують на стандартну помилку середнього значення. «Δ» вказує на основний ефект генотипу, «*» вказує на основний ефект дієти за допомогою двосторонньої ANOVA. N = 9–11 на групу.
Сигналізація гіпокампа GSK3β
Істотних основних ефектів генотипу або дієти на фосфорилювання GSK3β в гіпокампі не спостерігалося. Однак значний генотип за допомогою дієтичної взаємодії спостерігався на рівні гіпокампа фосфорильованого GSK3β відносно загального GSK3β (F (1,30) = 4,74, p = 0,0375, малюнок 4A). Post hoc аналізи показали, що HFD призвів до значного збільшення фосфорилювання GSK3β у мишей WT, але не тварин Tph2KI. Суттєвих змін рівня мРНК GSK3β в гіпокампі не спостерігалося (рис. 4В).
- 1,3-Dmaa використання, побічні ефекти, взаємодії, дозування та попередження
- Переваги гриба Agaricus, побічні ефекти, дозування, взаємодія
- Основи препарату Авандія (розиглітазон), побічні ефекти; Відгуки
- Використання синьо-зелених водоростей, побічні ефекти, взаємодія, дозування та попередження
- 7 корисних для здоров’я побічних ефектів Goldenberry - SelfHacked