Цитокіни для оцінки хронічного запального стану при дослідженнях старіння: надійність та фенотипова характеристика
Анотація
Передумови
Зростає інтерес до ролі запалення для розвитку хронічного захворювання. Цитокіни є потужними розчинними імунними медіаторами, які можуть бути використані як цільові біомаркери запалення; однак їх вимірювання у зразках людини було складним завданням. Це дослідження мало на меті оцінити надійність про- та протизапальної панелі цитокінів у вибірці здорових людей, виміряну за допомогою нової електрохімілюмінесцентної мультиплексної платформи імунологічного аналізу (Meso Scale Discovery, MSD), та охарактеризувати їх асоціації з метаболічними та запальними фенотипами.
Результати
Загалом, більшість цитокінів перевищували межу виявлення (принаймні у 85,3% зразків). Цитокіни IL-6, IL-8, TNF-α, IL-10, IL-13 та IFN-γ показали загальну добру до справедливої надійності (ICC> 0,40), тоді як IL-1β, IL-2, IL-4, і IL-12p70 показали низьку надійність (ICC
Передумови
Запалення все частіше визнається важливим патофізіологічним явищем у старінні [1]. Два десятиліття тому Франчески та ін. (2000) ввів термін „запалення” як перспективну нову область досліджень зв’язку між імунітетом, хронічним запаленням та старінням [2]. З тих пір з’явилося все більше доказів, що свідчать про важливу роль запалення у розвитку хронічних захворювань, таких як хвороба Альцгеймера, атеросклероз, хвороби серця, діабет ІІ типу та рак [3]. Основні механізми, за допомогою яких запалення впливає на складні патологічні зміни та розвиток хвороби, досі не з’ясовані до кінця [4].
Цитокіни є потужними розчинними імунними медіаторами, порушеними при різних станах хвороби, і їх вимірювання може дати важливу інформацію про патогенез багатьох вікових захворювань та роль запалення [5,6,7]. На сьогодні кількісне визначення цитокінів у кровообігу людини було проблемою як для дослідників, так і для клініцистів [8]. Зазвичай цитокіни чинять біологічну дію при низьких фармакологічних дозах, а концентрація в циркуляції нижче межі виявлення за допомогою комерційно доступних наборів для аналізів. Рівні цитокінів у крові мають короткий період напіввиведення і схильні до істотної мінливості, що потенційно пояснюється добовими ритмами, обробкою, обробкою та зберіганням крові та методами аналізу [8].
Цитокіни вимірювали на рівнях РНК (мРНК) з використанням ланцюгової реакції полімеразної зворотної транскрипції (RT-PCR), а також на рівні білка за допомогою біологічного аналізу на цитокіни або імуноферментних аналізів (ІФА) [9]. Ці методи мають свої недоліки, і результати, отримані з використанням комерційних аналізів, слід інтерпретувати з обережністю [9]. Досягнення лабораторних технологій, включаючи проточну цитометрію, аналізи на основі гранул Luminex [10] та планарні мультиплексні аналізи, дозволяють вимірювати більш повну панель цитокінів у сироватці/плазмі протягом короткого періоду та з меншими обсягами зразків [8]. Серед нових мультиплексних платформ платформа мультиплексного імунологічного аналізу (Meso Scale Discovery, MSD) представляє поєднання електрохімілюмінесценції та візерункових масивів із наднизькими межами виявлення. Надійність вимірювання цитокінів за допомогою платформи MSD оцінювали у двох недавніх дослідженнях [11, 12]; однак, жодне з цих досліджень не стосувалось доцільності вимірювань у великих когортах населення, придатних для просування досліджень імунітету та старіння. Дані цих досліджень були обмежені характеристиками пацієнта [молоді чоловіки, які мають ризик зараження ВІЛ-інфекцією] [11], або невеликим обсягом вибірки [n = 10] досліджень [12].
У великих популяційних когортних дослідженнях рекрутовані учасники переважно здорові на початковому етапі дослідження, і дослідники прагнуть зафіксувати навіть тонкі патофізіологічні зміни запальної реакції для виявлення осіб високого ризику. Більше того, в більшості досліджень використовується один зразок крові, припускаючи, що одне вимірювання відображає довготривалий стан запалення людини. До цього часу дослідження, спрямовані на оцінку тимчасової надійності прозапальних панелей цитокінів та характеристику кореляційних зв'язків з метаболічними фенотипами в переважно здоровій когорті, не проводились.
Тому ми прагнули оцінити надійність десяти цитокінів [інтерферон-гамма (IFN-γ), інтерлейкін-1бета (IL-1β), інтерлейкін-2 (IL-2), інтерлейкін-4 (IL-4), інтерлейкін-6 ( IL-6), інтерлейкін-8 (IL-8), інтерлейкін-10 (IL-10), інтерлейкін-12p70 (IL-12p70), інтерлейкін-13 (IL-13) та фактор некрозу пухлини альфа (TNF-α )], виміряний у плазмі людини за допомогою платформи MSD протягом 4-місячного періоду. При вторинних аналізах ми охарактеризували поперечні зв’язки між концентраціями цитокінів та метаболічними фенотипами.
Результати
У таблиці 1 представлені базові характеристики учасників дослідження. Загалом у дослідження було включено 124 жінки та 83 чоловіки. Середній вік учасників дослідження становив 55,4 року для жінок та 57,6 років для чоловіків. Учасники мали середній індекс маси тіла (ІМТ) 26,1 кг/м 2 (78% чоловіків мали ІМТ ≥ 25,0 кг/м 2; 50% жінок мали ІМТ ≥ 25,0 кг/м 2) та окружність талії (WC) 93,0 см. Середні значення систолічного та діастолічного артеріального тиску становили 136 мм рт. Ст. І 88 мм. Рт. Ст. Відповідно. Зразки крові відбирали у більшості учасників (90%) після нічного голодування, а у решти - випадковий збір крові.
У таблиці 2 представлені внутрішньокласові кореляції (ICC) та 95% довірчі інтервали (CI), що відображають надійність вимірювань цитокінів протягом 4-місячного періоду загалом та за статтю. Загалом, оцінки надійності варіювались від хороших до справедливих, коли IL-6, IL-8 та TNF-α демонстрували найвищі показники ІКК (0,60 Таблиця 2 Повторні вимірювання концентрацій цитокінів загалом та за статтю, з розрахунковими МКК
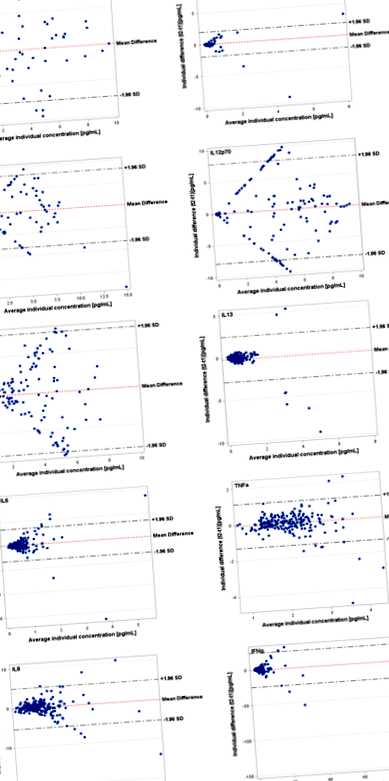
Ці дані були додатково підтверджені ділянками Бленда-Альтмана, які показали відповідні високі рівні згоди та симетричні розподіли цитокінів з вищими ICC (TNF-α, IL-6, IL-8, IL-10, IL-13) та зниженими рівнями угод та розподіленого розподілу для тих цитокінів з низькими ICC (IL-1β, IL-2, IL-4, IL-12p70) (рис. 1).
Графіки Бленда-Альтмана показують узгодження між log-трансформованими концентраціями цитокінів на початковому рівні та через 4 місяці відносно середніх концентрацій для кожної особини. Згода повторних вимірювань (вісь у) щодо середніх концентрацій (вісь х) для кожної людини. Горизонтальні лінії показують середню різницю та 95% ДІ меж згоди, які визначаються як середня різниця +/− 1,96 рази середнє стандартне відхилення різниць
В аналізах за віковими категоріями можна спостерігати зростання медіанних концентрацій плазми для IL-2, IL-6, IL-8, IFN-γ та TNF-α, тоді як середні концентрації решти цитокіни залишались майже незмінними (див. рис. 2). У таблиці 3 представлені часткові коефіцієнти кореляції Спірмена між середньою концентрацією біомаркерів та антропометричними параметрами, високочутливим С-реактивним білком (hsCRP) та фізичною активністю. Серед усіх цитокінів IL-6 виявився найбільш тісно пов'язаним з ІМТ (ρ: 0,36; 95% ДІ: 0,23-0,47), WC (ρ: 0,41; 95% ДІ: 0,28-0,51) та hsCRP (ρ: 0,53; 95% ДІ: 0,41–0,63). Більш слабкі позитивні кореляції з ІМТ, окружністю талії та hsCRP також можна спостерігати при TNF-α (ρ: 0,20; 95% ДІ: 0,07-0,33; ρ: 0,16; 95% ДІ: 0,03-0,29 та ρ: 0,22; 95% ДІ: 0,07–0,36 відповідно). Зворотна, хоча і слабка кореляція спостерігалася для IL-1β та ІМТ (ρ: -0,19; 95% ДІ: - 0,37-0,01), тоді як IL-10 та IFN-γ корелювали з hsCRP (ρ: 0,19; 95% ДІ: 0,03–0,33 та ρ: 0,23; 95% ДІ: 0,08–0,37 відповідно). ІЛ-6 і ФНО-α були обернено корельованими з фізичною активністю (ρ: -0,12; 95% ДІ: - 0,26-0,01 та ρ: -0,15; 95% ДІ: - 0,28-0,02). Більшість кореляцій, що залишились, мали незначну величину.
Графічні графіки, що візуалізують розподіл log трансформованих концентрацій цитокінів, стратифікованих за віковими третинами. Цей показник представляє розподіл інтерлейкіну 1-бета (IL-1β), інтерлейкіну 2 (IL-2), інтерлейкіну 4 (IL-4), інтерлейкіну 6 (IL-6), інтерлейкіну 8 (IL-8), інтерлейкіну 10 ( IL-10), інтерлейкін 12p70 (IL-12p70), інтерлейкін 13 (IL-13), інтерферон-гама (IFN-γ) та фактор некрозу пухлини альфа (TNF-α) відповідно до зростаючих вікових категорій (червоний: 44,9–54,7 років, зелений: 54,8–58,8 років, а фіолетовий: 58,9–64,0 років). Концентрації дають зразки плазми, зібрані під час першого вимірювання
Нарешті, щоб полегшити застосування поточних результатів для корекції вимірювань у майбутніх дослідженнях, ми надаємо оцінки справжнього та спостережуваного ризику в залежності від МКК цитокінів (додатковий файл 5). Відмінності між гіпотетичними коефіцієнтами ризику (1,5, 2,5 та 3,5) та спостережуваними коефіцієнтами ризику обумовлені (недосконалою) надійністю біомаркеру внаслідок внутрішньо-індивідуальних коливань. Як приклад, якщо хочеться дослідити асоціацію експозиції-результату IL-8 на основі єдиного показника, виміряний IL-8 призведе до недооцінки справжнього співвідношення ризику. Наприклад, спостерігається коефіцієнт ризику становить 2,3, тоді як справжній коефіцієнт ризику становить 3,5, беручи до уваги конкретний ICC IL-8 (0,64).
Обговорення
У цьому дослідженні, проведеному серед переважно здорових людей, ми оцінили надійність циркулюючих концентрацій десяти цитокінів, виміряних за допомогою нової платформи MSD, протягом 4-місячного періоду часу. Загалом, більшість цитокінів перевищували межу виявлення (принаймні у 85,3% зразків). Оцінки надійності коливались від хороших до поганих. Цитокіни IL-6, IL-8, TNF-α, IL-10, IL-13 та IFN-γ показали загальну хорошу надійність (ICC> 0,40), тоді як IL-1β, IL-2, IL-4 та IL -12p70 показав низьку надійність (ICC Таблиця 4 ICC з 95% ДІ запальних цитокінів у переважно здорових учасників, раніше опублікованих у літературі
Наші результати можуть допомогти дослідникам майбутніх перспективних досліджень цитокінів плазми крові оцінити справжній відносний ризик з огляду на спостережуваний відносний ризик. Зокрема, ICC можуть бути використані для корекції відносних ризиків або коефіцієнтів кореляції та їх довірчих інтервалів для випадкових коливань у межах людини для врахування ослаблення, спричиненого помилкою вимірювання [21]. Корекція помилок вимірювання матиме значний вплив на остаточну оцінку цитокінів зі скромними ІКК, як показано для інших досліджень біомаркерів [22].
Широкий діапазон факторів може впливати на рівень цитокінів у крові. Сюди входять вік, стать, стан ожиріння та загальний запальний стан. Тому ми оцінили, чи можуть деякі із цих факторів також впливати на спостережувані результати щодо надійності вимірюваних цитокінів. Наші дані не виявили виражених відмінностей за шарами віку, статі, ожиріння та рівня СРБ, аргументуючи можливий вплив будь-якого з цих факторів на спостережувані оцінки надійності. Різниця між концентраціями цитокінів у циркулюючому середовищі у людей також може існувати через сезонну, гормональну або циркадну фізіологічну мінливість. Концентрації цитокінів були вищими у денних вимірах порівняно з ранковими, нібито відображаючи вплив циркулюючого кортизолу [23]. Ці висновки узгоджуються з попередньою роботою, яка показувала денну регуляцію медіаторів запалення, включаючи IL-6 у здорових людей [24]. У нашому дослідженні, однак, варіації могли бути обмеженими через обмежений інтервал часу, коли брали зразки.
Щорічна сезонність також вважається важливим фактором навколишнього середовища, що впливає на вироблення цитокінів [25]. Сезонні коливання можуть відображати фізіологічну реакцію на зміну світлового дня, температуру в приміщенні чи на відкритому повітрі або коливання фізичної активності в зимовий та літній сезон. Наприклад, у когорті з 530 здорових людей продукція кількох цитокінів (IL-1β, IL-6 та TNF-α) показала значні піки влітку порівняно з іншими сезонами [25]. Оскільки ми проводили перше та друге вимірювання в різні сезони, між жовтнем-березнем (осінь/зима) та лютим – липнем (зима/весна/літо), і у нас був лише один зразок крові за час, ми не можемо визначити, чи є варіації залежать від сезонності. Однак, оскільки ми не виявили значних відмінностей між двома вимірами, ми могли виключити великий вплив сезонності на стабільність біомаркерів. Подібно до наших висновків, попереднє дослідження надійності, що оцінювало сезонну мінливість IL-1β, IL-6, IL-8 та TNF-α (n = 48) не спостерігали суттєвих змін сезонів [20].
Наше дослідження має кілька сильних сторін. Ми застосували електрохімілюмінесцентну мультиплексну платформу імунологічного аналізу (Meso Scale Discovery, MSD) як нову зручну методику, яка може бути корисною для майбутніх епідеміологічних досліджень, в яких буде задіяно велику кількість учасників. Наші дослідження включали обидві статі, і обсяг вибірки був порівняно великим для валідаційного дослідження порівняно з більшістю досліджень надійності в літературі (див. Додатковий файл 4). Біомаркери, які ми вимірювали, представляли різні аспекти імунно-запальних шляхів під час адаптивних та вроджених імунних відповідей, маючи прозапальну (IL-1β, IL-2, IL-8, IL-12p70, TNF-α, IFN-γ) або анти -запальні (IL-4, IL-10) ефекти або обидва (IL-6, IL-13).
Висновок
Це дослідження надало перші рядки доказів, наскільки нам відомо, про надійність концентрацій цитокінів, виміряних за новою методологією MSD. Наші результати показали, що одноразові вимірювання IL-6, IL-8, TNF-α, IL-10, IL-13 та IFN-γ можуть точно оцінити мінливість біомаркеру протягом певного періоду та можуть бути придатними для використання в перспективних епідеміологічних та клінічних дослідженнях. Такі дослідження вкрай необхідні для характеристики зв'язків цитокінів з фенотипами та захворюваннями, пов'язаними зі старінням.
- Харчові волокна, споживання енергії та стан харчування під час лікування дітей з хронічними захворюваннями
- Еозинофільний езофагіт сучасний стан та майбутні напрямки Педіатричні дослідження
- Оцінка дієтичних поживних речовин щодо клінічних результатів у пацієнтів із хронічно-прогресивним множинним захворюванням
- Дієтна схема для хворих на хронічний панкреатит Хворий на хронічний панкреатит Дієтна схема Лібрат
- Харчові рецепти дозволяють лікувати хронічні захворювання