Анти-HBV-ефект цільової рибонуклеази TAT-HBV
Листування: професору Цай-Фангу Сюе або доктору Цзюнь Лю, кафедрі етіології, Четвертий військово-медичний університет, Сіань 710032, провінція Шеньсі, Китай. nc.ude.ummf@ygoloite
Телефон: + 86-029-3374536 Факс: + 86-029-3374594
Анотація
ЦІЛЬ: Підготувати та очистити злитий білок рибонуклеази TAT-HBV, оцінити його трансдукційну активність та дослідити його вплив на реплікацію HBV у клітинах 2.2.15.
МЕТОДИ: Прокаріотичний вектор експресії pTAT, що містить ген TR, використовували для трансформації E.coli BL21 (DE3) LysS, а TR експресували з індукцією IPTG. Злитий білок TAT-TR очищали за допомогою колонок для знесолення Ni-NTA-агрози та PD-10 та аналізували за допомогою SDS-PAGE. Ефективність трансдукції TAT-TR виявляли за допомогою імунофлуоресцентного аналізу, а концентрацію HBeAg у супернатанті клітин 2.2.15 визначали за допомогою твердофазного радіоімуноаналізу (spRIA). Для визначення цитотоксичності TAT-TR використовували аналіз МТТ.
РЕЗУЛЬТАТИ: SDS-PAGE показав, що злитий білок TAT-TR був успішно очищений, а чистота TAT-TR становила 90%. Візуалізація TAT-TR за допомогою імунофлуоресцентного аналізу показала його високу ефективність у трансдукції клітин 2.2.15. Результат RIA свідчить про те, що TAT-TR може ефективно пригнічувати реплікацію HBV, він не впливав на ріст клітин і не мав цитотоксичності.
ВИСНОВОК: TAT-TR має значну анти-HBV-активність, а отримання злитого білка TAT-TR заклало основу для використання TR у терапевтичному дослідженні інфекції HBV.
ВСТУП
Введення білків у клітини ссавців було досягнуто шляхом трансфекції експресійних векторів, мікроін’єкції або інфекційного вірусу тощо. Хоча ці підходи були дещо успішними, класичні методи маніпуляції нелегко регулюються і можуть бути трудомісткими. Одним із підходів до вирішення цих проблем є використання трансдукції білка, опосередкованої PTD [1,2]. Пов’язаний ковалентно з білками, пептидами, нуклеїновими кислотами або як злиття з рамками з повнорозмірними білками, PTD дозволяв їм потрапляти до будь-якого типу клітин незалежно від рецепторів та транспортерів [3]. ВІЛ-ТАТ є членом доменів трансдукції білка і, мабуть, має високий рівень ефективності трансдукції білка [4,5]. Було показано, що злиті білки TAT трансдурують у всі клітини та тканини, наявні у мишей [6], включаючи ті, що присутні через гематоенцефалічний бар’єр [7,8]. І багато, якщо не більшість, білків можуть перетворюватися в клітини за допомогою цієї технології. Тому TAT PTD може дозволити нам звернутися до нових питань у доклінічних дослідницьких роботах і навіть допомогти в лікуванні захворювань людини.
Гепатит В є основною проблемою охорони здоров'я у всьому світі [9-13]. Хронічна інфекція пов’язана з високим ризиком цирозу печінки та первинної карциноми печінки [14-22]. На сьогодні доступні методи лікування мають обмежену ефективність [23-35]. Ген HBV-цільової рибонуклеази (TR), ген злиття HBVc та hEDN, був сконструйований Liu та співавт. [36] у нашій лабораторії, згідно з теорією спрямованої на капсиди вірусної інактивації (CTVI), що є перспективною стратегією проти дослідження вірусів. В якості цільової молекули використовували HBVc, який був структурним білком HBV і був незамінним під час упаковки частинок HBV. Ефекторною молекулою був hEDN, різновид людської рибонуклеази, яка може розщеплювати pgRNA HBV. Трансфекція клітин 2.2.15 з еукаріотичним вектором експресії, що несе ген TR, припустила, що TR суттєво інгібує реплікацію HBV [37]. Отже, зв’язування ВІЛ-ТАТ з ТР забезпечить нам більш ефективний підхід до введення ТР у гепатоцити та значною мірою допоможе нам використовувати ТР при лікуванні інфекції HBV. Тут повідомляється про очищення злитого білка TAT-TR, ідентифікацію його трансдукції та ефект проти HBV на клітинах 2.2.15. Для підтвердження його анти-HBV механізму ми також підготували та очистили білки TAT-TRmut, TAT-hEDN та TAT-HBVc для використання в якості негативного контролю.
МАТЕРІАЛИ ТА МЕТОДИ
Матеріали
Ні-NTA-агроза була придбана у компанії Qiagen. Колонки для знесолення PD-10 придбано у Amersham Pharmacia Biotech. Анти-його mAb був від компанії Санта-Крус. Маркери молекулярної маси білка, IPTG та G418, імідазол та МТТ - усі були від китайсько-американських біотехнологій. Набір для аналізу RIA HBVeAg був придбаний в Інституті біотехнологій Бейміана Донгя. 2.2.15 клітини був ласкавим подарунком професора Ченга, 302 лікарні китайського НВАК. hEDN очищали Li et al [36]. pTAT-HA/TR, TAT-HA/TRmut, pTAT-HA/hEDN та pTAT-HA/HBVc були приготовані в нашій лабораторії [38]. PET-30a/TR, PET-30a/TRmut, PET-30a/HBVc та E.coli BL21 (DE3) LysS підтримувались у нашій лабораторії.
Методи
Експресія та очищення злитих білків ТАТ pTAT-HA/TR, TAT-HA/TRmut, pTAT-HA/hEDN, pTAT-HA/HBVc та pTAT-HA використовувались для трансформації E.coli BL21 (DE3) LysS за допомогою перфорації CaCl2. Трансформанти культивували окремо в 3 мл підсилювача ТБ (100 мкг/л) при 37 ° С протягом ночі. Культуру 100 мкл інокулювали в 10 мл підсилювача ТБ та інкубували протягом 4 годин при 37 ° С. Потім IPTG додавали в кожну пробірку до кінцевої концентрації 100 мкмоль/л, і культуру інкубували протягом додаткових 4 годин. Індуковані клітини збирали центрифугуванням, а клітинні лізати аналізували за допомогою 120 г/л SDS-PAGE. Злиті білки з міченим тегом очищали за допомогою колонок для знесолення Ni-NTA-агрози та PD-10 відповідно до рекомендацій виробника (Qiagen та Amersham Pharmacia). Очищені білки аналізували за допомогою 120 г/л SDS-PAGE.
Експресія та очищення білків без TAT PTD PET-30a/TR, pET-30a/TRmut та pET-30a/HBVc трансформували E.coli BL21 (DE3) LysS. Після аналізу рівнів експресії три білки очищали так само, як і для злитих білків ТАТ.
Культура 2.2.15 клітин Клітини культивували в DMEM, що містила 150 мл/л плодової бичачої сироватки при 37 ° C в 50 мл/л CO2 і 100 мг/л G418.
Ідентифікація трансдукції злитого білка TAT 2.2.15 клітини (2 × 10 8/л) висівали в 6-лункові пластини з покривними кораблями і залишали прилипати протягом 24 годин. TAT-TR, TAT-TRmut, TAT-hEDN, TAT-HBVc, TR, TRmut, hEDN і HBVc додавали в лунки відповідно при кінцевій концентрації 100 нмоль/л. Інкубували протягом 30 хв при 37 ° С, всі клітини негайно промивали стерильним PBS (pH 8,0), фіксували у 20 г/л параформальдегіду та 1 г/л TritonX-100, розведеному в PBS, і ставили на лід на 30 хв. Клітини тричі промивали холодним PBS. Неспецифічні епітопи блокували, використовуючи 10 г/л BSA протягом 10 хв при 42 ° C. Клітини тричі промивали холодним PBS, а потім інкубували з мишачими анти-His mAb (1: 500) протягом 15 хв при 42 ° C . Після триразового промивання в холодному PBS, кролячий анти-мишачий IgG, мічений FITC (1: 1000), додавали до кожної лунки та інкубували протягом 10 хв при 42 ° C. Промивали PBS протягом 1 години, а чохли встановлювали на предметні стекла з використанням 500 мл/л гліцерину. Клітини спостерігали за допомогою флуоресцентної мікроскопії.
Визначення анти-HBV ефекту TAT-TR 2.2.15 клітини висівали при щільності 2 × 10 8/л у 12-лункові планшети. TAT-TR, TAT-TRmut, TAT-hEDN і TAT-HBVc додавали в лунки відповідно при кінцевій концентрації 100 нмоль/л. 20 мкл DMEM додавали в лунки як імітаційну групу. Для кожної групи було встановлено чотири паралелі. Через 24 години HBVeAg в супернатанті визначали за допомогою набору spRIA, як описано виробником.
МТТ аналіз 2.2.15 клітини висівали при щільності 2 × 10 8/л у 96-лункові планшети. Через 24 год TAT-TR, TAT-TRmut, TAT-HEDN, TAT-HBVc додавали до груп (A), (B), (C), (D) при кінцевій концентрації 100 нмоль/л. 20 мкл DMEM додавали в лунку (E). Через 72 год морфологію клітин спостерігали за допомогою інвертованої мікроскопії, і МТТ застосовували в кожній лунці при кінцевій концентрації 5 г/л. Після ще 4 год культивування у всі лунки додали 150 мкл ДМСО і виявили поглинання світла при А490.
Статистичний аналіз
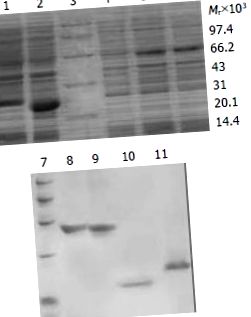
Всі отримані дані були оброблені програмним забезпеченням SPSS. P (рис.1). 1). Ступінь чистоти злитих білків становила 90%, 88%, 80% та 85% відповідно.
SDS-PAGE аналіз експресії та очищення злитих білків TAT. 1: Трансформований pTAT-HA/HBVc; 2: перетворений за допомогою pTAT-HA/hEDN; 3: Білковий маркер; 4: Трансформований pTAT-HA; 5: Трансформований pTAT-HA/TR; 6: перетворено pTAT-HA/TRmut; 7: Білковий маркер; 8: Очищений TAT-TN; 9: Очищений TAT-TNmut; 10: Очищений TAT-hEDN; 11. Очищений TAT-HBVc.
Експресія та очищення білків без TAT PTD
Подібним чином pET-30a/TR, pET-30a/TRmut та pET-30a/HBVc були індуковані для експресії білків без TAT PTD за допомогою IPTG в BL21 (DE3) LysS, і вони продукували білки з передбачуваними молекулярними масами (рис. (Рисунок 2). 2). Потім білки очищали за допомогою споріднених колонок Ni-NTA та колонок для знесолення PD-10. Ступінь чистоти злитих білків становила 88%, 76% та 81% відповідно.
SDS-PAGE аналіз очищених контрольних білків. 1: Білковий маркер; 2: очищений HBVc; 3: продукт експресії BL21, трансформований pET30-a/HBVc; 4: продукт експресії BL21, трансформований pET30-a; 5: Продукт експресії BL21, трансформований pET30-a/TR; 6. Продукт експресії BL21, трансформований pET30-a/TRmut; 7: Очищений TR; 8: Очищений TRmut.
Ідентифікація трансдукції білка
Оцінити здатність злиття білків до трансдукції при перетині мембрани 2.2.15 клітин. TAT-TR, TAT-TR mut, TAT-hEDN і TAT-HBVc додавали в культуральне середовище при кінцевій концентрації 100 нмоль/л. TR, TRmut, hEDN та HBVc без TAT PTD використовували як негативні контролі. Під флуоресцентним мікроскопом можна спостерігати рясну флуоресценцію в цитоплазмі клітин, трансдукованих злитими білками ТАТ, але флуоресценції в контрольних клітинах не виявлено (рисунок (рис. 3). 3). Цей результат чітко свідчить про те, що злиті білки TAT можуть перетинати мембрану клітин 2.2.15 з високою ефективністю.
Виявлення трансдукції злитих білків ТАТ у клітинах 2.2.15. A: Додано з TAT-TR; B: Додано з TAT-hEDN; C: Додано з TAT-HBVc; D: Додано з TAT-TRmut; a: Додано з TR; b: додано з hEDN; c: Додано з HBVc; d: Додано з TRmut.
Аналіз анти-HBV-активності на TAT-TR
Статистичний аналіз за допомогою програмного забезпечення SPSS показав, що середня концентрація HBeAg у групі TAT-TR значно зменшилася порівняно з контрольними групами (середня різниця є значною на рівні 0,05). Крім того, немає суттєвої різниці середньої концентрації контрольних груп (Р> 0,05). Концентрація HBeAg у групі TAT-TR зменшилась на 60,3% (рис. (Рис. 4 4).
Порівняння концентрації HBeAg між різними групами.
МТТ аналіз
Після 72 год культури морфологію клітин спостерігали під перевернутим мікроскопом, і було виявлено, що не було помітної різниці між чотирма експериментальними групами та контролем DMEM. Аналіз МТТ не показав суттєвої різниці між п’ятьма групами. Їх значення поглинання A490 (¯x ± s, n = 4) становили 0,4875 ± 0,018, 0,4675 ± 0,022, 0,4690 ± 0,028, 0,4800 ± 0,029 та 0,4855 ± 0,050, відповідно (P> 0,05).
ОБГОВОРЕННЯ
- Склад тіла у дітей з юнацьким ідіопатичним артритом ефект дієтичного споживання
- Ефект схуднення тіла
- Усі групи світу для схуднення закрилися з негайним впливом відповідно до останніх порад щодо коронавірусу -
- Усі групи світу для схуднення закрилися з негайним впливом відповідно до останніх порад щодо коронавірусу -
- Переваги та побічний ефект кави з медом для схуднення