Важливість типу розчинника в оцінці антиоксидантних властивостей фенольних сполук методом аналізу ABTS
Анотація
Аналіз ABTS належить до найпопулярніших методів оцінки антиоксидантної активності. Однак дослідники рідко звертають увагу на конкретні фактори, що впливають на визначення антиоксидантної активності досліджуваних сполук та сумішей. Стаття показує, що тип використовуваного алкоголю суттєво впливає на оцінку антиоксидантної активності фенольних сполук в аналізі ABTS, а саме, що їх антиоксидантна активність зростає із подовженням аліфатичного ланцюга в алкоголі. Це скоріше результат змін в ABTS •+ енергія сольватації використовуваними спиртами, ніж від дисоціаційних змін фенольних сполук. Отримані результати вказують на труднощі у правильній оцінці реальних антиоксидантних властивостей рослинних та харчових екстрактів за допомогою аналізу ABTS. Представлені результати також мають екологічне значення, оскільки посилаються на різницю в оцінці антиоксидантних властивостей сполук, що виникають в результаті заміщення токсичного метанолу розчинниками GRAS (загальновизнаним як безпечним), етанолом та пропанолом.
Вступ
Експериментальний розділ
Реагенти
Метанол, етанол, пропанол-1 (усі аналітичного реагенту) та реагент Карла Фішера були придбані у Польського хімічного заводу - POCh (Глівіце, Польща). 2,2'-азинобіс (3-етилбензотіазолін-6-сульфокислота) сіль діамонію (ABTS), персульфат калію (ди-калій пероксидисульфат), 2,2-дифеніл-1-пікрилгідразил (DPPH •) та BHT були придбані у Sigma-Aldrich (Познань, Польща). Воду очищали на системі Milli-Q від Millipore (Millipore, Бедфорд, Массачусетс, США).
Методи
Аналіз ABTS
Генерування катіона радикалу ABTS [2,2′-азинобіс (3-етилбензотіазолін-6-сульфонової кислоти)] діамонію] проводив Ненандіс [16]. Розчин ABTS • + готували реакцією 5 мл 7 мМ водного розчину ABTS і 88 мкл 140 мМ (2,45 мМ кінцевої концентрації) персульфату калію (K2S2O8). Суміш інкубували в темряві протягом 16 годин. Утворений таким чином катіон радикалів додатково розбавляли метанолом або етанолом, або пропанолом-1, або пропанолом-2. Було застосовано два типи алкогольних розчинів ABTS • +:
демонструючи початкове значення поглинання 0,71 при 744 нм і
що має однакову кількість ABTS • + (80 або 120 мкл розчину катіонного радикала в 10 мл кінцевого спиртового розчину).
Кінетику реакції ABTS • +/BHT оцінювали, вимірюючи зменшення концентрації катіону радикала ABTS при 744 нм (іноді при 757 і 412 нм) та/або збільшення концентрації у зниженій формі ABTS при 346 нм. Для нульового спектрофотометра використовували чисті розчинники (без ABTS • + і BHT). В якості контролю застосовували розчини ABTS • + без антиоксиданту.
Аналізи ABTS проводили згідно з такою процедурою: 2000 мкл розчину ABTS • + у даному спирті змішували в 4-мл пробірці з 20 мкл розчину BHT у тому ж спирті (0,5 мг/мл). Суміш інтенсивно перемішували протягом 30 с і виливали у кварцові кювети (1 см × 1 см × 3,5 см). Зміни поглинання контролювали за згаданої довжини хвилі протягом 60 хв (зрідка 180 хв) за допомогою спектрофотометра UV Probe-1800 (Shimadzu, Кіото, Японія). Подальші показники проводились через рівні проміжки часу (60 с).
Відсоток решти ABTS • + розраховували з наступного рівняння:
де A т0 і A т - значення поглинання ABTS • + через 0 хв і в момент часу, що дорівнює (т) хв відповідно.
Кінетику реакції ABTS • +/BHT також оцінювали, спостерігаючи збільшення концентрації у відновленій формі ABTS при 346 нм. Через вплив типу алкоголю на інтенсивності смуги поглинання на цій довжині хвилі зміни концентрації ABTS виражались як відносні зміни концентрації. Відносну концентрацію ABTS розраховували з наступного рівняння:
де A т0, A т і A т180 - значення поглинання ABTS через 0 хв, в момент часу, що дорівнює (т) хв і на 180 хв відповідно.
Визначення води Карлом Фішером
Частину досліджуваного спирту (100 мкл) вводили в напівавтоматичний пристрій Карла Фішера від Metrohm (Herisau, Швейцарія). Отримані результати відображали абсолютний вміст води у% введеного розчину.
Статистичний аналіз
Як було згадано вище, зміни в поглинанні контролювали протягом 60 хв (180 хв. Зрідка) через рівні проміжки часу (60 с). Кінетичні криві були втоплені з використанням усіх експериментальних даних; однак лише кілька експериментальних точок (середні значення ± SD) були наведені на рисунках для їх наочності. Для того, щоб визначити повторюваність вимірювань, кожен аналіз антиоксидантної активності проводили тричі. RSD усіх вимірювань були нижчими за 10%. P
Результати і обговорення
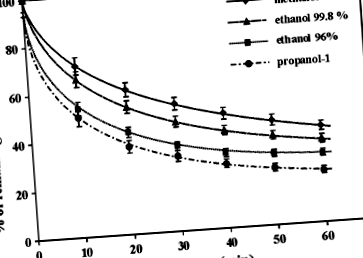
Вплив алкогольного типу (метанол, етанол та пропанол-1) на кінетику ABTS •+/Реакція ВНТ припинялася протягом 60 хв
Вплив концентрації води в метанолі, етанолі та пропанолі-1 на різницю (Δ) у кількості непрореагованого ABTS • + в системах, що містять вихідний спирт та в одних і тих же розчинниках при різних кількостях води
Результати, представлені на рис. 1, були отримані згідно загального припущення для аналізу ABTS, що поглинання вихідного розчину катіона радикалу ABTS має дорівнювати 0,71 ± 0,05 при 744 нм. На цьому етапі потрібно згадати, що різні обсяги ABTS •+ маточний розчин потрібно застосовувати для досягнення необхідної початкової абсорбції окремих спиртових розчинів. Наприклад, у представлених експериментах для приготування 10 мл обсягів розчину пропанолу або метанолу відповідно використовували близько 150 або 120 мкл об'ємного розчину. Все це свідчить про сольватохромний ефект у спектрі ABTS • +/ABTS. Спектри ABTS • +/ABTS у метанолі, етанолі чи пропанолі представлені на рис. 3а. Максимуми поглинання приблизно при 412, 658 та 744 нм відповідають катіону радикала ABTS, а максимум приблизно при 346 нм відповідають зменшеній формі ABTS [19, 20]. Як випливає з рис. 3а, заміна метанолу пропанолом-1 зміщує максимум рекомендованої смуги поглинання з 744 до 757 нм. На малюнку 3b – e показано вплив типу алкоголю на зміну концентрації решти ABTS • + протягом 60 хв вимірюваної реакції ABTS • +/BHT:
Спектри поглинання ABTS та продукту його окислення ABTS •+, в метанолі, етанолі та пропанолі-1 (a) та вплив типу алкоголю (метанолу та пропанолу-1) на зміну концентрації решти ABTS •+ протягом 60 хв ABTS •+/Виміряна реакція BHT: при 744 нм для метанолу та при 757 нм для пропанолу-1 в системах з початковою поглинанням розчину катіонного радикала ABTS, рівним 0,71 (b); при 744 нм для метанолу та при 757 нм для пропанолу-1 в системах, що містять однакові обсяги ABTS •+ основний розчин (80 мкл) (c); при 744 нм для метанолу та при 757 нм для пропанолу-1 в системах, що містять однакові обсяги ABTS • + основний розчин (120 мкл) (d); при 412 нм (e)
при 744 нм у випадку метанолу та при 757 нм у випадку пропанолу-1 для систем з початковою поглинанням розчину катіонного радикала ABTS, рівним 0,7;
при 744 нм у випадку метанолу та при 757 нм у випадку пропанолу-1 для систем, що містять однакові обсяги ABTS • + основний розчин (80 та 120 мкл);
Ці експерименти обмежувались порівнянням систем з метанолом та пропанолом-1 через спостережувані чіткі відмінності в кінетиці реакції ABTS • +/BHT, проведеної в цих спиртах. Залежності, представлені на рис. 3B-3E, підтверджують висновки з рис. 1 - швидкість реакції ABTS • +/BHT швидша у пропанолі-1, ніж у метанолі. Отже, можна зробити висновок, що спостережувана різниця в швидкості реакції не є результатом сольватохромного ефекту системи ABTS • +/ABTS.
Багато авторів [21, 22] класифікують ABTS як метод переносу електронів (ET). Метод, заснований на ЕТ, виявляє здатність потенційного антиоксиданта переносити один електрон для зменшення радикала (наприклад, ABTS • +). На думку Мусіаліка та Литвінієнка [23], цей процес прискорюється в середовищі, що підтримує іонізацію антиоксиданту. Отже, отримані результати можуть свідчити про кращу іонізацію BHT у пропанолі-1, ніж у метанолі. Проте це припущення може викликати деякі сумніви. Багато значень рКа для фенольних сполук у спиртових розчинах зустрічаються в літературі [24]. Хоча деякі з них вказують на зростаючу іонізацію фенолів при зміні їх розчинника з метанолу на пропанол, більшість із них демонструють протилежну залежність. Отже, спостерігається збільшення ABTS •+/Швидкість реакції BHT в результаті заміни метанолу пропанолом важко пояснити збільшенням іонізації BHT.
Вплив алкогольного типу на ABTS •+/Кінетика реакцій BHT може бути пов'язана зі структурними відмінностями сипучих спиртів. Насипні спирти складаються з воднево-зв’язаних скупчень [25, 26], які залишаються в термодинамічній рівновазі. За даними Боровського та ін. [25], основний обсяг метанолу здебільшого складається з гепта-, гекса-, пента-, тетра- та тримерних кластерних структур. Мономерні молекули метанолу складають лише незначну частку основного спирту. Кількість виділених молекул спирту також має низький вміст етанолу, але решта спирту складається переважно з пентамерних скупчень при кімнатній температурі. Не можна виключати, що різні кластерні структури використовуваних спиртів виявляють різну здатність до передачі протонів і, отже, відповідають за спостережувані відмінності в кінетиці реакції.
Ці відмінності також можуть бути результатом енергії сольватації використовуваних радикалів (ABTS •+ ) в зайнятих спиртах. Ймовірно, що більш полярні та кислотніші молекули метанолу сильно взаємодіють з ABTS • + (особливо з електронними парами, що існують на мостиках = N – N = цих радикалів), інгібуючи перенесення атома електрона та/або водню між антиоксидантом і ці радикали.
Вплив алкогольного типу (метанолу та пропанолу-1) на a відносні зміни концентрації ABTS (вимірювання при 346 нм), і b ABTS •+ зміни концентрації (вимірювання при 744 та 757 нм для метанольного та пропанольного розчину відповідно) протягом 180 хв ABTS •+/Реакція BHT
- Важливість управління вагою при цукровому діабеті 2 типу - Уайлдінг - 2014 - Міжнародний
- Дієта від виразки, який тип труб використовується для обходу печінки
- Що означає ваша група крові для вашого здоров'я Північно-західна медицина
- Розуміння важливості білка для спортсменок
- Розуміння подагри типу артриту - поліклініка