Зміна ІМТ після абляції радіоактивним йодом для хвороби Грейвса
Анотація
Передумови
Ми мали на меті визначити ступінь збільшення маси тіла після лікування, який спостерігається у педіатричних пацієнтів у перший рік після терапії радіоактивним йодом (RAI) при хворобі Грейвса (GD) та її зв’язок із клінічними характеристиками.
Методи
Здійснено ретроспективний огляд діаграми пацієнтів, які отримували терапію РАІ з приводу РД між 1998–2015 рр. Була визначена зміна ІМТ ІМТ (∆BMI SDS) від вихідного рівня до одного року після лікування. Ми також дослідили, чи пов'язані окремі клінічні та/або біохімічні фактори з ваговою траєкторією у цих пацієнтів.
Результати
В аналіз було включено сто п'ятдесят сім пацієнтів у віці 12,7 ± 3 років (80% дівчаток). Середнє значення MIBMI SDS становило 0,70 ± 0,71 (стор
Передумови
Хвороба Грейвса (ГР), що характеризується аутоімунною надмірною стимуляцією щитовидної залози, є найпоширенішою причиною гіпертиреозу у дітей та підлітків [1,2,3,4]. Загальна захворюваність серед педіатричної популяції становить приблизно 1 із 10 000 [5], з найвищою поширеністю серед дівчат-підлітків [2]. Хоча гіперметаболічний стан при ГД зазвичай призводить до втрати ваги, можна спостерігати стабільну вагу або навіть збільшення ваги через збільшення калорійності споживання [5].
Терапевтичні методи лікування ГР включають хірургічне втручання, абляцію радіоактивним йодом (RAI) та протитиреоїдні препарати (АТД). Хірургічне втручання та РАІ вважаються остаточною терапією і призводять до постійного гіпотиреозу. Пацієнти, які отримують остаточну терапію, часто стають гіпотиреозами протягом певного періоду часу, перш ніж буде проведено відповідне заміщення левотироксином та біохімічний еутиреоз. Повідомлялося про збільшення ваги після лікування ГД як у дітей, так і у дорослих. Запропоновані пояснення включають постійне збільшення споживання калорій з дозволом попереднього гіперметаболічного стану [5], повернення до або перебільшення преморбідної ваги [6] або результат гіпотиреозу після лікування [7]. Попередні дослідження, що повідомляли про зміну ваги після лікування ГД у дітей, були зосереджені переважно на пацієнтах, які отримували АТД як терапію першої лінії. Навпаки, зміна ІМТ після лікування РАІ систематично не вивчалося. Невідомо, чи сам спосіб лікування впливає на ступінь збільшення ваги чи існують клінічні чи біохімічні фактори, які можуть модулювати ступінь збільшення ваги у цих пацієнтів [7,8,9].
Таким чином, метою нашого дослідження було дослідити ступінь збільшення ваги у перший рік після терапії RAI для ГР. Ми також прагнули дослідити, чи не пов'язані індивідуальні особливості з різницею у збільшенні ваги серед наших пацієнтів.
Методи
Після етичного огляду та затвердження Протоколу № 1412088318 Комісією з огляду інституцій Університету Індіани було проведено ретроспективний огляд діаграми педіатричних пацієнтів, які отримували РАІ-абляцію для ГР в лікарні Райлі для дітей у період з 1998 по 2015 рік. Усі пацієнти із задокументованим зростом і вагою за чотири місяці до лікування RAI та подальший візит із задокументованим зростом та вагою між 6 та 18 місяцями після дати RAI. Незалежно від того, чи лікувались пацієнти з приводу ГР до оцінки в нашому закладі, на момент РАІ у всіх пацієнтів був гіпертиреоз. Якщо потрібна була друга доза РАІ, дозу, що вела до успішної абляції (тобто другу дозу), використовували як цікавий випадок для визначення зросту та ваги до та після лікування.
Було проведено пошук медичних записів щодо цікавих змінних, які включали вік, стать, статус пубертатного періоду, історію втрати ваги, ДС (синдром Дауна), використання ліків для СДУГ, вживання АТД протягом ≥ одного місяця до РАІ, дату початку заміни левотироксину та дату задокументованого еутиреозу. Вага та збір були зібрані на вихідному рівні (останнє призначення до RAI) та на однорічному контрольному прийомі. ІМТ розраховували за формулою. Пубертатний статус класифікували як до пубертатного (Tanner I), так і пубертатного (Tanner II-V). Еутиреоз вважався ТТГ та вільним Т4 або загальним Т4 у межах референтного діапазону лабораторії, або (у невеликій частині випадків), задокументоване тлумачення лабораторних тестів як „нормальне” первинним ендокринологом.
Усі ІМТ були класифіковані відповідно до стандартів Центрів контролю за хворобами (CDC) як недостатня вага (th-й процентиль), нормальна вага (5--й процентиль), надмірна вага (85-й процентиль) або ожиріння (≥95-й процентиль) [10]. Час до еутиреозу (ТТЕ) розраховували, визначаючи час у тижнях між датою початку заміщення левотироксином і датою задокументованого еутиреозу.
Статистика
Аналізи проводились із використанням статистичного програмного забезпечення SPSS (версія 24; IBM Corp.). Всі цікаві змінні оцінювались на предмет нормальності, щоб визначити доцільність статистичних методів, і виявилось, що вони нормально розподілені. Для опису антропометричних даних та часових інтервалів використовували описову статистику. Тести хі-квадрат та точні тести Фішера використовувались для аналізу відмінностей у розподілі вагового статусу до та після RAI. Для оцінки відмінностей в ІМТ до та після лікування використовували парні t-тести. Непарні t-тести використовувались для аналізу впливу клінічних факторів ризику на збільшення ваги. Лінійна регресія була використана для опису міцності зв'язку між зміною (∆) ІМТ ІМТ з часом та факторами, що сприяють цьому. Рівень значущості становив α = 0,05, при цьому всі р-значення нижче 0,05 вважалися статистично значущими. Результати в тексті виражаються як середнє значення ± SD, а медіани та діапазони також наведені в таблиці 1.
Результати
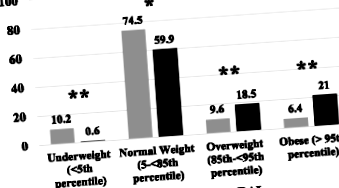
З 247 пацієнтів, які отримували RAI для ГР, 157 (79,6% жінок) мали повні дані та були включені в аналіз. Середній вихідний вік становив 12,7 ± 3,0 року, а середній базовий показник ІМТ - 0,003 ± 1,18 кг/м 2. Десять пацієнтів (6,4%) мали ДС (синдром Дауна), а 33 (21,0%) отримували ІТС до абляції РАІ. З 135 пацієнтів із задокументованим статусом статевого дозрівання 88 (65,2%) були ≥ стадією Таннера на етапі базової оцінки. Дані ІМТ після лікування були отримані через 50,65 ± 11,32 тижні після ІРВ.
Середнє значення SDSBMI SDS із початкового рівня до одного року становило 0,70 ± 0,71 (p Рис. 1
Субаналіз був проведений у 81 пацієнта (85,2% жінок) із свідченнями належної відповідності, у яких була точна ТТЕ. У цій групі ТТЕ становив 24,16 ± 13,28 тижнів, а SDSBMI SDS протягом одного року не відрізнявся від групи в цілому. На відміну від того, що спостерігалося для всієї когорти, історія втрати ваги не мала впливу на ∆BMI SDS протягом 1 року (0,77 ± 0,62 проти 0,55 ± 0,56, p = 0,12), тоді як було встановлено, що у пацієнтів до пубертату SDSBMI SDS був більшим, ніж у пацієнтів пубертатного віку через 1 рік (0,90 ± 0,71 проти 0,57 ± 0,58, p = 0,037). У чоловіків триваліший ТТЕ корелював із більшим збільшенням z-показника ІМТ (R = 0,63, p = 0,029) (рис. 2), тоді як аналогічна, хоча і слабша, асоціація спостерігалася у жінок (R = 0,59, p ≤ 0,001).
Зв'язок SDSBMI SDS з часом до еутиреозу у хлопчиків
Обговорення
Збільшення ваги після лікування ГД добре визнається у дорослих, але на наш відомий досвід було опубліковано лише два попередні дослідження у педіатричних пацієнтів [5, 11]. Ці дослідження включали пацієнтів, які майже виключно лікувались АТД як терапію першої лінії, і не вивчали пильно стільки потенційних факторів, що модифікують. Ми спостерігали SDSBMI SDS 0,70 ± 0,71 протягом першого року в нашій популяції, яка отримувала терапію RAI як остаточне лікування ГР. Одне попереднє дослідження спостерігало за дітьми до 3 років і спостерігало подібне збільшення z-показника ІМТ після лікування з -0,02 ± 1,05 до 0,79 ± 0,81 з подальшою стабілізацією ваги, причому найбільше збільшення ваги спостерігалося протягом перших 6 місяців лікування [ 5]. Друге дослідження, що порівнювало зміни ваги після лікування як гіпотиреозу, так і гіпертиреозу, також повідомляло про збільшення ваги після лікування ГД на початку спостереження, хоча точні часові рамки не були вказані [11].
Не дивно, що історія втрати ваги до РАІ була пов’язана з більшим збільшенням ваги під час подальшого спостереження в нашій популяції, хоча ця взаємозв’язок не була присутньою в субаналізі. Однак у пацієнтів до пубертатного періоду у нашому субаналізі був більший рівень SDSBMI SDS. Це відповідає іншому дослідженню, яке спостерігало більший ріст ІМТ після лікування ГД у дітей до 11 років у порівнянні зі старшими дітьми [5]. Невідомо, чи це взаємозв’язок є наслідком віку чи метаболічних змін, що відбуваються під час статевого дозрівання. Не виявлено жодних інших факторів, які чітко визначали б групи підвищеного ризику набору ваги у нашій популяції. У всіх пацієнтів, які отримують RAI для ГР, слід враховувати високий ризик набору ваги та відповідно консультувати.
Незважаючи на те, що наше дослідження було зосереджено на ефектах терапії RAI, 21% пацієнтів раніше отримували ATD і не мали різниці в SDSBMI SDS протягом одного року порівняно з тими, хто цього не робив. Більшість пацієнтів, які отримували АТД, не були помічені в нашому закладі на початковій стадії ГД, і, отже, їх ІМТ перед лікуванням були недоступні. Однак попередні дослідження показали, що використання послідовних методів лікування у дорослих може призвести до подальшого збільшення ваги порівняно з остаточним лікуванням як підхід першої лінії [8]. Це питання було б цікавим для дослідження і у педіатричних пацієнтів. Якщо це підтверджено, це може бути ще однією причиною відстоювати попереднє остаточне лікування, а не проведення медичної терапії, яка лише рідко призводить до постійної ремісії у дітей та підлітків і несе потенціал для рідкісних, але серйозних побічних ефектів [12].
Хоча ТТЕ негативно корелював з SDSBMI SDS у нашому субаналізі, слабкість цієї асоціації передбачає, що слід враховувати й інші фактори. Хоча деякі дослідження на дорослих демонструють відмінності в результатах ІМТ залежно від способу лікування [8, 9], це не було продемонстровано послідовно, і невідомо, чи можна поширити ці очікування на дітей. Ми виявили подібні результати у нашій популяції порівняно з повідомленнями інших центрів [5].
Наскільки нам відомо, наше дослідження представляє найбільшу когорту педіатричних пацієнтів, у яких досліджується набір ваги після лікування ГД, і єдину, в якій всі пацієнти отримували РАІ. Обмеження включають його ретроспективний характер, а також той факт, що дані, що підтверджують точну ТТЕ, були доступні лише у 81 нашого пацієнта. Додатковою слабкістю є те, що ми не мали інформації щодо ІМТ наших пацієнтів до розвитку ГД. Однак майже 40% наших пацієнтів мали надлишкову вагу або страждали ожирінням на один рік, що вище рівня національних даних ІМТ ІМТ у молоді віком 2–19 років [13].
Висновки
На закінчення ми спостерігали вражаюче і майже універсальне збільшення ІМТ ІМТ через рік після лікування ГРЗ, що призвело до подвоєння кількості надмірної ваги та потроєння кількості пацієнтів із ожирінням, що зробило їх більш високим ризиком несприятливих наслідків для здоров'я в порівнянні з час. Майбутні дослідження повинні бути зосереджені на цілеспрямованих втручаннях, спрямованих на зменшення швидкості збільшення ваги у дітей та підлітків, які проходять лікування ГР.
- Досвід дієт з низьким вмістом йоду при лікуванні диференційованого раку щитовидної залози радіоактивними
- Хронічне гнійне захворювання легенів у дорослих - Метерскі - Журнал торакальної хвороби
- Чи викликає фізична бездіяльність неалкогольну жирову хворобу печінки Journal of Applied Physiology
- Конкуренція у фармацевтичній промисловості Випадок з лікарськими препаратами PAH Міжнародний журнал
- Динамічна зміна вогнищевого збереження жиру при неалкогольній жировій хворобі печінки після лікування