Споживання вуглеводів та неалкогольна жирова хвороба печінки: фруктоза як зброя масового знищення
Метін Басараноглу
Гекчен Басараноглу
Елізабетта Буджанесі
Анотація
Вступ
Найбільш ранньою стадією неалкогольної жирової хвороби печінки (НАЖХП) є стеатоз печінки, який визначається концентрацією печінкових тригліцеридів, що перевищує 55 мг/г печінки (5,5%) (1). НАЖХП може прогресувати до неалкогольного стеатогепатиту (НАСГ), що характеризується ознаками ураження гепатоцитів та запалення печінки з відкладенням колагену. Приблизно у 10-29% пацієнтів з НАСГ розвинеться цироз протягом 10 років (2). NAFLD є незалежним і сильнішим предиктором серцево-судинних захворювань, ніж периферична або вісцеральна жирова маса (3,4). Поширеність НАЖХП становить 15% у пацієнтів, що не страждають ожирінням, але зростає у пацієнтів із ожирінням [індекс маси тіла (ІМТ) = 30,0-39,9 кг/м 2] та надзвичайно ожирінням (ІМТ ≥40,0 кг/м 2) у 65% і 85% відповідно (5).
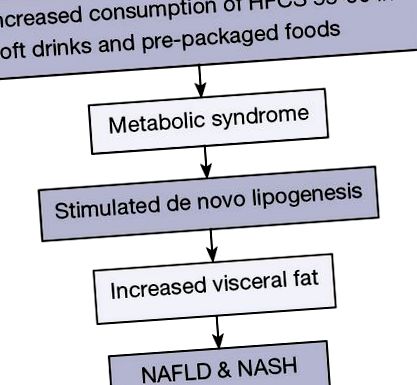
На додаток до генетичної сприйнятливості, фактори навколишнього середовища відіграють важливу роль у розвитку НАЖХП та НАСГ (6-8). Швидке зростання поширеності НАЖХП підтримує роль факторів навколишнього середовища. Повідомлялося, що надмірне споживання кукурудзяного сиропу з високим вмістом фруктози (HFCS) у безалкогольних напоях та упакованих харчових продуктах пов’язане із зростанням поширеності ожиріння та пов’язане з НАЖХП. Проковтнуті вуглеводи є головним стимулом для печінкового ліпогенезу de novo (DNL) і, швидше за все, безпосередньо сприяють НАЖХП, ніж споживання жиру з їжею.
Патофізіологія НАЖХП
Ожиріння асоціюється із хронічним запаленням низького ступеня (9). Це хронічне запалення є зв’язком між ожирінням та резистентністю до інсуліну. Стійкість до інсуліну відіграє центральну роль у патогенезі НАЖХП.
Зазвичай інсулін пов'язує α-субодиниці свого рецептора з адипоцитами та гепатоцитами, що призводить до автофосфорилювання β-субодиниць та активує тирозинкіназу (10). Автофосфорильований рецептор активує субстрат рецептора інсуліну (IRS) -1, IRS-2, гомологічний колаген Src (Shc) та APS [білок-адаптер з гомологією плекстрину (PH) та домен Src homology 2 (SH2)], які активують нижчі компоненти сигнальних шляхів інсуліну. І в скелетних м’язах, і в жировій тканині ці опосередковані інсуліном сигнальні каскади індукують транслокацію транспортерів глюкози (GLUT). IRS-1 був пов'язаний з гомеостазом глюкози, тоді як IRS-2 був пов'язаний з ліпогенезом за допомогою регуляції ліпогенних ферментів стеролу-регуляторного елемента, що зв'язує білок-1c (SREBP-1c) та синтази жирних кислот.
При ожирінні підвищена продукція TNF-α та вільних жирних кислот у плазмі є основними стимулами фосфорилювання Ser 307 IRS-1 (11). Інгібування IRS-1 за рахунок фосфорилювання його залишків Ser 307 також вимагає активації як c-Jun N-кінцевої кінази (JNK), так і інгібітора κB кінази β (IKK-β). І TNF-α, і вільні жирні кислоти індукують активацію JNK та IKK-β. TNF-α стимулює фосфорилювання залишків Ser як IRS-1, так і IRS-2 у гепатоцитах та Ser залишків IRS-1 у м’язах. JNK є однією зі стресових кіназ і відіграє важливу роль у розвитку інсулінорезистентності. Активований JNK індукує фосфорилювання Ser 307 IRS-1, порушує передачу сигналу інсуліну і згодом викликає інсулінорезистентність. Протеїнкіназа С тета (PKCθ) та IKK-β - це дві прозапальні кінази, що беруть участь в передачі сигналів інсуліну, що активуються метаболітами ліпідів. IKK-β фосфорилює інгібітор ядерного фактора каппа B (NF-κB). NF-κB має як апоптотичний, так і антиапоптотичний ефект.
Мітохондрії гепатоцитів є головним місцем β-окислення вільних жирних кислот (12-15). Електрони, вилучені з вільних жирних кислот під час β-окислення, в результаті призводять до синтезу АТФ. Вичерпання запасів енергії (АТФ) збільшує сприйнятливість гепатоцитів до різних травм.
Вуглеводи: глюкоза, фруктоза та ГФУ
Фруктоза є моносахаридом (16,17). Це цукор солодкої на смак, який природно міститься у фруктах та деяких овочах. Фруктоза солодша ніж глюкоза або сахароза. До розвитку всесвітньої цукрової промисловості фруктоза була обмежена в раціоні людини. Мед, фініки, родзинки, патока та інжир містять> 10% цього цукру. Вміст фруктози 5-10% по масі міститься у винограді, сирих яблуках, яблучному соку, хурмі та чорниці.
Сьогодні основними джерелами фруктози в американській дієті є ГФУ (18–20). Промислово HFCS часто містяться в безалкогольних напоях та упакованих продуктах. Найбільш поширеною формою ГФУЗ є ГФУЦ 55, у якій 55% фруктози порівняно з сахарозою, яка становить 50% фруктози. Їжа та напої виготовляються з HFCS 55. Дослідження показало, що деякі популярні газовані напої та інші напої містять вміст фруктози, що наближається до 65% цукру. Більше того, HFCS може мати будь-яку частку фруктози до 90%. Нещодавно повідомлялося, що більше 50% дітей дошкільного віку вживають деякі підсолоджені калоріями напої.
Кілька мета-аналізів показали, що споживання підсолоджуваних цукром напоїв пов'язане з ризиком метаболічного синдрому; підвищений рівень тригліцеридів (TG), стимульований DNL та збільшення вісцерального жиру (20,21) (рис. 1). В іншому дослідженні порівнювали молоко, дієтичну колу, підсолоджену цукром колу та воду. Дослідження показало, що підсолоджений цукром напій збільшував печінку та вісцеральний жир за 6 місяців споживання напою, вживаючи два напої, що містять цукор, 16 унцій на день протягом 6 місяців (22).
Збільшене споживання підсолоджуваних цукром напоїв та розфасованих продуктів харчування пов'язане з ризиком метаболічного синдрому. Кукурудзяний сироп з високим вмістом фруктози (HFCS) стимулює de novo ліпогенез і, нарешті, розвиток неалкогольної жирової хвороби печінки (NAFLD) та неалкогольного стеатогепатиту (NASH).
Фруктоза є посередником у метаболізмі глюкози (17-20). Але він у декількох випадках відрізняється від глюкози. Фруктоза погано всмоктується із шлунково-кишкового тракту за іншим механізмом, ніж механізм глюкози (рис. 2). У більшості клітин лише невелика кількість транспортера глюкози типу-5 (GLUT-5), який транспортує фруктозу в клітини. Глюкоза транспортується в клітини за допомогою GLUT-4, інсулінозалежної транспортної системи. Фруктоза майже повністю очищається печінкою. Печінковий обмін фруктози стимулює ліпогенез. Ці події не залежать від напруги інсуліну та етапу регулювання фосфофруктокінази. Високе споживання фруктози пов’язане зі збільшенням TG у плазмі крові шляхом регулювання печінкової секреції DNL та секреції TG та зниженням кліренсу тригліцеридів ліпопротеїдів дуже низької щільності (VLDL-TG). Фосфорилювання фруктози в печінці споживає АТФ, отже накопичений АДФ служить субстратом для утворення сечової кислоти. Ці події сприяють окисному ураженню печінки та перекисному окисленню ліпідів.
Фруктоза погано всмоктується із шлунково-кишкового тракту транспортером глюкози типу 5 (GLUT-5). Глюкоза транспортується в клітини за допомогою GLUT-4, інсулінозалежної транспортної системи. Фруктоза майже повністю очищається печінкою (циркулююча концентрація становить
0,01 ммоль/л у периферичній крові, порівняно з 5,5 ммоль/л для глюкози). Печінковий метаболізм фруктози індукує de novo ліпогенез. Фосфорилювання фруктози в печінці споживає АТФ, отже накопичений АДФ служить субстратом для утворення сечової кислоти.
Aeberli та ін. провели 4-тижневе рандомізоване перехресне дослідження з 4-тижневим вимиванням між кожною дієтою у дев'яти здорових молодих чоловіків, порівнявши чотири різні безалкогольні напої з рівнями фруктози, глюкози та сахарози, які ближчі до нормального споживання (23). Це рандомізоване порівняльне порівняння чотирьох напоїв з двома рівнями фруктози, глюкози та сахарози (50% фруктози). Дослідники досліджували чутливість до інсуліну печінки та всього тіла методом гіперінсулінемо-евглікемічного затиску. Вони показали, що у порівнянні з напоями з високим вмістом глюкози, напій з низьким вмістом фруктози погіршує чутливість до печінки, але не чутливість до інсуліну всього тіла. Крім того, вони виявили, що рівень холестерину ліпопротеїнів загальної та низької щільності (ЛПНЩ) підвищується фруктозою щодо глюкози. Вільні жирні кислоти також збільшувались у групах фруктозних напоїв. Це дослідження додає інформацію про роль фруктози як із сахарози (звичайного столового цукру), так і із кукурудзяного сиропу з високим вмістом фруктози у ініціації порушення функції печінки та метаболічного синдрому.
Коен і Шалл також повідомили, що сахароза підвищує TG після їжі, але глюкоза не впливає на ліпіди (24).
Фруктоза як основне джерело печінкової DNL при НАЖХП
Збільшення DNL (збільшення гепатоцелюлярних вуглеводів перетворюється на жир) суттєво сприяє збільшенню вмісту печінкових тригліцеридів у НАЖХП (25,26). Останні методи, такі як методологія ізотопів, підхід із множинними стабільними ізотопами та газова хроматографія/мас-спектрометрія, показали, що відносний внесок трьох джерел жирних кислот у накопичений жир у НАЖХП як жирова тканина, ДНЛ та харчові вуглеводи. Двадцять шість відсотків жиру в печінці виникає із DNL та 15% з дієти у пацієнтів із НАЖХП.
Фруктоза може індукувати НАЖХП завдяки своїй здатності діяти як регульований субстрат для ДНЛ та в обхід основної стадії обмеження швидкості гліколізу при фосфофруктокіназі. Безперервний прийом фруктози може спричинити метаболічне навантаження на печінку через індукцію фруктокінази та синтази жирних кислот (27).
Факти підтверджують фруктозу як зброю масового знищення в НАЖХП
Дослідження на тваринах
Прийом фруктози може швидко спричинити жирову печінку у тварин з розвитком стійкості до лептину (28-30). Повідомлялося, що споживання їжі з високим вмістом фруктози знижує концентрацію інсуліну та лептину у плазмі протягом 24 годин, збільшує пост після їжі та не пригнічує циркулюючий грелін (рис. 3). Раніше наша група продемонструвала, що самці мишей C57BL/6, які годували відповідну кількість еквівалента кукурудзяного сиропу з високим вмістом фруктози (питної води, що містить 55% фруктози), протягом 16 тижнів розвивали важкий стеатоз печінки, пов’язаний з некрозапальними змінами (31).
Прийом фруктози може швидко спричинити жирність печінки у тварин шляхом розвитку резистентності до лептину, зниження концентрації інсуліну та лептину в плазмі та не пригнічувати циркулюючий грелін. HFCS, кукурудзяний сироп з високим вмістом фруктози; НАЖХП, неалкогольна жирова хвороба печінки; NASH, неалкогольний стеатогепатит.
Акерман та ін. показали, що щури, яким давали збагачену фруктозою дієту, збільшували печінковий ТГ і кількість холестерину (32).
60% енергії) або гіперкалорійність (+ 30% надлишку енергії) викликає стеатоз та стеатогепатит за ДНЛ; у цьому дослідженні на фруктозу припадає 60-70% жирних кислот (33).
Нагай та ін. продемонстрували, що активований транскрипцією фактор пероксисомного проліфератора гамма-коактиватор-1 бета (PGC-1 β) відіграє вирішальну роль у патогенезі індукованої фруктозою резистентності інсуліну у щурів Спраг-Доулі (34). Армутку та ін. повідомляли, що самці щурів-альбіносів Wistar, забезпечені питною водою, що містить 10% фруктози, протягом 10 днів розвивали макровезикулярний та мікровезикулярний стеатоз без запалення в печінці (35).
Дієта з дуже низьким вмістом вуглеводів спричиняє втрату ваги та посилення окиснення жирних кислот у печінці та міокарді у мишей дикого типу, порівняно з мишами, що підтримуються на стандартних дієтах чау, багатих полісахаридами (37). Недавнє дослідження показало, що миші C57BL/6J протягом 12 тижнів годувались кетогенною дієтою з дуже низьким вмістом вуглеводів, з низьким вмістом білка та з високим вмістом жиру, що призвело до накопичення жиру в печінці, системної непереносимості глюкози, стресового ендоплазматичного ретикулума, стеатозу, пошкодження клітин і накопичення макрофагів (38). Проте тварини залишаються худими, а індуковане інсуліном печінкове фосфорилювання Akt і чутливість всього організму до інсуліну не погіршуються. Кетогенні дієти спровокували схуднення у гризунів. Однак тривале дотримання кетогенної дієти стимулювало розвиток НАФЛД та системної непереносимості глюкози у мишей (37,38).
Людські дослідження
Невеликі поперечні та ретроспективні дослідження на випадок та контроль показали зв'язок між споживанням фруктози цукру та НАЖХП (39-41). Мета-аналіз показав ефект підйому тригліцеридів фруктози (39). Нещодавно опубліковане дослідження на людях досліджувало, чи існує зв'язок між спонтанним споживанням вуглеводів та НАЖХП (41). Вони виявили, що стеатоз печінки пов'язаний із споживанням енергії та вуглеводів. Роль дієтичних вуглеводів було виявлено в межах звичайного споживання вуглеводів: від 32% до 58% калорій.
Систематичний огляд та мета-аналіз контрольованих випробувань годування досліджували вплив фруктози на маркери НАЖХП (42). Вони виявили сім ізокалорійних випробувань, в яких фруктоза обмінювалася ізокалорично на інші вуглеводи, та шість гіперкалорійних випробувань, в яких дієта доповнювалася надлишком енергії (+ 21-35% енергії) з високих доз фруктози (+ 104-220 г/день). Хоча в ізокалорійних дослідженнях ефект фруктози не спостерігався, фруктоза в гіперкалорійних дослідженнях збільшувала як печінкові ліпіди [стандартизовані середні різниці (СМД) = 0,45; 95% довірчий інтервал (ДІ): 0,18-0,72] та аланінамінотрансферази (АЛТ) [середня різниця (МД) = 4,94 Од/л; 95% ДІ: 0,03-9,85]. Вони дійшли висновку, що ізокалорійний обмін фруктози на інші вуглеводи не викликає НАЖХП. Фруктоза забезпечує надлишок енергії та підвищує кількість печінкових ліпідів та АЛТ у сироватці крові. Більше того, це дослідження дійшло висновку, що виявлення відсутності впливу фруктози на маркери NAFLD в ізокалорійних дослідженнях. У цьому мета-аналізі енергія представляла важливий фактор, що впливає на вплив фруктози. Основним обмеженням цього мета-аналізу було те, що для включення було доступно декілька досліджень, і більшість з них були невеликими та короткими (≤4 тижнів).
Раян та співавт. повідомив про post hoc аналіз 52 дорослих з ожирінням, резистентних до інсуліну дорослих за програмою схуднення (43). Ці пацієнти були рандомізовані для прийому дієти з низьким вмістом вуглеводів (40% вуглеводів/40% жиру) або дієти з низьким вмістом жирів (60% вуглеводів/25% жиру) протягом 16 тижнів. Обидві групи втратили значну кількість ваги протягом випробувального періоду. Рівень АЛТ в сироватці крові знизився вдвічі при дієті з низьким вмістом вуглеводів порівняно з дієтою з низьким вмістом жирів. Було також показано, що рівні інсулінорезистентності знижуються в обох групах без істотних відмінностей між ними. Автори дійшли висновку, що дієти з низьким вмістом вуглеводів є більш корисними, ніж дієти з низьким вмістом жиру при зниженні рівня АЛТ. де Луїс та ін. повідомили, що тримісячне втручання гіпокалорійної дієти (або з низьким вмістом жиру, або з низьким вмістом вуглеводів) у пацієнтів із ожирінням покращило біохімічні показники, ІМТ та окружність (44).
Родрігес-Ернандес та ін. продемонстрували вплив дієти з низьким вмістом жиру та вуглеводів на трансамінази печінки (45). У цьому дослідженні взяли участь 54 жінки з ультразвуковим діагнозом НАЖХП і випадковим чином призначили їх дієті з низьким вмістом жиру (25% білка, 10% жиру, 54% вуглеводів) або з низьким вмістом вуглеводів (27% білка, 28% жиру, 45% вуглеводів). строком на 6 місяців. Наприкінці випробування ті, хто сидів на дієті з низьким вмістом вуглеводів, втратили 5,7% ваги свого тіла, а ті, хто входив до групи з низьким вмістом жиру, 5,5%, що є незначним результатом. Рівні ALT та AST знижувались в обох групах без істотної різниці.
В іншому дослідженні Haufe et al. продемонстровано у загальній складності 102 пацієнтів, включаючи чоловіків та жінок, протягом 6 місяців дієтотерапія з низьким вмістом вуглеводів (90 г вуглеводів та 0,8 г білка на кг ваги, 30% жиру) та низьким вмістом жиру (20% жиру, 0,8 г білка на кг, решта вуглеводів) (46). Результати цього дослідження також були подібні до Родрігеса-Ернандеса та ін. результати дослідження (45). Крім того, внутрішньопечінковий вміст жиру також не показав статистичної різниці, 47% знизився у групі з низьким вмістом вуглеводів та 42% знизив вміст жиру в печінці у групі з низьким вмістом жиру.
Севастьянова та ін. продемонстровано 16 суб'єктів (ІМТ = 30,6 ± 1,2) протягом 3 тижнів, індукованих дієтою з високим вмістом вуглеводів (> 1000 Ккал), показали> 10-кратну більшу відносну зміну жиру в печінці (27%), ніж у масі тіла (2%) та збільшення жиру в печінці позитивно корелювали з DNL (47). Крім того, наступна гіпокалорійна дієта протягом 6 місяців призвела до зменшення маси тіла, а також зниження жиру в печінці до норми. Це дослідження припускає, що жирова печінка людини накопичує жир під час перегодовування вуглеводами і підтримує роль DNL у патогенезі НАЖХП.
Показано, що дієти з низьким вмістом вуглеводів сприяють зниженню ваги, зменшенню вмісту внутрішньопечінкових тригліцеридів та поліпшенню метаболічних показників пацієнтів із ожирінням (48). Мета-аналіз досліджував довгострокові (6 і більше місяців) ефекти дієти з низьким вмістом вуглеводів (≤45% енергії з вуглеводів) проти дієти з низьким вмістом жиру (≤30% енергії з жиру) на фактори ризику метаболізму шляхом рандомізації контрольовані випробування (48). Всього 2788 учасників відповідали заздалегідь визначеним критеріям прийнятності (з 1 січня 1966 року по 20 червня 2011 року) і були включені в аналіз. Як дієти з низьким вмістом вуглеводів, так і з низьким вмістом жиру знизили вагу та покращили фактори ризику метаболізму. У порівнянні з учасниками дієт з низьким вмістом жиру, люди, які харчуються з низьким вмістом вуглеводів, зазнали дещо, але статистично значущо нижчого зниження загального холестерину та холестерину ЛПНЩ, але більшого збільшення рівня ліпопротеїдів високої щільності та більшого зниження рівня ТГ.
Абдельмалек та ін. вивчав 341 дорослий пацієнт з НАЖХП (49). Вони оцінили, чи збільшене споживання фруктози корелює лише з розвитком НАЖХП чи сприяє переходу від НАЖХП до НАСГ та більш прогресивним стадіям ураження печінки. Споживання фруктози оцінювалось на основі звітування (частота × кількість) про охолоджувану їжу, фруктових соків та недієтичного споживання соди, виражених як порції на тиждень. Автори виявили, що збільшення споживання фруктози однозначно асоціюється із зменшенням віку (Р 48 років), щоденне споживання фруктози - із збільшенням запалення печінки (P Szczepaniak LS, Nurenberg P, Leonard D та ін. Магнітно-резонансна спектроскопія для вимірювання вмісту тригліцеридів у печінці: поширеність стеатозу печінки серед загальної популяції Am Am Physiol Endocrinol Metab 2005; 288: E462-8. [PubMed] [Google Scholar]
- Аналог куркуміну CUR5–8 покращує неалкогольну жирову хворобу печінки у мишей з високим вмістом жиру
- Фруктоза та цукор Основний посередник неалкогольної жирової хвороби печінки - Фруктоза Факти
- Вплив споживання вуглеводів на рівень етанолу в крові та алкогольне ураження печінки у щурів
- Повна стаття Лікування неалкогольної жирової хвороби печінки від досліджень у дорослих до перспектив в
- Китайські трави від неалкогольної жирної хвороби печінки Журнал рослинних ліків