Вплив добавок магнію та втрати ваги на ферменти печінки у пацієнтів з неалкогольною жировою хворобою печінки
Маджид Карандіш
Науково-дослідний центр з питань харчування та метаболізму, Університет медичних наук ім. Ахваза Джундішапура, Ахваз, Іран
Махтаб Тамімі
1 Відділ харчових наук, Міжнародний відділ Арванда, Університет медичних наук ім. Ахваза Джундішапура, Ахваз, Іран
Алі Акбар Шаєстех
2 Кафедра гастроентерології медичного факультету Університету медичних наук ім. Ахваза Джундішапура, Ахваз, Іран
Мохаммад Хосейн Хагігізаде
3 Відділ біостатики та епідеміології факультету громадського здоров'я Університету медичних наук ім. Ахваза Джундішапура, Ахваз, Іран
Мохаммед Таха Джалалі
4 Дослідницький центр гіперліпідемії, Університет медичних наук Ахваз Джундішапур, Ахваз, Іран
Анотація
Передумови:
Було проведено мало досліджень щодо вивчення впливу добавок магнію (Mg) на ферменти печінки. Метою цього дослідження було оцінити вплив добавок Mg та втрати ваги на ферменти печінки, ліпідний профіль та рівень цукру в крові натще у пацієнтів з неалкогольною жировою хворобою печінки (NAFLD).
Матеріали та методи:
Це дослідження було подвійним сліпим, контрольованим плацебо, рандомізованим клінічним випробуванням. Ультрасонографія використовувалася для діагностики жирової печінки у пацієнтів з аланінамінотрансферазою (АЛТ) ≥ 40 ОД/л та без інших захворювань печінки. Загалом 68 учасників (18-59 років) з НАЖХП були випадковим чином розділені на дві групи, які отримували або добавку Mg (350 мг елементарного Mg на день), або плацебо протягом 90 днів. На початку та в кінці втручання АЛТ у сироватці крові, аспартатамінотрансфераза (AST), лужна фосфатаза (ALP), загальний холестерин (TCHO), холестерин ліпопротеїдів високої щільності (HDL-C), тригліцериди (TG), цукор і сироватка крові інсуліну, а рівні Mg вимірювали натще. Холестерин ліпопротеїдів низької щільності (LDL-C) та резистентність до інсуліну (IR) розраховували, використовуючи формулу Фрідевальда та оцінку моделі гомеостазу на інсулінорезистентність (HOMA-IR), відповідно. Усі учасники отримали рекомендації щодо способу життя, включаючи низькокалорійну дієту та фізичну активність.
Результати:
Значне зменшення в групах втручання та плацебо спостерігали при АЛТ (57,00 (25) до 41,82 ± 19,40 ОД/л, Р = 0,000; 68,50 ± 26,96 до 40,17 ± 19,40 ОД/Л, Р = 0,000 у групах Mg та плацебо відповідно ). Подібне значне зниження спостерігалось у рівнях АСТ та інсуліну натщесерце натще в межах досліджуваних груп. Зниження ваги також було значним в обох групах (від 91,05 ± 13,77 до 87,60 ± 14,37 кг та від 94,59 ± 16,85 до 91,45 ± 16,39 кг у групах Mg та плацебо відповідно). LDL-C та TCHO значно зменшувались у групі плацебо, але не в групі втручання. Mg в сироватці крові суттєво збільшився в групі втручання. Статистично значущих відмінностей між двома досліджуваними групами на початковому рівні та після втручання не спостерігалось.
Висновок:
Згідно з результатами цього дослідження, добавка Mg не впливає на ферменти печінки, але втрата ваги може мати важливу роль у поліпшенні жирової хвороби печінки.
ВСТУП
Безалкогольна жирова хвороба печінки (НАЖХП) визначається як спектр розладів, що характеризуються переважно макровезикулярним стеатозом печінки. Клінічна значимість НАЖХП виникає з того факту, що у значної частини цих пацієнтів (20-30%) розвивається неалкогольний стеатогепатит (НАСГ), і цей стан, на відміну від простої жирової печінки, є потенційно прогресуючим розладом печінки, що може призвести до термінальна стадія печінки та гепатоцелюлярна карцинома. [1] Хоча точний механізм розвитку NASH невідомий, останні дослідження показали, що у пацієнтів з NASH спостерігається більша поширеність інсулінорезистентності. [2,3] Ожиріння також сильно пов'язане зі стеатозом печінки. [3] Крім того, деякі дослідження повідомляють про взаємозв'язок між зниженим рівнем магнію (Mg) у сироватці крові та НАСГ. [4]
Mg є кофактором для більш ніж 300 метаболічних реакцій в організмі. [5] Mg відіграє важливу роль у загальних функціях клітин, включаючи синтез ДНК та білків, метаболізм глюкози та жирів та окисне фосфорилювання. [6] Дефіцит Mg пов’язаний із запуском запальної реакції, дисфункцією мітохондрій, профіброгенною реакцією та зниженням активності антиоксидантної системи; який стимулює перекисне окислення ліпідів та індукцію цитокінів, а також добре відомі шляхи розвитку стеатогепатиту та фіброзу печінки. [7]
У кількох дослідженнях повідомлялося, що добавки Mg пов’язані з поліпшенням запальних факторів, [7] метаболізму глюкози та резистентності до інсуліну. Таких зв'язків не було показано в інших дослідженнях. [8,9,10,11] Переваги добавок Mg у пацієнтів з НАЖХП не встановлені. Отже, вплив добавок Mg та втрати ваги на сироваткові ферменти печінки, ліпідний профіль та резистентність до інсуліну досліджували у цьому подвійному сліпому, плацебо-контрольованому, рандомізованому дослідженні.
МАТЕРІАЛИ ТА МЕТОДИ
Учасники
Це дослідження було подвійним сліпим, контрольованим плацебо, рандомізованим клінічним випробуванням. Учасників завербували з міста Ахваз, розташованого на південному заході Ірану. Письмова інформована згода була отримана від усіх пацієнтів. Критеріями включення були: Вік між 18-59 роками, порушення функції печінки з аланінамінотрансферазою (АЛТ) ≥40 ОД/л та жирова печінка, діагностована за допомогою УЗД. Критеріями виключення були: хронічна діарея, прийом алкоголю (що дорівнює або перевищує 30 г/добу), споживання діуретиків або попередньої пероральної добавки Mg, хвороба печінки, гемохроматоз, хвороба Вільсона, цироз, анамнез будь-якої іншої печінкової, ниркової або легеневі розлади.
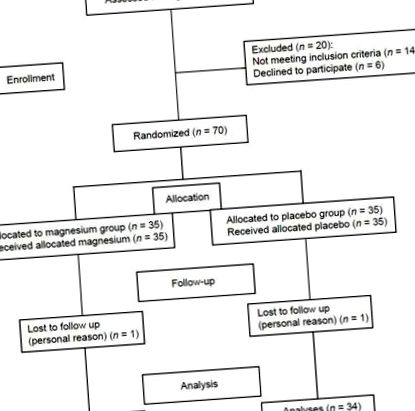
Блок-схема набору для подвійного сліпого, плацебо-контрольованого, рандомізованого контрольованого дослідження прийому Mg при НАЖХП
Сімдесят пацієнтів з НАЖХП були випадковим чином розділені на дві групи: група втручання (n = 35) отримувала 350 мг елементарного Mg на день у формі оксиду магнію протягом 90 днів, а контрольна група (n = 35) отримувала плацебо (лактоза ). Капсули добавки та плацебо виглядали однаково і були спеціально підготовлені для цього дослідження компанією Darou-Pakhsh (Тегеран, Іран) та зберігались при 20-25 ° C. Ця доза Mg була обрана відповідно до допустимих верхніх рівнів споживання (UL) Mg та звіту Еріберто Родрігес-Ернандеса щодо впливу добавок Mg на АЛТ. [7]
Дієтичні звички, демографічні та антропометричні дані були отримані шляхом особистого інтерв’ю чи вимірювання.
Щоденне споживання поживних речовин, включаючи енергію та Mg, було оцінено трьома 24-годинними дієтичними відкликаннями протягом першого місяця дослідження кваліфікованим дієтологом. Дієтичні дані були проаналізовані програмним забезпеченням Nutritionist IV. Фізичну активність оцінювали за допомогою опитувальника загальної практики фізичної активності (GPPAQ) на початку. [12]
Була розрахована низькокалорійна дієта, і учасникам було запропоновано підпадати під цю дієту. Потреба в енергії була розрахована за формулою Всесвітньої організації охорони здоров’я (ВООЗ), а потім знижена до 500 ккал/день (≥ 55% вуглеводів, 15-20% білків і ≤30% жиру). Всім учасникам рекомендували виконувати щонайменше 30 хв фізичних навантажень на день. Відповідність та втручання у спосіб життя оцінювали кожні 2 тижні за телефонним контактом. Залишилися капсули були отримані в кінці дослідження для розрахунку рівня відповідності.
Вимірювання
Біохімічні змінні вимірювали на початковому рівні та в кінці дослідження.
Зростання та вага вимірювались за допомогою стандартних протоколів із учасниками у легкому одязі та без взуття. Індекс маси тіла (ІМТ) розраховували як вагу (кг), поділену на зріст у квадраті (м 2), а відсоток жиру в організмі оцінювали за допомогою монітора жиру в організмі Omron (HBF-306) на початку та в кінці дослідження. Зразки крові відбирали через 12-14 годин нічного голодування на вихідному рівні та після періоду втручання. Зразки сироватки переносили в мікропробірки і зберігали при -70 ° C до аналізу. АЛАТ та аспартатамінотрансферазу (АСТ) визначали методом, розробленим Міжнародною федерацією клінічної хімії (IFCC) [13,14] Лужну фосфатазу (ALP) визначали Deutschen Gesellschaft für Klinische Chemie (DGKC); [15] загальний рівень холестерину (TCHO), холестерин ліпопротеїнів високої щільності (HDL-C), тригліцериди (TG) та Mg сироватки крові вимірювали ферментативним колориметричним методом. Цукор крові натще (FBS) вимірювали колориметричним методом. Холестерин ліпопротеїнів низької щільності (LDL-C) розраховували за формулою Фрідевальда. [16] Концентрацію інсуліну визначали імуноферментним методом, а чутливість до інсуліну оцінювали за допомогою модельної оцінки гомеостазу інсулінорезистентності (HOMA-IR) за такою формулою: Інсулін натще (мкМЕ/мл) × глікемія натще (мг/дл)/405. [17]
Статистичний аналіз
РЕЗУЛЬТАТИ
Загалом 68 учасників завершили судовий розгляд. Два учасники були втрачені для подальшого спостереження (по 1 пацієнту з кожної групи). Через особисті причини вони не любили продовжувати свою участь. Рівна кількість втрачених для подальшого спостереження у досліджуваних групах зробила групи порівнянними щодо цієї змінної. Учасники не повідомляли про побічні та побічні ефекти. Рівень відповідності становив 85,2 та 84% у групах, що вживали Mg та плацебо, відповідно. На початковому етапі не було суттєвих відмінностей у демографічних характеристиках та поживному стані між групами втручання та плацебо [Таблиця 1]. Середній вік учасників становив 36 ± 7 років. Шістьом учасникам із добавок та двом учасникам із груп плацебо призначали по одній таблетці метформіну (500 мг) на день під час дослідження. Однак статистично значущої різниці між групами щодо прийому цього препарату не було (Р = 0,25). Середнє значення ± SD загального споживання Mg, включаючи добавку, становило 553,83 ± 54,38 та 188,25 ± 70,16 відповідно у групах добавок та плацебо.
Таблиця 1
Вихідні демографічні та харчові дані 68 пацієнтів з НАЖХП
Антропометричні та біохімічні характеристики 68 пацієнтів на початковому рівні та наприкінці дослідження наведені в таблиці Таблиця 2 2 та 3, 3 відповідно. На початковому рівні між двома групами не було значущих відмінностей у всіх вимірюваних змінних. Після втручання вага та ІМТ (P = 0,004 та P = 0,000 у групах Mg та плацебо відповідно), відсоток жиру в організмі, інсуліну та резистентності до інсуліну (IR), ALT (P = 0,000 в обох групах) та AST значно зменшились у групи втручання та плацебо. На кінець періоду втручання рівень АЛТ у сироватці крові становив нижче 40 Од/л у Mg (n = 19) та групах плацебо (n = 22) відповідно. FBS і TG знизилися в обох групах, але не суттєво (Р> 0,05). Незначне збільшення ХС ЛПВЩ спостерігалося в обох групах. З іншого боку, TCHO та LDL-C суттєво знизились у групі плацебо, але не в групі втручання. ALP зменшився у групі плацебо та збільшився у групі втручання, але не суттєво. Наприкінці дослідження не спостерігали статистично значущих відмінностей між групами втручання та плацебо.
Таблиця 2
Порівняння антропометричних характеристик на вихідному рівні та через 90 днів після втручання у 68 пацієнтів з НАЖХП (середнє значення ± SD)
Таблиця 3
Порівняння біохімічних характеристик на вихідному рівні та через 90 днів після втручання у 68 пацієнтів з НАЖХП
ОБГОВОРЕННЯ
Це дослідження показало, що добавки Mg не впливають на ферменти печінки при НАЖХП. Переваги добавок Mg у пацієнтів з НАЖХП ще не встановлені.
Наскільки нам відомо, на сьогоднішній день опубліковано лише одне контрольне дослідження щодо впливу добавки Mg на рівень АЛТ. [7] Значний вплив добавки Mg на рівень АЛТ у цьому дослідженні суперечив висновкам нашого дослідження. Існує велика різниця між двома дослідженнями. Вони класифікували учасників за гіпомагніємією та використовували дозу Mg, що перевищує допустиму UL (450 мг/добу елементарного Mg). Тривалість цього дослідження становила 4 місяці, що трохи довше, ніж це дослідження. Хоча добавки Mg можуть бути найбільш корисними для осіб з дефіцитом Mg, [7,8,9,21], але в нашому дослідженні учасники були нормомагнезіємічними.
У цьому дослідженні спостерігали значне зниження рівня АЛТ, АСТ, інсуліну та ІР у групах, що втручалися та плацебо, і, як вважають, це результат значного зниження ваги та ІМТ в обох групах. Зниження рівня ALT, AST, TCHO та TG у жінок із ожирінням, які протягом 6 місяців отримували дієту з низьким вмістом вуглеводів (РК) або дієту з низьким вмістом жиру (ЛЖД), Геріберто Родрігес-Ернандес та ін., [23] припустили, що незалежно З точки зору дієти, метаболічні зміни залежать від зменшення ваги. Wang et al., [24] показали, що прості втручання у спосіб життя, що включають зміни дієти та збільшення фізичної активності у дітей із ожирінням із НАЖХП, можуть призвести до значного поліпшення функції печінки та резистентності до інсуліну. Wong et al., [25] припустили, що зниження ваги пов’язане зі зниженням ризику прогресування НАЖХП, і цим пацієнтам слід зазнати модифікації способу життя.
У нашому дослідженні пацієнти груп втручання та плацебо знизили відповідно 3,78 та 3,31% від початкової маси тіла. Ці скорочення відбулися внаслідок модифікації способу життя. Опублікована література показує, що різний ступінь втрати ваги, від 1 до 10%, пов’язаний із поліпшенням ІР та печінкових ферментів. [26,27,28,29,30]
У нашому дослідженні спостерігалося значне зниження рівня TCHO та LDL-C у групі плацебо. Ці результати були несподіваними, і чіткого пояснення цьому немає. Оскільки середнє значення змін не було великим, схоже, існувала статистична значущість без будь-якого клінічного значення, а середнє значення рівнів ХС ЛПНЩ і TCHO було нижче 130 мг/дл та 200 мг/дл відповідно в обох групах.
У двох попередніх дослідженнях було показано вплив добавок Mg на ферменти печінки, але ці дослідження проводились на учасниках алкоголізму [31,32], і це не схоже на це дослідження, оскільки, як ми знаємо, патогенез порушених ферментів печінки у алкоголіків відрізняється від NAFLD. Це дослідження є першим рандомізованим клінічним випробуванням, яке досліджувало вплив добавок Mg на НАЖХП.
У цьому дослідженні існувало кілька обмежень: Ультрасонографія використовувалась для визначення жирової тканини печінки, але ми не повторювали її в кінці дослідження. Однак зміни ступеня НАЖХП не були визначеним первинним результатом цього дослідження. Короткотривалість цього дослідження є ще одним обмеженням, тому незрозуміло, що зміни маси тіла, а також рівня печінкових ферментів та рівня інсуліну зберігаються протягом тривалого часу. Іншими обмеженнями цього дослідження є відсутність безпосереднього вимірювання гомеостазу інсуліну, калію та кальцію. Однак було встановлено, що HOMA-IR є корисним методом для визначення чутливості до інсуліну у учасників діабету та недіабету, і його можна надійно використовувати в дослідженнях, що вимірюють лише зразки крові глюкози та інсуліну натще [17,33]. Гомеостаз Mg пов’язаний із статусом кальцію та калію, і його слід оцінювати у поєднанні з цими двома мінералами.
Важливим моментом є те, що результати цього дослідження відносяться до учасників із нормальним рівнем Mg у сироватці крові, і ці результати не можна екстраполювати на пацієнтів з гіпомагніємією.
На закінчення результати цього рандомізованого клінічного випробування показують, що добавки Mg не впливають на рівень ферментів печінки в сироватці крові, ліпідний профіль та контроль глікемії у пацієнтів з нормально-магнієногенною хворобою. Модифікація способу життя, зокрема зменшення ваги, може покращити стан цієї хвороби.
ПОДЯКІ
Джерело даних, використаних у цій роботі, було отримано в магістерській дисертації Махтаба Тамімі, студента Університету медичних наук Ахваза Джундішапура; а фінансову підтримку надав Університет медичних наук ім. Ахваза Джундішапура.
Виноски
Джерело підтримки: Міжнародний відділ Арванда, Університет медичних наук ім. Ахваза Джундішапура, Абадан, Іран, № NRC-9011 Це дослідження було схвалено Комітетом з етики Університету медичних наук ім. номер IRCT201203128753N1)
Конфлікт інтересів: Жоден не задекларований.
- Вплив харчових добавок до білка для пацієнтів із масовим схудненням, що переживають
- Ступінь та вплив втрати ваги у пацієнтів з гострим мієлоїдним лейкозом, які отримують індукцію та
- Втрата ваги та поліпшення фіброзу печінки у єгипетських пацієнтів із хронічним гепатитом С
- Поверніть Хула Хуп для схуднення схуднути рух, тренування, ефект схуднення, тренажерний зал PNG і вектор з
- The; Ефект Сталлоне; Скелястий шлях до схуднення; Джо Де Джорджо