Стеарат магнію, широко використовувана харчова добавка, демонструє відсутність генотоксичного потенціалу in vitro та in vivo
Шеріл А. Гоббс
Програма токсикології, Integrated Laboratory Systems, Inc., поштова скринька 13501, Research Triangle Park, NC 27709, США
Казухіко Сайго
b Дослідницькі лабораторії з безпеки наркотиків, Shin Nippon Biomedical Laboratories, Ltd., 2438 Miyanoura-cho, Kagoshima-City, Kagoshima 891-1394, Японія
Міхоко Коянагі
c Глобальна наукова та регуляторна справа, San-Ei Gen F.F.I., Inc., 1-1-11 Sanwa-cho, Toyonaka, Osaka 561-8588, Японія
Шим-мо Хаясі
c Глобальна наукова та регуляторна справа, San-Ei Gen F.F.I., Inc., 1-1-11 Sanwa-cho, Toyonaka, Osaka 561-8588, Японія
Пов’язані дані
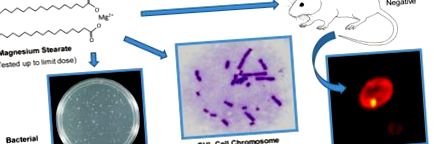
Графічний реферат
Анотація
1. Вступ
Стеарат магнію - це магнієва сіль жирної кислоти, стеаринової кислоти (рис. 1). Протягом багатьох десятиліть він широко використовується в харчовій промисловості як емульгатор, сполучна речовина та загусник, а також як антизлежуючий, мастильний, вивільняючий та протипінний агент. Він присутній у багатьох харчових добавках, кондитерських виробах, жувальній гумці, травах та спеціях та інгредієнтах для випічки. Стеарат магнію також широко використовується як неактивний інгредієнт у виробництві фармацевтичних таблеток, капсул та порошків.
Хімічна структура стеарату магнію. Стеарат магнію, також відомий як октадеканова кислота, існує у вигляді солі, що містить два аніони стеарату і катіон магнію.
Для харчових продуктів стеарат магнію зазвичай виробляється одним із двох процесів. Прямий процес або процес злиття включає пряму реакцію жирних кислот з джерелом магнію, таким як оксид магнію, з утворенням солей магнію жирних кислот. У процесі непрямого або осадження натрієве мило отримують шляхом взаємодії жирних кислот з гідроксидом натрію у воді та осадження продукту шляхом додавання до мила солей магнію. Жирні кислоти, що використовуються в якості сировини, отримують з їстівних жирів та олій і складаються в основному зі стеаринової та пальмітинової кислот. Кінцевий продукт містить 4,0-5,0% магнію на сухій основі, а фракція жирних кислот складається з ≥90% стеаринової та пальмітинової кислот, щонайменше 40% - це стеаринова кислота. Це дуже дрібний порошок, жирний на дотик і практично нерозчинний у воді.
При прийомі всередину стеарат магнію розчиняється в іонах магнію та стеариновій та пальмітиновій кислотах. Магній всмоктується в основному в тонкому кишечнику і, в меншій мірі, в товстій кишці. Магній є важливим мінералом, слугуючи кофактором сотень ферментативних реакцій і важливий для синтезу вуглеводів, ліпідів, нуклеїнових кислот і білків, а також нервово-м'язової та серцево-судинної функцій [1], [2]. Більшість вмісту магнію в організмі зберігається в кістках і м’язах [1], [3]. Невелика кількість (~ 1%) присутня в сироватці та інтерстиціальній рідині тіла, переважно у вигляді вільного катіону, тоді як решта зв’язана з білком або існує у вигляді аніонних комплексів [3]. Нирка значною мірою відповідає за гомеостаз магнію та підтримання концентрації в сироватці крові [1], [3]. Виведення відбувається переважно із сечею, але також відбувається з потом та грудним молоком. Стеаринова та пальмітинова кислоти - це продукти метаболізму їстівних олій та жирів, для яких метаболічна доля добре встановлена. Ці жирні кислоти піддаються ß-окисленню з отриманням 2-вуглецевих одиниць, які потрапляють у цикл трикарбонової кислоти, а продукти метаболізму утилізуються та виводяться з організму [4].
2. Матеріал і методи
2.1. Хімікалії
Усі аналізи генотоксичності відповідали GLP; однак аналіз дозових препаратів для концентрації не був санкціонований японським регулюючим органом, який вимагав проведення цих досліджень, і не проводився. Стеарат магнію (99% відносного вмісту стеаринової та пальмітинової кислот; CAS No 557-04-0; San-Ei Gen F.F.I., Inc., Осака, Японія) зберігали при кімнатній температурі. Препарати готували безпосередньо перед використанням, додаючи розчинник до зваженої досліджуваної речовини та розчиняючи ультразвуком; нижчі концентрації готували шляхом серійного розведення. Диметилсульфоксид (DMSO) був придбаний у Sigma-Aldrich Japan K.K. (Шінагава-ку, Японія). 2- (2-фурил) -3- (5-нітро-2-фурил) акриламід (AF-2), 2-аміноантрацен (2AA), натрію карбоксиметилцелюлоза та мітоміцин С (MMC) були придбані у компанії Wako Pure Chemical Industries, Ltd., Осака, Японія. Моногідрат 9-аміноакридину гідрохлориду (9AA) та N-етил-N'-нітро-N-нітрозогуанідин (ENNG) були придбані у Nacalai Tesque, Inc. (Кіото, Японія). Фізіологічний розчин японської фармакопеї був придбаний у фармацевтичної фабрики Otsuka, Inc. (Токусіма, Японія).
2.2. Аналіз зворотних мутацій бактерій
2.3. Аналіз аберації хромосом in vitro
Свіжорозморожені клітини культивували протягом 72 год, потім розводили до 1 × 10 4 клітин/мл; По 5 мл суспензії переносили в кожну з двох 6-сантиметрових пластикових чашок Петрі на обробну групу і культивували протягом 72 годин. Потім з кожної чашки Петрі видаляли 2,5 мл культурального середовища і додавали 0,5 мл суміші S9 (кінцева концентрація 5%) або культуральне середовище для тестів із метаболічною активацією та без неї. Кінцевий об’єм препаратів, стеарату магнію або ММС (кінцева концентрація 20 мкг/мл), доданих до культурального середовища, становив 10%; B [a] P додавали при 0,5% (0,15 мкг/мл кінцевої концентрації). Після культивування протягом 6 год клітини один раз промивали фізіологічним розчином, додавали 5 мл свіжого середовища та культивували протягом додаткових 18 годин. Для безперервного впливу, через 72 год після початку культури, додавали 0,5 мл препарату стеарату магнію, носія або розчину MMC (кінцева концентрація 0,05 мкг/мл) і клітини культивували протягом 24 або 48 годин. Колцемід додавали в кожну чашку Петрі з кінцевою концентрацією 0,1 мкг/мл за 2 год до закінчення періоду культивування.
2.4. Тваринництво
Самець Crj: миші CD-1 (ICR) (Charles River Laboratories Japan, Inc.) на момент лікування мали вік 7 тижнів. Тварин розміщували в алюмінієвих клітках з абсорбуючою підстилкою (White Flakes, Charles River Laboratories Japan, Йокогама, Японія) у спеціальному приміщенні, вільному від патогенів, з 12-годинним світловим/12-годинним темним циклом. Мишам забезпечували опромінений твердим кормам кобальт-60 (CE-2, CLEA Japan, Inc., Токіо, Японія) та воду за бажанням.
2.5. Аналіз мікроядерних еритроцитів in vivo (MN)
Частоту MN-PCE визначали, підраховуючи кількість мікроядер (MN) у 2000 PCE на тварину, використовуючи закодовані зразки та масляну занурювальну лінзу (кінцеве збільшення: 1000 ×). П’ять сотень еритроцитів [PCE + нормохроматичні еритроцити (NCE)] від кожної тварини були оцінені, щоб визначити відсоток PCE у загальних еритроцитах як показник придушення хімічного росту клітин кісткового мозку.
2.6. Статистичний аналіз
Тест хі-квадрат (односторонній, p Таблиця 1. Відповідно до результатів аналізу дальності (Таблиця додаткових даних S1), позитивна мутагенна реакція на стеарат магнію не була отримана ні в одній із п’яти сальмонел або E. coli. Середні значення ревертації для хімічних речовин позитивного контролю, як з метаболічною активацією, так і без неї, були принаймні в 2 рази вище одночасних контролів розчинників. Кількість колоній, що повертаються, у носії та групах позитивного контролю знаходилась у межах діапазон лабораторних історичних даних. Відсутність індукції збільшення колоній, що повертаються, або будь-яка очевидна реакція, що залежить від концентрації, вказує на те, що в тестованих умовах тестування стеарат магнію не є мутагенним в аналізі зворотної мутації бактерій.
Таблиця 1
Результати аналізу бактеріальної зворотної мутації стеарату магнію.
- Побічні ефекти стеарату магнію, використання та багато іншого
- Стеарат магнію Безпечний та ефективний наповнювач - встановлення рекорду прямого огляду харчування
- Чи безпечний стеарат магнію для використання в дієтичних добавках
- Чи шкідливий чи нешкідливий стеарат магнію 6 передбачуваних небезпек
- Стеарат магнію не токсичний, не проблема Дебра; s Натуральний гурман