Розподілені гепатоцити, що експресують теломеразу, заселяють печінку при гомеостазі та травмах
Шенгда Лін
1 Медичний факультет Медичної школи Стенфордського університету, Стенфорд, Каліфорнія 94305
Elisabete M. Nascimento
1 Медичний факультет Медичної школи Стенфордського університету, Стенфорд, Каліфорнія 94305
Чандреш Гаджера
1 Медичний факультет Медичної школи Стенфордського університету, Стенфорд, Каліфорнія 94305
Лу Чень
1 Медичний факультет Медичної школи Стенфордського університету, Стенфорд, Каліфорнія 94305
Патрік Нойхофер
1 Медичний факультет Медичної школи Стенфордського університету, Стенфорд, Каліфорнія 94305
Аліна Гарбузова
1 Медичний факультет Медичної школи Стенфордського університету, Стенфорд, Каліфорнія 94305
Суй Ван
2 Кафедра офтальмології Медичної школи Стенфордського університету, Стенфорд, Каліфорнія, 94305
Стівен Е. Артанді
1 Медичний факультет Медичної школи Стенфордського університету, Стенфорд, Каліфорнія 94305
3 Програма біології раку, Медична школа Стенфордського університету, Стенфорд, Каліфорнія 94305
4 Кафедра біохімії Медичної школи Стенфордського університету, Стенфорд, Каліфорнія, 94305
Пов’язані дані
Вихідні дані для дослідження RNA-seq доступні у сховищі GEO під номерами приєднання> GSE104415.
Анотація
Він патоцити виконує метаболічну діяльність печінки і виявляє функціональну неоднорідність уздовж осі в межах часточки, визначеної від ворітної вени до центральної вени 12. На крайніх кінцях цієї осі перицентральні гепатоцити Axin2 + повторно заселяли печінку під час нормального гомеостазу 13, тоді як перипортальні гепатоцити, позначені експресією Sox9, були неактивними під час гомеостазу, але розширювались із хронічними хімічними пошкодженнями 14. Спостереження, що вказують на те, що проліферуючі гепатоцити розташовані по всій часточці 15, 16, дозволяють припустити додаткові джерела повторного заселення гепатоцитів. Теломераза синтезує повтори теломер і пов'язана з тривалим оновленням у стовбурових клітинах та при раку 17. Інактивуючі мутації зародкових генів у генах теломерази схильні до цирозу у людей 9,10 та у мишей 11, тоді як активаційні мутації в промоторі TERT представляють найбільш повторювані мутації гепатоцелюлярної карциноми 18. З огляду на важливу роль теломерази у захворюваннях печінки та спостереження, що теломераза міститься у відділеннях стовбурових клітин у багатьох тканинах дорослої людини 19-22, ми припустили, що теломераза може експресуватись у клітинах печінки з унікальними властивостями.
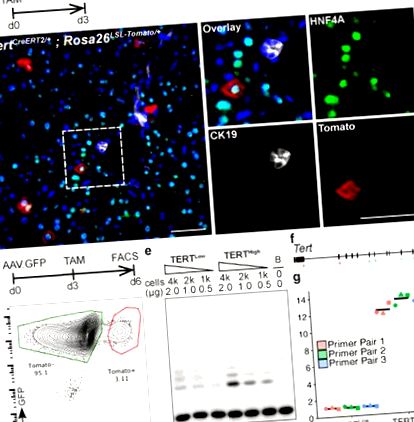
a-b, Аналіз імунофлуоресценції (ІФ) на Tert CreERT2/+; Печінку Rosa26 LSL-Tomato/+ обробляли одноразовою дозою тамоксифену та аналізували через 3 дні після ін’єкції. Показано помідор (червоний), HNF4A (зелений), CK19 (білий) та DAPI (синій). c-g, Аналіз експресії теломерази в сортованих FACS гепатоцитах. Репрезентативна ділянка FACS (d), Аналіз TRAP (e, B: Тільки буфер) та кількісна ПЛР зворотної транскрипції (f, положення пар праймерів) (g, fold-changes.n = 3 миші, кожна з яких позначена унікальними фігурними крапками; поперечка: середнє) показано. Експерименти, повторені тричі для b, більше п'яти разів за d, і двічі за e і g. Ваги, 50 мкм.
a-i, Відстеження лінії в Tert CreERT2/+; Rosa26 LSL-Tomato/+, оброблений однодозовим тамоксифеном (б-г) або масляний транспортний засіб (i) та аналізували за вказаними періодами відстеження за допомогою IF для Tomato. Кількісне визначення площі помідор + гепатоцити (h, n = 4, 5, 4, 4, 7, 5 мишей для кожної точки часу; поперечна смуга: середнє). j-m, Co-IF для Tomato та GS inTert CreERT2/+; Rosa26 LSL-Tomato/+ мікропроцесор протягом 3 днів, 6 місяців або одного року. Кількісна оцінка фракції томатів + GS + гепатоцитів GS + (м, n = 4, 5, 5 мишей для кожної точки часу; поперечини, середнє). ні, Результати RNA-seq на FACS-очищених гепатоцитах TERT High (Tomato +) або TERT Low (Tomato -) (n = 3 миші для кожної групи). Сюжет вулкана для збагачених генів та термінів GO (n,відсікання: q 0,8). Аналіз GSEA для збагачених генних наборів (o, кількість генів, показаних для кожного набору генів). Експерименти повторювали двічі для часових точок у b,f,g,j-l. Шкали шкали, 100 мкм.
Щоб зрозуміти, чим клітини TERT High відрізняються від основних гепатоцитів, ми провели RNA-seq на гепатоцитах TERT High і TERT Low, виділених FACS з трьох Tert CreERT2/+; Миші Rosa26 LSL-Tomato/+ через три дні після лікування тамоксифеном. РНК-послідовності показали 3172 гени, диференційовано експресовані між двома популяціями (q Рис. 2n) (Розширені дані Рис. 3j). Аналіз генетичної онтології (GO) (рис. 2n) та База даних для анотацій, візуалізації та інтегрованого відкриття (DAVID, Розширені дані, рис. 3j) показали, що гени клітинного циклу були підвищеними в популяції TERT High, тоді як рибосомні гени та гени мітохондрій регулювались у ТЕРТі Мало населення. Аналіз збагачення генних наборів (GSEA) виявив підвищену представленість наборів генів, пов’язаних з діленням клітин та активністю тирозинкінази рецепторів у популяції TERT High (рис. 2o, червоний), та зменшення представництва генних наборів, пов’язаних з компонентами рибосом, білками мітохондрій, електроном Гени транспортного ланцюга та метаболічна активність гепатоцитів (рис. 2o, сірий). Проліферація гепатоцитів високого вмісту TERT була підвищена порівняно з гепатоцитами TERT Low (6,4 ± 1,0% проти 0,9 ± 0,1%) завдяки включенню 5-етиніл-2′-дезоксиуридину (EdU) (7-денна питна вода, розширені дані, рис. 6). Разом ці дані свідчать про те, що гепатоцити TERT з високим рівнем менше вкладаються в метаболічні та синтетичні функції об'ємних гепатоцитів і більше присвячені проліферації та гомеостатичному відновленню.
а-ч, 3D-аналіз розріджених мічених гепатоцитарних клонів у Tert CreERT2/+; Миші Rosa26 LSL-Tomato/+, які отримували низькі дози тамоксифену, простежували протягом 3 днів, 3 місяців або 6 місяців. Розміри клонів (б, с) і число клонів на обсяг (d) (n = 5, 3 та 4 миші відповідно; кожна миша представлена унікальним крапковим кольором у c; поперечна смуга: середнє). Co-IF для Tomato і GS для оцінки розташування клону в 6-місячних зразках слідів (е-ч). Кількісне визначення розміру та положення клону щодо клітин GS + (h).i-r, Одномолекулярна РНК РИБА на очищеному FACS ТЕРТ Високий похідний (л-н) і TERT Низький похідний (o-q) гепатоцити. Кількісна оцінка за кількістю вогнищ (р, n = 3 миші на момент часу, кожна миша позначена унікальними крапковими фігурами. Стовпчики та стовпчики помилок мають середнє значення + SEM. Для клітин з> 5 вогнищами, p1місяць-3 дні = 0,56, p1рік-3 дні = 2,7e-5, p1рік-1місяць = 4,3e-5). Експерименти повторювали двічі. Ваги, 50 мкм.
Гепатоцити TERT High можуть генерувати клони або за допомогою механізму самовідновлення, в якому початкова клітина залишається TERT High, а потомство - TERT Low (рис. 3j), або простий механізм розмноження, при якому всі дочірні клітини залишаються TERT High (рис. . 3k). Щоб розрізнити ці механізми, ми дослідили мРНК Tert з одномолекулярною РНК-РИНОЮ на сортованих Tomato + та Tomato - гепатоцитах з різних періодів відстеження (рис. 3i, l-r), а також гепатоцитах дикого типу (Розширені дані рис. 7). Ми виявили, що відсоток клітин Tomato + з високою мРНК Tert (> 5 вогнищ іРНК) був порівнянний через три дні та один місяць (80,3 ± 2,0% проти 75,3 ± 4,8%), але зменшився до 18,0 ± 2,2% через рік . Томатні клітини залишались ТЕРТ низькими, незалежно від періодів відстеження. Наявність рідкісних клітин у цій фракції з високою мРНК Tert, ймовірно, свідчить про неповну рекомбінацію з CreER T2. Ці дослідження показують, що субпопуляція TERT High як самооновлюється для поповнення клітин TERT High, так і диференціюється, отримуючи дочірні клітини TERT Low.
Щоб зрозуміти здатність гепатоцитів TERT High поповнювати клітини, пошкоджені в перицентральній зоні, ми усунули перицентральні гепатоцити шляхом одноразового введення тетрахлориду вуглецю (CCl4) ін’єкцією 25 (Розширені дані, рис. 8c-f). Незважаючи на те, що гепатоцити TERT High зустрічаються рідко в перицентральній зоні GS +, спостерігалося помітне збільшення кількості клітин GS + Tomato + протягом семи днів після пошкодження (рис. 4a-f). Ці дані вказують на те, що травма перицентральних гепатоцитів активує гепатоцити TERT High, що знаходяться поблизу, і що їх потомство набуває нової зональної ідентичності при загоєнні перицентральних ран. Щоб зрозуміти, чи сприяють гепатоцити TERT High регенерації гепатоцитів після глобальної травми, ми кинули виклик печінці дієтою 0,1% 3,5-дієтоксикарбоніл-1,4-дигідроколідину (DDC) (рис. 4g та розширені дані, рис. 8g, h). Ми виявили значне розширення гепатоцитів Томат + після одномісячної DDC-дієти (38,0 ± 3,2% проти 5,6 ± 0,3% у контрольній печінці) (рис. 4g-j). Деякі нащадки клітин TERT High сприйняли протокову долю (Розширені дані, рис. 9), що узгоджується з відомою пластичністю гепатоцитів при пошкодженні DDC 26. Ці висновки показують, що гепатоцити TERT з високим рівнем заселення гепатоцитів прискореними темпами на тлі хімічної травми.
а-ф, Однодозова травма печінки CCl4. Tert CreERT2/+; Миші Rosa26 LSL-Tomato/+, оброблені масляним носієм (b,c) або CCl4 (d,e), проаналізований IF для помідорів та GS на 7 день після обробки. Якщо кількісна оцінка (f); білі лінії, GS + перицентральна зона (n = 5 мишей). g-j, DDC-травма, спричинена дієтою у Tert CreERT2/+; Rosa26 LSL-Tomato/+ миші. ІФ печінки для помідорів після 30-денного лікування звичайною дієтою (h) або дієта DDC (i). Якщо кількісна оцінка (j) (n = 4 миші). k-m, Абляція гепатоцитів TERT High за допомогою ін'єкції AAV.lsl.dtA Tert CreERT2/+; Rosa26 LSL-Tomato/+ миші (n = 4 миші), кількісне визначення клітин Tomato + (м). п-в, Генетична абляція з подальшим пошкодженням DDC у Tert CreERT2/+; Rosa26 LSL-Tomato/+ миші. Печінка, проаналізована Сіріусом Редом на наявність колагену (o-q), SMA для активованих зірчастих клітин (р-т) і клітини CK19 + (u-w) (n = 4 миші). AAV.GFP вводили контрольним тваринам (o, р, т) та AAV.lsl. Тварини, яким вводили DTA (стор, s, uПоперечні смуги: середнє значення. Експерименти повторюються принаймні двічі. Шкали шкали, 100 мкм.
a, Гепатоцити TERT High генерують розширюються клони, що складаються як з гепатоцитів TERT High, так і з TERT Low. b, Рідкісні TERT Високі гепатоцити, розподілені по часточці, утворюють збільшувальні клони під час гомеостазу у відповідь на місцеву втрату гепатоцитів. c, Населення пошкодженої печінки шляхом клонального розширення ТЕРТ Високі гепатоцити прискорюються під час пошкодження. Сині судини, ворітна та центральна вени; судина рожевого кольору, печінкова артерія; дрібні зелені клітини, холангіоцити; великі зелені клітини, перицентральні гепатоцити; еритроцити, ТЕРТ Високі гепатоцити; чорні клітини, пошкоджені гепатоцити.
Методи
Генерація нокаут-лінії Tert CreERT2
Вектор націлювання був сформований шляхом послідовного рекомбінації та клонування шлюзу. Гомологічні плечі (mm10 chr13: 73,621,344 - 73,631,102) клонували з BAC (RP24-342O18) шляхом рекомбінації. Касета 27 з оптимізованим кодоном intron-CreERT2-NeoR була вставлена в ендогенну поступальну стартову ділянку Tert (mm10 chr13: 73,627,032 - 73,627,033) за допомогою рекомбінації. Остаточний вектор націлювання був створений шляхом клонування на шлюз до вектора pWS-TK2 з касетами тимідинкінази на обох кінцях гомологічних рукавів, як описано раніше 28. Цільовий вектор лінеаризували та електропорували в ES-клітини миші JM8/F6. Правильно націлені ES-клони були відібрані за допомогою південних блотів і каріотипів, а потім введені у бластоцисти BALB/c, щоб отримати лінію удару. Миші Tert CreERT2/+ народилися з нормальною менделівською частотою. Щоб перевірити ефективність CreERT2 в ES, на клон Tert CreERT2/+ було націлено модифікований вектор «Rosa26-mTmG», націлений на 29, використовуючи HygroR як ген селекції. Подвійні збиті клітини обробляли 500 нМ 4-гідрокси тамоксифеном (4-OHT) для оцінки ефективності рекомбінації.
Виробництво AAV
Всі AAV, використані в цьому дослідженні, отримували з цис-плазмідами, що містять повний промотор TBG [дві копії елементів підсилювачів α-1-мікроглобуліну/попередника бікуніну (AMBP) з подальшим промотором гена SERPINA7 та міні-інтроном], плазміду для упаковки серотипу AAV8 та допоміжну плазміду аденовірусу. Придбано AAV.GFP (AAV8.TBG.PI.eGFP.WPRE.bGH, номер каталогу: AV-8-PV0146) та AAV.Cre (AAV8.TBG.PI.Cre.rBG, каталог № AV-8-PV1091) від Університету Пенсільванії Vector Core. AAV.lsl.dtA містить сильний зупиночний елемент SV40, клонований із плазміди 30 Lox-Stop-Lox TOPO (адджен Плазміда №11584). AAV.flex.dtA було модифіковано з pAAV-mCherry-flex-dtA 31 (адджен Плазміда № 58536) із наступними змінами: промотор EF-1α замінено промотором TBG, а mCherry замінено EGFP. Клітини HEK293T трансфікували і вирощували в багатошарових колбах Корнінга для отримання вірусів. Віруси очищали градієнтним ультрацентрифугуванням Iodixanol (Sigma-Aldrich) 32 і титрували qPCR 33 та фарбуванням білковим гелем SYPRO Ruby (ThermoFisher) за стандартами.
Тварини
Мишей Tert CreERT2/+ виводили разом з репортером Rosa26 (Gt (ROSA) 26Sortm14 (CAG-tdTomato) Hze/J) 34 для отримання Tert CreERT2/+; Миші Rosa26 LSL-Tomato/+ для аналізу. Двомісячним мишам внутрішньочеревно вводили тамоксифен (Каймон, 1 мг/10 г ваги), розчинений у 100 мкл кунжутного масла (Sigma-Aldrich). Розріджене мічення було досягнуто шляхом ін’єкції тамоксифену при вазі 0,08 мг/10 г. EdU (карбосинт) вводили через питну воду (1 мг/мл) щодня протягом семи днів. AAV розводили до частинок геному 4e11 у 100 мкл нормального фізіологічного розчину (на мишу) та вводили внутрішньовенно. Для пошкодження DDC миші отримували дієту TD.07571 (Harlan), що містить 0,1% DDC (Sigma-Aldrich) ad libitum. Для пошкодження CCl4 мишам вводили рідкий CCl4 (Sigma-Aldrich, 10 мкл/10 г ваги), розчинений у кунжутній олії (Sigma-Aldrich).
Статистика
При порівнянні двох груп значення р визначали за допомогою двостороннього непарного t-критерію. Порівнюючи більше двох груп, значення p визначали одностороннім ANOVA з тестом HSD Тукі, проведеним як пост-хок аналіз. Значимість даних також перевірялася за допомогою непараметричної статистики з використанням двостороннього неспареного тесту Уілкоксона – Манна – Уітні для порівняння двох груп та одностороннього ANOVA Крускала – Уолліса на ранги з тестом Коновера – Імана, проведеного як пост-хоковий аналіз ніж дві групи. Для порівняння закономірностей розподілу неперервних змінних проведено тест Колмогорова-Смірнова. Тварин випадковим чином розподіляли до кожної експериментальної/контрольної групи. Слідчі не були сліпими для розподілу під час експериментів та оцінки результатів. Дані представлені у тексті як “середнє ± SEM”. Графіки були сформовані пакетом ggplot2 35 в R.
Експерименти FACS
Клітини виділяли стандартною двоступеневою перфузією колагенази. Перфузійне середовище печінки (Life Technologies) та відфільтроване (0,22 мкм) середовище для перетравлення печінки (Life Technologies) послідовно перфузували через ворітну вену, згідно з інструкціями виробника. Дисоційовану печінку пропускали через сито 100 мкм для клітин, а гепатоцити збагачували шляхом низькошвидкісного центрифугування (50xg протягом 3 хв) протягом трьох разів у середовищі для промивання гепатоцитів (Life Technologies). Клітини аналізували та/або сортували за допомогою проточного цитометра BD Aria II з використанням сопла 100 мкм. Мертві клітини виключали на основі включення Topro3 (1 мкМ) або DAPI (1 мкМ) (Life Technologies). Для аналізу плоїдності гепатоцити інкубували в Hoechst33342 (15 мкг/мл) і резерпіні (5 мкМ) при 37 градусах протягом 30 хв перед аналізом.
Імунофлуоресценція (ІФ), імуногістохімія (ІГХ), виявлення EdU, одномолекулярна РНК FISH та SiriusRed фарбування
qPCR та RNAseq
Аналіз зображень
Флуоресцентні зображення аналізували Leica LAS AF, ImageJ, Adobe Photoshop та Fluorender. Індекс площі визначався площею печінки, охопленою клітинами Tomato +, як відсоток від загальної площі та кількісно визначався ImageJ. 3D-реконструкцію проводили за допомогою Fluorender. Багатоклітинні клони були зображені у 258 × 258 × 100 мкм 3 томах за допомогою конфокального мікроскопа Leica SP8 або двофотонного мікроскопа Prairie Ultima IV. Клони, що складаються з понад восьми клітин, часто збільшували об'єм зображення, і тому їх зараховували до восьми клітин. Поверхневий плоский вигляд був створений шляхом максимальної проекції перших 12 мкм об’єму близько до поверхні до приблизних результатів фарбування на тонких ділянках. Для спільного імунофарбування з ГС було зображено 580 × 580 × 100 мкм 3 об'єми. Зшиті одноплощинні зображення були оброблені з окремих плиток Adobe Photoshop. Кількість гепатоцитів EdU +, Ki67 +, GS +, CK19 + підраховували вручну.
Аналізи TRAP
Протокол посилення теломерного повторення (TRAP) проводився за попередньо встановленим протоколом 40. Клітини, відсортовані FACS, або гомогенізовану тканину лізували в буфері NP40 (25 мМ HEPES-KOH, 400 мМ NaCl, 1,5 мМ MgCl2, 10% гліцерину, 0,5% NP40 та 1 мМ DTT [рН 7,5], доповнені інгібіторами протеази).
Етична відповідність
Усі протоколи для тварин були схвалені Інституційним комітетом з догляду та використання тварин при Стенфордському університеті. Усі експерименти відповідали відповідним етичним нормам Стенфордського університету.
Наявність коду
Коди можна отримати у відповідного автора за запитом.
Наявність даних
Вихідні дані для дослідження RNA-seq доступні у сховищі GEO під номерами приєднання> GSE104415.
- Центральна роль жирової печінки у патогенезі інсулінорезистентності у діабету підлітків із ожирінням
- Дієтичні зміни для лікування жирної хвороби печінки та неалкогольного стеатогепатиту dLife
- Центр жирових захворювань печінки - Нью-Йорк КолумбіяДокторс Здоров'я дітей
- Жаби; травми або хвороби жаб
- Безалкогольна жирова хвороба печінки, спричинена дієтою швидкого харчування, надає ранній захисний ефект проти