Порівняльне дослідження пошкодження печінки, спричиненого дієтою з дефіцитом метіоніну та холіну з високим вмістом жиру, у мишей ICR із трьох різних джерел
Анотація
Вступ
Безалкогольна жирова хвороба печінки (НАЖХП) - це порушення метаболізму печінки, яке не передбачає вживання алкоголю. Важливо, що з роками рівень ожиріння зріс внаслідок зміни способу життя та харчових звичок, і як наслідок НАЖХП стала поширеною причиною хронічних захворювань печінки у багатьох країнах [1]. NAFLD включає широкий спектр захворювань печінки від простого стеатозу до неалкогольного стеатогепатиту (NASH), фіброзу та цирозу, а зрештою - гепатоцелюлярної карциноми та печінкової недостатності [2]. Простий стеатоз зазвичай не вважається серйозним станом. Однак NASH може перерости в цироз або рак печінки, що з часом може призвести до летального результату [3]. Незважаючи на те, що було проведено багато досліджень, патологічні механізми НАЖХП ще слід з'ясувати, а терапевтичні препарати - розробити. Широкий спектр НАЖХП ускладнює визначення точної стадії захворювання, а характеристики дуже повільно прогресуючих захворювань важко визначити в клінічних дослідженнях [4]. Отже, тваринна модель, яка рекапітулює НАЖХП людини, може надати важливу інформацію для визначення патогенезу захворювання та дослідження терапевтичних ефектів різних препаратів [5].
Тваринні моделі НАЖХП здебільшого класифікуються як генно-інженерні та харчові (дієтичні) моделі відповідно до етіології. Взагалі, дієтична індукція НАЖХП у експериментальних тварин є найкращим методом відтворення таких станів, які спостерігаються у людей, таких як метаболічний синдром, тоді як генно-інженерні тварини використовуються для детальних механістичних досліджень [6]. Оскільки миші ICR мають низький рівень агресивності та сильну здатність до розмноження, їх використовують у всьому світі для дослідження багатьох захворювань у різних галузях, таких як онкологія, інфекції та фармакологія [7].
Матеріали та методи
Тварини та лікування
Восьмитижневих самців мишей ICR отримували з трьох різних джерел. Корл: Мишей ICR люб’язно надав Департамент лабораторних та тваринних ресурсів NIFDS (Чеонджу, Корея). Інші дві групи мишей ICR були придбані у постачальників у США (A: ICR) та Японії (B: ICR). Усі експерименти на тваринах були схвалені Комітетом з експериментів та використання тварин Пусанського національного університету (PNU-2018-1994). Основні умови, такі як навколишнє середовище та дієта, були описані раніше [16]. Мишей акліматизували до температури 22 ± 2 ° C та вологості 55 ± 5% у дієтичній кімнаті з 12-годинним циклом світло/темрява протягом 1 тижня перед використанням. Їх випадковим чином розділили на дві групи, яких годували різними дієтами протягом 6 тижнів: звичайна дієта (контроль) або HFMCD, що складається з 60 ккал% жиру, без додавання холіну та 0,1% метіоніну. Печінка та нирки брали проби через 1 та 6 тижнів.
Біохімічний аналіз крові
Зразки крові отримували з черевної аорти кожної миші; сироватки відокремлювали за допомогою пробірки для збору крові BD Microtainer (BD Life Sciences, Franklin Lakes, NJ, США) і використовували для вимірювання активності аланінамінотрансферази (ALT), аспартатамінотрансферази (AST) та лактатдегідрогенази (LDH). ALT та AST вимірювали за протоколами Рейтмана та Франкеля [17], а LDH - за допомогою комерційного набору, придбаного у Dogen (Сеул, Корея). Результати кількісно визначали за допомогою спектрофотометра з використанням зчитувача Multiskan GO (Thermo Scientific, Waltham, MA, USA).
Гістопатологічний аналіз
Ліву бічну частку печінки зрізали і закріпили 4% параформальдегідом. Тканини вбудовували в парафін, а ділянку 5 мкм фарбували гематоксиліном та еозином (H&E) для розрізнення ядер та цитоплазми.
Очищення РНК та кількісна RT-PCR
Кількісну RT-PCR визначали, як повідомлялося раніше [16]. Загальну РНК виділяли з лізату печінки за допомогою набору РНК Direct-zol (Zymo Research, Orange, CA, USA). кДНК була синтезована за допомогою системи синтезу кДНК iScript (Bio-Rad, Hercules, CA, USA). Кількісну RT-PCR проводили із застосуванням суміші SensiFAST SYBR qPCR (Bioline, Лондон, Великобританія) відповідно до протоколу виробника. Значення експресії генів були нормалізовані до значень GAPDH. Послідовності праймерів наведені в таблиці 1.
Статистичний аналіз
Всі дані були виражені як середнє значення ± стандартне відхилення (SD). Статистичну значимість визначали за допомогою Стьюдента т-тест, і стор
Результати
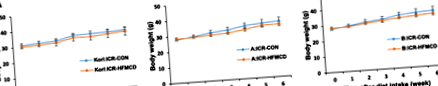
Вплив дієти HFMCD на зміну маси тіла
Дієти з високим вмістом жиру викликають ожиріння та резистентність до інсуліну, але для встановлення НАСГ потрібно 30 тижнів [14]. Дієта MCD часто використовується для індукування НАСГ, викликаючи стеатоз і запалення печінки протягом 4 тижнів, але вона характеризується серйозною втратою ваги [13]. Тому ми намагалися викликати NAFLD/NASH, використовуючи дієту HFMCD. Зміни маси тіла протягом 6 тижнів не показали суттєвих відмінностей між контрольними та мишами, що годували HFMCD (рис. 1).
Вплив HFMCD на зміни маси тіла Korl: ICR (a), A: ICR (b) і B: ICR (c) миші. Мишей ICR годували контрольною (CON) або дієтою з дефіцитом L-метіоніну та холіну (HFMCD), що складалася з 60 ккал% жиру, без додавання холіну та 0,1% метіоніну протягом 6 тижнів. n = 8 на дієту
Вплив дієти HFMCD на зміну відносної ваги печінки та нирок
Щоб вивчити вплив тривалості годування, ми отримали зразки через 1 і 6 тижнів після прийому HFMCD. Відносна вага печінки зростала поступово (рис. 2а) і через 6 тижнів показала приблизно в 2 рази збільшення мишей, яких годували HFMCD, порівняно з контрольними мишами, які годувались дієтою. Відносна вага нирок протягом експерименту залишалася незмінною (рис. 2б). Результати були однаковими у всіх мишей, незалежно від їх походження.
Вплив дієти HFMCD на активність ALT, AST та LDH у сироватці крові
Сироваткова активність АЛТ (рис. 3а), АСТ (рис. 3б) та ЛДГ (рис. 3в), які є показниками пошкодження печінки, була значно підвищена дієтою HFMCD через 1 тиждень і залишалася підвищеною через 6 тижнів.
Вплив дієти HFMCD на гістопатологічні зміни в печінці
Ми досліджували гістопатологічні зміни в печінці, щоб встановити, чи HFMCD індукував прогресування НАЖХП залежно від часу. Через 1 тиждень НАЖХП індукував як мікро-, так і макровезикули, що відображає накопичення ліпідів у печінці; цей ефект був більш серйозним через 6 тижнів (рис. 4). Макровезикули займали більшу частину печінки, а інфільтрація нейтрофілів, яка є запальною реакцією, також спостерігалася в печінці мишей, що годували HFMCD, через 6 тижнів. Ці результати свідчать про те, що HFMCD індукує перехід від стеатозу до NASH у залежний від часу спосіб протягом 6 тижнів. Значимість відмінностей серед мишей різного походження не досліджували.
Вплив дієти HFMCD протягом 1 та 6 тижнів на накопичення ліпідів у печінці мишей із трьох різних джерел. Тканини печінки фарбували H&E
Індукція запальної реакції в печінці дієтою HFMCD
Дієта МХД збільшує секрецію запальних цитокінів і тим самим індукує запалення печінки, що призводить до НАСГ [18]. Для підтвердження індукції запальної реакції HFMCD, запропонованої нейтрофільною інфільтрацією, ми дослідили експресію мРНК TNF-α, IL-6 та IL-1β у печінці. Всі три цитокіни продемонстрували залежність від часу збільшення і були різко індуковані HFMCD через 6 тижнів після (рис. 5). Рівні транскриптів TNF-α (рис. 5a) та IL-6 (рис. 5b) були підвищені приблизно в 15 разів, а рівні IL-1β (рис. 5c) збільшені більш ніж у 20 разів через 6 тижнів після прийом HFMCD.
Експресія маркерів фіброзу в печінці за допомогою дієти HFMCD
Фіброз вважається більш розвиненою стадією НАЖХП, і ми задавались питанням, чи може прийом HFMCD протягом 6 тижнів впливати на фіброгенез печінки у мишей ICR. Рівень мРНК α-SMA та TGFβ1, маркери для активації зірчастих клітин печінки та колаген 1A1 (Col1a1), один із компонентів ECM, були істотно індуковані HFMCD через 6 тижнів після (рис. 6). Рівні транскриптів α-SMA (рис. 6а), TGFβ1 (рис. 6b) та Col1a1 (рис. 6c) були підвищені приблизно у 8, 15 та 3 рази відповідно через 6 тижнів після прийому HFMCD.
Обговорення
НАЖХП стала найпоширенішою причиною хронічних захворювань печінки у всьому світі, оскільки частота ожиріння, діабету та метаболічного синдрому зросла [19]. НАЖХП включає клініко-патологічний спектр жирових захворювань печінки, що виникають за відсутності вживання алкоголю [20]. Початковим симптомом є стеатоз печінки, який вважається відносно доброякісною травмою печінки. Однак, якщо пошкодження печінки погіршується, прогресування до НАСГ стає швидшим, а рівень смертності, пов’язаний із захворюваннями печінки, збільшується [21]. NASH характеризується наявністю стеатозу, запалення та гепатоцелюлярної смерті [22]. З'являється все більше доказів того, що NASH може викликати прогресуючий фіброз, цироз і згодом рак печінки [23].
Дієта MCD давно використовується для вивчення НАЖХП. Тварини, що харчуються МКД, демонструють значне накопичення ліпідів у печінці від 2 до 4 тижнів з подальшим запаленням та прогресуванням фіброзу [24]. Дієта MCD зменшує секрецію ЛПНЩ, збільшує споживання жирних кислот, індукує запальну сигналізацію, викликає стрес ендоплазматичного ретикулуму та викликає перекисне окислення ліпідів [25]. Він має перевагу в тому, що індукує НАЖХП протягом короткого періоду часу, але його недоліком є серйозна втрата ваги, яка не є загальним симптомом у пацієнтів із НАЖХП людини [26]. Тому дієта HFMCD, яка є поєднанням дієти з високим вмістом жиру та МХД, була запропонована для відтворення патологічних симптомів НАЖХП [6]. Важливо, що ця модель дієти імітує захворювання людини, включаючи багато біохімічних та гістопатологічних особливостей прогресування НАЖХП [27]. На сьогоднішній день деякі групи повідомляють про відмінності між штамами інбредних мишей щодо їхньої сприйнятливості до індукованих дієтою НАЖХП та НАСГ [6, 28,29,30,31]. Зокрема, дієта HFMCD індукувала більш важкий фенотип NASH з фіброзом у мишей C57BL/6 порівняно з мишами A/J [6], а тривалий вплив HFD призвів до NASH у мишей C57BL/6 J, але не у A/J миші [31].
Висновки
Це дослідження натякає на те, що модель HFMCD може бути ще одним варіантом подолання недоліків моделі NAFLD, спричинених MCD або дієтою з високим вмістом жиру. Ми також виявили, що відповіді мишей Korl: ICR, створених NIFDS в Кореї, подібні до відповідей мишей ICR з інших джерел, що свідчить про те, що це корисний ресурс для вивчення патогенезу індукованої дієтою НАЖХП.
Наявність даних та матеріалів
Набори даних, використані та/або проаналізовані в цьому дослідженні, доступні у відповідного автора за обґрунтованим запитом.
- Вплив тривалої дієти з високим вмістом жиру на метаболізм жирних кислот у ліпідах крові та печінки щурів у Росії
- Вплив чергування (10 днів) жиру з нормальним харчуванням на інфільтрацію ліпідів у печінці, жир
- Часникова олія пригнічує ожиріння, спричинене дієтами, спричинене ожирінням у щурів за допомогою регуляції UCP-1 та
- Екстракт імбиру може пригнічувати ожиріння, запалення, пропонує дослідження на щурах, які харчуються дієтою з високим вмістом жиру
- Оцінка ефекту відвару трансжиру на мишей із ожирінням, викликаних дієтичним журналом з високим вмістом жиру