Нездатний контроль експресії генів з дестабілізованою Cre
Пов’язані дані
Анотація
Гостра маніпуляція з функцією генів і білків у мозку має важливе значення для розуміння механізмів розвитку нервової системи, пластичності та обробки інформації. Тут ми описуємо методику, засновану на дестабілізованій Cre-рекомбіназі (DD-Cre), активність якої контролюється антибіотиком TMP. Ми показуємо, що DD-Cre викликає швидку TMP-залежну рекомбінацію «флокс» -алелів у нейронах миші in vivo, і підтверджуємо використання цієї системи для нейро-поведінкових досліджень.
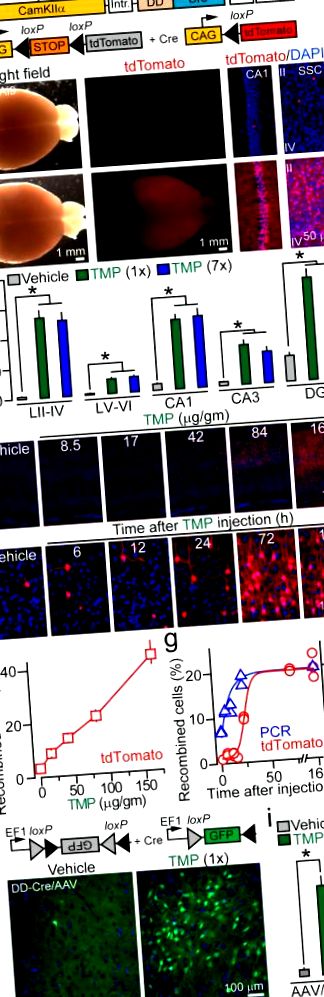
a, Схематичне зображення CamKIIα: алелі-репортери DD-Cre та R26 Ai9 Cre.
b, Зображення цілого мозку та зафарбованих DAPI зрізів, виділених від мутантів DD-Cre/Ai9, що вводяться транспортним засобом та ТМР. SSC = соматочутлива кора (шари II – IV).
Через 24 та 48 годин після введення препарату відповідно (рис. 1д, г). Ця затримка індукції tdTomato не дивна, враховуючи те, що вона вимагає синтезу білка.
Локус Rosa26 має розслаблену структуру хроматину, що полегшує доступ Cre (це також, ймовірно, сприяє спостережуваному фону), тому ми запитали, чи здатна DD-Cre рекомбінувати інші субстрати ДНК. З цією метою ми вводили аденоасоційовані віруси, що кодують «флокс» -репортер GFP (AAV2.5 DIO-GFP), в кору мишей DD-Cre. TMP також в цьому випадку сильно ініціював рекомбінацію, без очевидного збільшення щільності GFP-позитивних нейронів після повторних медикаментозних процедур (рис. 1h, i та додаткова таблиця 1). Ми також виявили, що медикаментозна рекомбінація з мінімальним фоном може бути досягнута шляхом регулювання титрів вірусу (додаткова фіг. 8).
Щоб оцінити придатність DD-Cre для поведінкових досліджень, ми створили штам миші, що несе DD-Cre і Cre-індуковану форму правцевого токсину (TeNT), який інгібує вивільнення нейромедіатора, розщеплюючи везикулярний білок SNARE VAMP/Syb2 (R26 floxstop -TeNT, рис. 2а) 18. Ми обробляли DD-Cre/TeNT та їх контрольних одноліток TMP і досліджували їх мозок імунофарбуванням на TeNT, Syb2 та Zif268/Egr1, продукт безпосереднього раннього гена, транскрипція якого індукується синаптичним збудженням. Тварини, яким вводили наркотики, знизили імунореактивність Zif268/Egr1 та Syb2 (рис. 2b – e). Імуноблотування показало, що починає відбуватися розщеплення Syb2
Через 6 годин після введення препарату, що відображає гостру індукцію TeNT, опосередковану DD-Cre (рис. 2f, g). Електрофізіологічні записи на зрізах мозку підтвердили TMP-залежну втрату збуджуючої синаптичної сили у мишей DD-Cre/TeNT (рис. 2h та додаткова таблиця 2).
a, Схематичне зображення CamKIIα: алелі DD-Cre та R26 floxstop-TeNT.
б – е, Мишам P30 із зазначеними генотипами вводили або носій, або ТМР (170 мкг/г) та аналізували через 7 днів після обробки імунофарбуванням на Zif268/Egr1, TeNT та Syb2. b, Типові зображення корональних відділів мозку демонструють загальну закономірність експресії Zif268/Egr1. c – e, Аналіз імунореактивності Zif268/Egr1 та Syb2 в SSC. Графіки представляють усереднену інтенсивність фарбування Zif268/Egr1 на нейрон (Vehicle versus TMP, P Fig. 3a і Додаткова Рис. 9 і Додаткова Таблиця 3). Однак введення TMP мишам DD-Cre/TeNT скасувало розпізнавання та просторову пам’ять, про що свідчить відсутність інтересу до нових об’єктів, втрата переваги цільовим квадрантам у тесті зонду з лабіринту Барнса та збільшення частоти помилок, допущених під час розвороту тест. На відміну від цього, ці форми пам’яті були інтактними у введених в транспортний засіб DD-Cre/TeNT та TeNT, а також штам TeNT, оброблених TMP. (Рис. 3b, c та Додаткова Рис. 9 та Додаткова Таблиця 3). Цікаво, що всі чотири групи тварин мали нормальну асоціативну пам’ять (дані не наведені). Отже, ні сам ТМП, ні конститутивна активність DD-Cre в мозку мишей DD-Cre/TeNT не впливають на поведінку у відкритому полі та на збір/пошук пам’яті, тоді як індукована блокада нейромедіації заважає конкретним кортикальним та гіпокампальним залежним завданням.
Мишей із зазначеними генотипами тестували на рухливу активність та набуття/пошук пам’яті. Тварин лікували один раз або носієм, або ТМП (170 мкг/г) за 48 годин до початку поведінкових досліджень.
a, Загальну горизонтальну рухливість локомотора оцінювали за допомогою фотоелементних променів протягом 2 годин з інтервалами часу 5 хвилин.
b і c, Тести розпізнавання нових об'єктів та просторової пам'яті. b, Середня кількість контактів, ініційованих кожною групою мишей зі старими (O) та новими (N) об'єктами (O проти N: TeNT + Vehicle, P = 0,035; TeNT + TMP, P = 0,038; DD-Cre/TeNT + Vehicle, P = 0,007; DD-Cre/TeNT + TMP, P = 0,94). c, Середні відсотки часу, проведеного в правильній мішені (T) та інших (O) квадрантах в тесті зонда лабіринту Барнса (DD-Cre/TeNT + TMP проти DD-Cre/TeNT + Vehicle, P = 0,026; DD-Cre/TeNT + TMP проти TeNT + TMP, P = 0,019; DD-Cre/TeNT + TMP проти TeNT + Автомобіль, P = 0,024; DD-Cre/TeNT + Транспортний засіб проти TeNT + TMP, P = 0,9; DD-Cre/TeNT + Vehicle проти TeNT + Автомобіль, P = 0,98; TeNT + TMP проти TeNT + Vehicle, P = 0,92). Всі вимірювання проводили на тваринах P60 (n = 7–9 мишей на групу) і представляли як середнє значення ± S.E.M. Дивіться також Додаткову Рис. 9 та Таблицю 3 для додаткових даних про поведінку.
Швидка кінетика, широкий динамічний діапазон та відсутність виявлених побічних ефектів TMP роблять систему DD-Cre привабливим інструментом для широкого спектра нейрогенетичних застосувань. Тимчасовий контроль DD-Cre in vivo швидший, ніж Cre-ERT2 та tTA/rtTA, які, як правило, вимагають повторюваного впливу індукуючих препаратів 3,7,8,19,20. Сильна дозозалежність DD-Cre від дози TMP також робить його ідеальним інструментом для одночасного збурення та мічення невеликих популяцій клітин для вивчення клітинно-автономних механізмів. Подібно до інших хіміко-генетичних методів, DD-Cre може виявляти конститутивне тло. Хоча наші аналізи не вказують на поведінкові наслідки такого фону у дорослих мишей DD-Cre/TeNT, ми припускаємо, що на клітинному рівні може бути досягнута щільна регуляція in vitro та in vivo, сила промотора, профіль розвитку експресії DD-Cre та чутливість його нижні цілі слід брати до уваги при розробці нових штамів миші.
Якщо розглядати ширше, наші результати дають основу для подальшої розробки тваринних моделей, що несуть дестабілізовані білки в певних тканинах і типах клітин. Наприклад, прикріплення міток DD до факторів транскрипції, мембранних рецепторів та сигнальних молекул може забезпечити широкий контроль над різними функціями білка та полегшити дослідження клітинної диференціації та метаболізму. Крім того, ці мітки можуть бути використані в поєднанні з іншими загальними елементами, такими як FLP та tTA/rtTA (для подвійного фармакологічного контролю). На ефективність DD-P.O.I.s. Можуть впливати швидкість розпаду, набір стабілізованих зв’язаних з лігандом злиття у відповідні субклітинні домени та втручання міток DD у функцію білка. Таким чином, нові системи DD слід завжди перевіряти в культивованих клітинах до проведення експериментів in vivo.
ОНЛАЙН-МЕТОДИ
Переносники векторів Лентивісу та дослідження in vitro
Послідовності, що кодують DD-YFP, DD-Cre, Cre-ERT2, Cherry-H2B, GFP та floxstop-GFP, були субклоновані у вектори-човники лентівірусу, що містять синтетичний нейрональний промотор синапсину. Вектор KD + DD-Syb2 складався з промотору H1, який керував шпилькою, специфічною для миші Syb2 (GTGCAGCCAAGCTCAAGCG), а потім промотору Synapsin та DD-Syb2 рятувальної послідовності кДНК, що містять некодуючі мутації, що виключають втручання РНК. Способи підготовки нейрональних культур, вироблення лентівірусу та зараження, імунофарбування, імуноблотинг та електрофізіологія були описані раніше 17,21 .
Конститутивні CamKIIα: лінія драйвера Cre, репортер R26 Ai9 Cre та алель R26 floxstop-TeNT раніше характеризувались 18,22,23. Для генерування трансгенних штамів CamKIIα: DD-Cre, послідовність, що кодує DD-Cre (додаткова фіг. 2), була вставлена нижче за промотором CamKIIα 8 кб у векторі націлювання, який також включав 5 'і 3' інтрони, фланкуючі кДНК і 3 'SV40 polyA сигнал. Цільова конструкція була лінеаризована і використана для пронуклеарної мікроін’єкції в TSRI Mouse Genetics Core. Позитивні засновники були виявлені за допомогою ПЛР з наступними парами праймерів: GGCAATTGAGATCTACCATGATCTCTCTGATTGCCG CGCCGCTAGCTAATCGCCATCTTCCAGCAG; (Продукт розміром 1,3 кб для DHFR-Cre) та CTCCGTTTGCACTCAGGAGCAC/GCGCGGCGCGCCTCTCCTTTCCAGGATCTCAAAG (продукт, що відповідає 0,9 кб для промотору CamKIIα та ecDHFR). Потім засновників спарювали з мишами, що несли алелі Ai9 або R26 флоксстоп-TeNT (змішаний фон C57/Bl6 та 129/sv), а їх потомство генотипували та використовували для експериментів.
Ін’єкція наркотиків in vivo
Триметоприм (Sigma, T7883) відновлювали в ДМСО при концентрації насичення 100 мг/мл. Цей розчин готували свіжим для кожного експерименту і розводили його в 0,9% фізіологічному розчині безпосередньо перед ін’єкціями. Внутрішньочеревно (внутрішньовенно) ін’єкції проводили за допомогою голки 29 г для доставки доз ТМП в діапазоні від 8 до 170 мкг/г маси тіла. В якості контролю використовували транспортний розчин, що містить фізіологічний розчин і ДМСО. Фармакокінетику TMP досліджували на мишах дикого типу C57/BL6, використовуючи біологічний тест in vitro, заснований на пригніченні росту бактерій. ТМП досягав пікової концентрації в екстрактах мозку 1 мкг/мл через 10 хвилин після одноразового введення (50 мкг/г). Максимальні добові дози ТМП не перевищували 170 мкг/г, щоб уникнути потенційного дистрессу та опадів препарату. Мутантних тварин аналізували в різні моменти часу після лікування наркотиками, як зазначено в легендах на малюнках. Тамоксифен був розтворений у кукурудзяній олії (10 мг/мл) та вводився при 100 мкг/г маси тіла.
Ін’єкція вірусу in vivo
Концентровані лентівіруси виробляли вдома. AAV2.5 DIO-GFP був сформований в ядрі вектора Солка з використанням човникового вектора, що складається з 1,26 kb промотору EF1α та інвертованої послідовності GFP, фланкированої двома парами сайтів loxP. Титри вірусів визначали методом ПЛР. Новонародженим цуценям знеболювали на льоду і вводили 0,5 мкл вірусного матеріалу за допомогою скляної мікропіпетки (діаметр кінчика 10 мкм). Потім цуценят нагрівали протягом 1-2 хв під лампою розжарювання і повертали до домашніх клітин до експериментів.
Імуногістохімія
Мишей знеболювали ізофтороном і перфузували 4% PFA. Мозок інкубували протягом ночі в 0,5% PFA і нарізали в PBS за допомогою вібратома. Зрізи мозку товщиною 90 мкм коротко проварювали в 0,1 М розчині цитрату для отримання антигену і згодом поміщали на 5 хвилин у цитратний буфер (40,5 мл 0,1 М цитрату натрію, 9,5 мл 0,1 М лимонної кислоти, рН 6,0). Потім зрізи промивали в PBS, блокували протягом 3 годин у 4% BSA, 2% кінської сироватки, 0,5% Triton і інкубували протягом ночі з первинними антитілами, розведеними в блокуючому розчині, з подальшим промиванням у PBS та інкубацією з DAPI та/або відповідним флуоресцентним мічені вторинні антитіла.
Антитіла
Моноклональні анти-Syb2 (Cl69.1) та поліклональні анти-Syt1 антитіла були своєрідним подарунком доктора Томаса Зюдгофа. Анти-βтубулін, анти-Zif268/Egr1 та анти-SPO антитіла були придбані у Sigma (Cat # T2200), Cell Signaling Technologies (Cat # 4153S) та Synaptic Systems (Cat # 102-002), відповідно. Всі антитіла використовували у розведенні 1: 1000 для імуноблотингу та імуногістохімії.
Гібридизація in situ
Зонди для транскриптів DD-Cre та tdTomato були синтезовані за допомогою набору маркування РНК Roche, перевіреного електрофорезом та секвенуванням, та позначені або FITC, або DIG. Зрізи мозку готували, як описано вище, і ацетилировали в буфері, що містить триетаноламін та ангідрид оцтової кислоти. Потім зрізи попередньо гібридизували при 65 ° С в буфері, складеному з 50% формаміду, 5X сольового розчину натрію-цитрату, 5X Denhardts, 250 мкг/мл тРНК дріжджів, ДНК сперми 500 мкг/мл, 50 мкг/мл гепарину, 2,5 мМ EDTA, 0,1% Твін-20, 0,25% CHAPS з наступною інкубацією протягом ночі з денатурованими теплою зондами, розведеними в тому ж буфері. Мічені зрізи промивали в 0,2X SSC, врівноважували в 100 мМ трис-HCl рН 7,5, 150 мМ NaCl і блокували 0,5% -ним блокуючим реагентом Перкіна-Елмера в буфері TN. Потім зрізи промивали 0,05% Tween20 з наступною ампліфікацією тираміду (система Perkin-Elmer TSA Plus) та послідовними обробками анти-FITC-POD та FITC-тирамідом. Після загартування активності пероксидази 3% -ним перекисом водню зрізи обробляли анти-DIG-POD (1: 500), промивали і встановлювали для аналізу.
Збір зображень та аналіз даних
Зображення збирали під конфокальним мікроскопом Nikon C2 з використанням 10-кратних, 20-кратних та 60-разових масляних об'єктивів. Цифрові зображення спочатку оброблялися за допомогою програмного пакету Nikon Elements. Цифрові маніпуляції застосовувались однаково до всіх пікселів. Щільності репортер-позитивних нейронів обчислювали автоматично за допомогою програмного забезпечення Metamorph. Тривимірну реконструкцію ГХ, показану на додатковому рис. 7, виконували з пакетом Neurolucida.
Геномну ДНК виділяли з кірок мишей DD-Cre/TeNT в різні моменти часу після ін’єкції TMP та аналізували за допомогою ПЛР з наступними парами праймерів, специфічними для рекомбінованого алеля: CGTGCTGGTTATTGTGCTGTCTCATC/CCTCGGCGCGGTCTTGTAGTTGCC.
Електрофізіологія
Анестезованих мишей обезголовлювали до розчину aCSF, що не містить оксигенованого Ca 2+, у складі 124 мМ NaCl, 2 мМ KCl, 1,25 мМ KH2PO4, 2 мМ MgSO4, 26 мМ NaHCO3, 10 мМ декстрози, pH 7,4. Зрізи мозку 400 мкм готували за допомогою вібратома. Зрізи переносили в aCSF, що містить 2 мМ Ca 2+, і давали можливість відновитись протягом 1 години при 30 ° C до запису. Потенціали збуджуючого поля контролювали з гранульованих клітин DG за допомогою скляного електрода, заповненого 2М NaCl (
3 МОм). Синаптичні відповіді викликав позаклітинний електрод (концентричний біполярний електрод, FHC), розміщений поблизу перфорантного шляху, і реєстрував у присутності 20 мкм габазину. Дані відбирали за допомогою підсилювача Multiclamp700B та аналізували в автономному режимі за допомогою програмних пакетів Clampfit10 та Origin8.
- Зробити контроль ваги другою природою, яка живе тонко, природно
- Lelinta - компресійна безрукавка для жінок із контролем животика Cami Shaper для схуднення
- Генна терапія лептином; може бути краще дієти; для схуднення
- Визначення місця для млинців у вашому раціоні - Рада з контролю за калоріями
- Лейпуриновий хліб для контролю ваги - шрифти, що використовуються