Galleria mellonella Личинки (більшої воскової молі) як модель для тестування чутливості до антибіотиків та випробувань гострої токсичності
Анотація
Передумови
Випробування на інфекційність та тестування токсичності на гризунах є важливими передумовами використання сполук у людини. Однак випробування на щурах та мишах є дорогими, і є етичні міркування. Galleria mellonella Личинки (більшої воскової молі) - потенційна альтернатива. Ми оцінили використання цих комах у випробуваннях на зараженість та тестуванні токсичності.
Висновки
За допомогою чотирьох видів бактерій (двох грамнегативних та двох грампозитивних) ми оцінили ефективність чотирьох антибіотиків проти інфекцій у Galleria та порівняли чутливість антибіотиків до такої у людей. Загалом, ми знаходимо хорошу кореляцію. Подібним чином ми оцінили 11 сполук (спочатку перевірених сліпими) на їх токсичність у Galleria та порівняли це з випробуваннями токсичності на мишах та щурах. Знову ми виявили хорошу кореляцію між токсичністю у Galleria та токсичністю для гризунів.
Висновок
У наших руках ми це знайшли G. mellonella личинки можуть бути використані у випробуваннях на зараженість та тестуванні токсичності, і що ці аналізи представляють недорогу та легко виконувану альтернативу тестуванню на гризунах.
Передумови
6 тижнів) за низькою вартістю та без потреби в спеціалізованому обладнанні; крім того, вони, як правило, не підлягають етичним міркуванням. Личинки Galleria великі, досягаючи 250–300 мм у довжину на п’ятому етапі, достатньо для внутрішньочеревної ін’єкції досліджуваних сполук. Крім того, імунна система комах функціонально та структурно схожа на вроджену імунну систему ссавців [7, 8].
Galleria mellonella личинки вперше були використані для оцінки ефективності антибіотиків проти Acinetobacter baumannii [9]. Цефотаксим, тетрациклін, гентаміцин та меропенем аналізували на системну систему А. baumannii інфекція. Гентаміцин та меропенем, які А. baumannii сприйнятливий до, значно подовжував виживання заражених личинок, тоді як виживання інфікованих, але необроблених личинок та личинок, оброблених цефотаксимом та тетрацикліном, до яких стійкі бактерії, становило менше 25% за 5 днів. Модель швидко зацікавила ряд академічних груп, використовуючи її як стандартну модель тестування. G. mellonella личинки використовувались для дослідження нових патогенів [10] та нових методів лікування стійких патогенів [3].
Метою даної роботи було оцінити ефективність G. mellonella під час випробувань на чутливість до антибіотиків та вивчення того, чи можна їх також регулярно застосовувати в аналізах гострої токсичності. Зокрема, для випробувань ефективності антибіотиків ми хотіли встановити, чи відповідають терапевтичні дози, встановлені у личинок воскової молі, з дозами, рекомендованими для використання людиною, а для тестування токсичності ми хотіли визначити, чи відповідають значення LD50, встановлені для личинок воскової молі, до значень встановлений у гризунів.
Методи
Штами бактерій та середовища
Ми вибрали два грампозитивні та два грамнегативні штами бактерій, які мають клінічне значення для цих досліджень; це були: Кишкова паличка (ATCC 25922), Mycobacterium smegmatis (ATCC 700084), Синьогнійна паличка (ATCC 15692) та Золотистий стафілокок (ATCC 29213), і були отримані з колекції культурних агентств Агентства з охорони здоров’я (Public Health England, Porton Down, UK). Їх культивували із запасів гліцерину та витримували на відповідних середовищах на агарових пластинах [середовище Middlebrook (BD Difco 7H9) для М. смегматис, LB (LMM0202, Formedium) для всіх інших] до зростання в бульйоні LB аеробно при 37 ° C. Культури культивувались як мінімум двічі перед використанням в аналізах.
Сполуки
Ампіцилін, ципрофлоксацин, рифампіцин та тетрациклін для тестування ефективності антибіотиків були отримані від Sigma Chemicals. Для тестування токсичності сполук, що постачаються ТОВ «Інспіраліс», джерелами були: ципрофлоксацин (Fluka), етопозид, новобіоцин, амсакрин, NaCl, тетрациклін, ДМСО, хлорохін, стрептоміцин та АТФ (Sigma), хлорамфенікол (Duchea Biochemie), доксорубімін та глюкоза (Fisher Chemicals) (Таблиця 1). Через проблеми з нерозчинністю амсакрин постачався у кількості 8 мг/мл у 50% ДМСО у воді; доксурубіцин постачали у дозі 5,5 мг/мл у 50% ДМСО у воді. Для випробувань токсичності спочатку всі сполуки подавали у пронумерованих пробірках без назв сполук, щоб уникнути зміщення. Ідентичність сполук було виявлено лише після завершення процедури тестування та даних з G. mellonella було порівняно зі сторінками паспорта безпеки матеріалів (MSDS), доступними зі сполуками.
Вирощування комах
Колонія в G. mellonella було отримано з Центру ентомології Центру Джона Іннеса (спочатку отримано від Livefood UK Ltd.). Колонію тримали в темряві при температурі 37 ° С у великих чашках Петрі (140 мм, стерилін), наповнених штучним кормом. Штучна їжа складалася з 300 мл меду (мед Sainsbury's Honey, Clear), 400 мл гліцерину (G5516, Sigma Chemicals), 200 г сухого молока (сухе знежирене молоко, чудо), 200 г борошна грубого помелу (міцне кам'яне борошно 100% цільнозернового борошна, Sainsbury's), 100 г порошку дріжджів (103753, Merck), 100 г зародків пшениці (натуральні пшеничні зерна Neal's Yard Wholefoods) та 400 г висівок (натуральні пшеничні висівки Neal's Yard Wholefoods Natural Wheat). Спочатку сухі та вологі інгредієнти змішували окремо, а потім суміші поєднували. Дієту змішували з гранулами бджолиного воску у співвідношенні 2: 1. Невикористану їжу зберігали при 4 ° C. Їжу замінювали принаймні раз на тиждень, якщо лише лишилося недостатньо для того, щоб личинки могли харчуватися, і в цьому випадку в контейнери додавали більше їжі.
G. mellonella процедура ін’єкції
П’ять-десять личинок (по 250–320 мг кожна) довільно відбирали для кожного етапу процедури. Будь-які личинки з потемнінням кутикули викидали. Досліджувані сполуки вводили в гемоцель у буфері DMSO або PBS через останню ліву пролегу (шприц Гамільтона 701N, об'єм 10 мкл, розмір голки 26 с, наконечник конуса) [10], якщо не зазначено інше. Личинок розміщували на медичних тканинах (Kimtech), щоб зупинити витікання гемолімфи. Личинок інкубували в темряві протягом 5 днів і щодня реєстрували смертність.
Визначення інфекційної дози бактерій
Інфекційну дозу бактерій визначали, вводячи групам з п’яти личинок бактеріальну суспензію при: 5 × 10 4 колонієутворюючих одиницях (КОЕ) за ін’єкцію, 5 × 10 5 КОЕ, 5 × 10 6 КОЕ і 5 × 10 7 КОЕ. Личинки інкубували протягом 5 днів. Інфекційну дозу визначали як дозу, що викликала імунну відповідь, впізнавану за потемнінням кутикули [10]. В G. mellonella Імунна реакція личинок призводить до утворення меланінових бляшок навколо бактерій, іммобілізованих клітинами імунної системи. Ці бляшки здаються темними через кутикулу. Інфекційною дозою бактерій була така, що спричиняла 60–80% летальність протягом 48 годин, але не 100% летальність протягом 24 годин. Личинок інкубували при температурі 37 ° C, оскільки вірулентність бактерій змінюється з температурою, і експеримент був розроблений для імітації інфекції у людей.
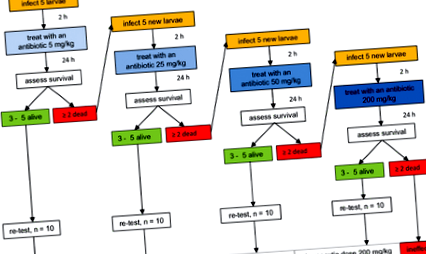
Тестування ефективності антибіотиків
Блок-схема, що представляє послідовні етапи тесту на ефективність антибіотиків. Вводили початкову дозу 5 мг/кг маси тіла та оцінювали комах на виживання. Якщо смертність була менше 40%, сполуці призначали найнижчу терапевтичну дозу. Якщо смертність перевищувала 40%, вищу дозу тестували до встановлення терапевтичної дози
Процедура перевірки токсичності
Блок-схема, що представляє послідовні етапи тесту на гостру токсичність. Вводили початкову дозу 5 мг/кг маси тіла і комах оцінювали за смертністю. Якщо смертність перевищувала 40%, сполуці присвоювався найвищий клас токсичності. Якщо смертність нижче 40%, дозу повторно перевіряли і тестування продовжували до встановлення токсичної дози
Результати і обговорення
Вивчати дизайн
Як випробування ефективності антибіотиків, так і тестування токсичності базувалися на керівних принципах ОЕСР щодо тестування токсичності на мишах та щурах [15]. Настанови адаптовані для використання з G. mellonella оскільки вони є статистично надійним методом і дозволяють спростити робочий процес із чіткими початковими та кінцевими точками.
Ефективність антибіотиків
Спочатку для кожного виду бактерій визначали відповідну інфекційну дозу бактерій. Інфекційною дозою була доза, яка спричинила імунну відповідь, що спостерігалася як потемніння кутикули та 60–80% летальність протягом 48 годин, але не 100% летальність протягом 24 годин. Це було визначено як 5 × 10 6 КОЕ в 10 мкл для Кишкова паличка, М. смегматис і S. aureus, і 5 × 10 4 КОЕ в 10 мкл для P. aeruginosa.
Ефективність чотирьох антибіотиків: ампіциліну, ципрофлоксацину, тетрацикліну та рифампіцину, в G. mellonella личинок оцінювали щодо чотирьох бактеріальних збудників: грампозитивні М. смегматис і S. aureus, та грамнегативний Кишкова паличка і P. aeruginosa. Для кожного штаму бактерій був принаймні один антибіотик, який вказується при лікуванні інфекції, спричиненої цим штамом, і принаймні той, який, як передбачається, не очищає інфекцію, щоб підтвердити, що за антибіотичну дію відповідає не імунітет комах. для відновлення.
Тестування ефективності антибіотиків проводили, як описано в розділі «Методи». Терапевтичну дозу антибіотика визначали, коли антибіотик врятував смертність, спричинену бактеріальною інфекцією. Коли навіть найвища доза антибіотика не очищала інфекцію, антибіотик вважався неефективним проти цих бактерій. Результати зведені в таблиці 2. Є чотири можливі результати тестування на антибіотики: «(1) передбачувана доза антибіотика очищає бактеріальну інфекцію, (2) доза, яка відрізняється від передбачуваної дози, очищає інфекцію, (3) антибіотик прогнозований неефективний неефективний, (4) антибіотик, який прогнозують як неефективний, очищає бактеріальну інфекцію. У більшості випадків антибіотики виконували приблизно так, як передбачали, або лікуючи інфекцію в межах передбаченої дози, або неефективні щодо стійкого штаму.
Ці дослідження ефективності антибіотиків базувалися на існуючій літературі [2]. G. mellonella Личинки раніше використовувались для вивчення бактеріальної вірулентності та сприйнятливості до антибіотиків, і наше дослідження підтвердило, що личинки є підходящим господарем для досліджень ефективності антибіотиків. Крім того, ми визначили, що терапевтична доза антибіотика встановлена в G. mellonella часто відповідає дозам, рекомендованим для використання у людей.
Наші експерименти підтверджують думку, що можна проводити тестування на ефективність антибіотиків G. mellonella а терапевтичні дози, рекомендовані для використання людиною, можна перевести на дози в личинках воскової молі. У більшості випадків точну дозу, рекомендовану для клінічного лікування системної інфекції, можна розрахувати на масу тіла личинки та очистити інфекцію. Така кореляція можлива, оскільки часто механізми мікробної вірулентності не є специфічними для господаря. Там, де прогнози не відповідали результатам, існує безліч потенційних пояснень, напр. відмінності в імунних реакціях у різних організмів і т. д. Попередні дослідження показали, що грибковий збудник Candida albicans використовує той самий репертуар ефекторів, що беруть участь у вірулентності грибів та переході дріжджів до гіфи, проти комах та ссавців [4]. Подібним чином бактеріальний збудник P. aeruginosa використовує подібний набір генів вірулентності для подолання імунної системи личинок воскової молі та мишей [6], і личинки можуть бути використані для виявлення факторів вірулентності, необхідних для зараження ссавців.
Тестування токсичності
11 сполук було надано ТОВ "Інспіраліс" для перевірки їх токсичності в G. mellonella личинки. Спочатку сполуки випробовували сліпо, тобто їх поставляли в пронумерованих пробірках, і лише після завершення процедури випробування цифри пов'язували з назвами сполук. Метою цього підходу було уникнути упередженості, тобто присвоєння менших токсичних доз відомим токсичним сполукам, а вищих - більш безпечним.
Комахам (5–10 личинок) вводили 10 мкл сполуки в крайню задню частину ноги. Внутрішньочеревна ін’єкція застосовувалася в процедурах для суворого контролю кількості токсичної сполуки або бактеріального збудника, якому піддавались личинки. Альтернативні підходи, не застосовувані в цьому дослідженні, використовують процедури годування [16] або контактний вплив [17]. Кількісна оцінка впливу сполуки є менш точною для таких процедур, але іноді є більш доцільним методом, коли відомий шлях впливу. Наприклад, токсичність пестицидів при тестуванні комах, як правило, передбачає дослідження годівлі [18], оскільки це звичайний шлях впливу.
Комахам спочатку вводили низькі дози (5 мг/кг маси тіла) сполук, і смертність реєстрували щодня протягом 5 днів. Якщо смертності не спостерігалось, новим групам личинок вводили сполуки при 50 мг/кг маси тіла, і смертність реєстрували щодня протягом 5 днів знову. Коли спостерігалася смертність у 60% і більше личинок, сполуку повторно тестували при тій самій концентрації для підтвердження токсичності. Коли спостерігалася смертність нижче 60%, сполуки випробовували згодом при 125, 300 та 2000 мг/кг маси тіла. Кожній сполуці було присвоєно значення LD50 (таблиця 3), і значення порівнювали з даними про токсичність, доступними на сторінках MSDS. Жодні сполуки не тестувались понад 2000 мг/кг маси тіла відповідно до вказівок ОЕСР [15]. Такі високі концентрації сполук спричиняють проблеми розчинності, і в рекомендаціях не рекомендується вважати їх непотрібними та неетичними. Як правило, сполуки без ознак токсичності при 2000 мг/кг маси тіла вважаються нетоксичними.
Порівняння випробувань на токсичність у G. mellonella з дослідженнями на гризунах
Є три можливі результати порівняння токсичності для личинок воскової молі та гризунів. По-перше, токсичність може бути однаковою або дуже подібною. По-друге, токсичні дози в G. mellonella може бути вищою, ніж у гризунів, і, нарешті, токсичні дози в G. mellonella може бути нижчою, ніж дози для гризунів. Наше стандартне середовище для ін’єкцій, 50% ДМСО у воді, було смертельним для воскової молі в дозі, еквівалентній 100 мг/кг маси тіла (ін’єкція 4 мкл основного розчину або більше 2 мкл чистого ДМСО на ін’єкцію). Всі сполуки, токсичні понад 100 мг/кг маси тіла, мали бути повторно перевірені у модифікованому середовищі для ін’єкцій із зменшеною кількістю ДМСО (
Висновок
Підсумовуючи, наші експерименти підтверджують думку про те, що ефективність антибіотиків можна перевірити in vivo в Galleria mellonella личинки. Ми встановили, що дози, рекомендовані для використання у людей, можуть бути ефективними при системних інфекціях личинок і що гостра токсичність сполук у личинках воскової молі корелює з токсичністю мишей та щурів. G. mellonella це організм, який можна легко прийняти під час різних тестів. Він не може повністю замінити моделі ссавців, але він набагато дешевший і може забезпечити статистичну стійкість, якої не вистачає сучасним моделям тварин.
- Гліцин відновлює анаболічну реакцію на лейцин в мишачій моделі гострого запалення в Америці
- Збентежуючі нові відповіді у Модель самогубства
- Вплив дієти з високим вмістом жиру на дисбактеріоз мікробіомів кишечника на моделі миші про хворобу війни в Перській затоці
- Чи може Helix ДНК-тестування насправді точно визначити вашу ідеальну дієту та тренування
- Велика долина YMCA