Комплексне омічне профілювання індукованих декстратом натрію сульфатом колітичних мишей, доповнених Wolfberry (Lycium barbarum)
Предмети
Анотація
Ми використовували мультиомічний підхід до профілювання, щоб дослідити супресивний ефект збагачених 2% дієтами, збагаченими Wolfberry (WOL), на колітах, викликаних декстраном натрію сульфатом (DSS), у мишей. Було відмічено, що у мишей, які годувались дієтою WOL, індекс активності захворювання, укорочення товстої кишки, концентрація матриксної металопротеїнази-3 у плазмі крові та відносна маса брижового жиру значно покращились порівняно з групою DSS. Результати профілів транскриптома товстої кишки та протеомів показали, що добавки WOL значно покращують експресію генів та білків, пов'язаних з цілісністю стінки слизової оболонки товстої кишки та запаленням товстої кишки. На підставі даних печінкової транскриптоми, протеомів та метаболомів гени, що беруть участь в метаболізмі жирних кислот, білки, що беруть участь у запаленні, і метаболіти, пов’язані з гліколізом, були знижені у мишей WOL, що призвело до зниження запалення і зміни цих молекул могли призвести до поліпшення маси тіла втрата. Таким чином, інтегрований нутрігеномічний підхід виявив молекулярні механізми, що лежать в основі покращаючого ефекту споживання цілих плодів WOL на запальні захворювання кишечника.
Вступ
Запальна хвороба кишечника (ВЗК) - це група виснажливих запальних розладів, які вражають шлунково-кишковий тракт. IBD включає хворобу Крона (CD) та виразковий коліт (UC). У уражених пацієнтів виникають різні симптоми, пов’язані із запаленням кишечника, починаючи від болю в животі та діареї, закінчуючи ректальною кровотечею та втратою ваги. Лікарі зазвичай рекомендують використовувати протизапальні стероїди або імунодепресанти для зменшення запалення 1. Дієтичні втручання 2 з використанням нутрицевтиків 3, пробіотиків, пребіотиків 2; втручання у спосіб життя, а нещодавно трансплантація мікробіоти калу 4 зазвичай використовується як альтернатива медикаментозній терапії при лікуванні ВЗК 5,6,7 .
Незважаючи на те, що існує багато звітів про компоненти ВОЛ, насправді існує дуже мало досліджень із використанням цілої ВОЛ, хоча її часто вживають цілою в кухні, десертом або настоюють у гарячій воді. У цьому дослідженні ми використовували багатовимірний підхід, заснований на нутрігеноміці, який використовується для визначення впливу цілісних дієтичних сигналів, що впливають на харчування, на стан генів, білків та метаболітів. Ми прагнули визначити дієтичну взаємодію взаємодії WOL у мишей-хазяїв та з’ясувати потенційні молекулярні механізми в DSS-індукованій коліті-моделі миші за допомогою всебічних оцінок транскриптома, протеома та метаболомів не тільки з використанням тканин товстої кишки, а також тканин печінки, що є важливим метаболічна електростанція у господаря.
Результати
Загальна характеристика
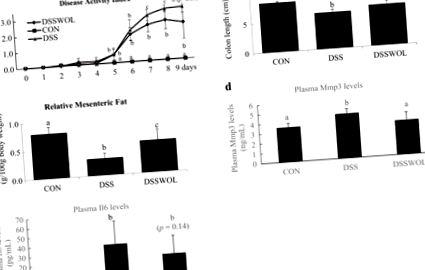
Суттєвих відмінностей у споживанні їжі до DSS не спостерігалося (CON: 27,0 ± 2,3; DSS: 27,7 ± 4,7; DSSWOL: 24,8 ± 2,3 г) або після введення DSS (CON: 40,6 ± 9,9; DSS: 37,1 ± 7,9; DSSWOL: 32,3 ± 2,3 г). Споживання води протягом періоду введення СППР є таким: CON: 26,5 ± 0,6; СППР: 24,2 ± 1,5; DSSWOL: 24,8 ± 1,2 мл. Таким чином, споживання DSS мишами DSS та DSSWOL істотно не відрізнялося. Миші, які зазнали DSS, мали значні патологічні зміни, включаючи сильну втрату маси тіла, наявність прихованої крові в калі та діарею, що призвело до значного збільшення DAI порівняно з групою CON (рис. 1а).
Добавки WOL пригнічували ці патологічні стани IBD, що призводило до зменшення значень DAI з 7 по 9 день (рис. 1а). Миші з групи DSS мали значно меншу довжину товстої кишки (рис. 1b) і меншу вагу брижі (рис. 1c) порівняно з контрольною групою, і WOL значно покращував це зменшення. Рівні Mmp3 у плазмі крові (рис. 1г) були значно підвищені при введенні DSS, і втручання WOL значно пом'якшило це збільшення. Концентрації Il6 у плазмі крові (рис. 1д), як правило, покращуються за допомогою добавок WOL.
Аналіз мікрочипів товстої кишки
РНК-месенджери для 2189 генів диференційовано експресувались у мишей DSS порівняно з контролем. Серед цих генів 271 ген був регульований в DSSWOL, а 207 генів був знижений у порівнянні з DSS (Додаткова таблиця 1). WOL знижував рівень експресії генів тканинного інгібітора металопротеїнази 1 (Timp1) та хемокіни, що належать до ліганду хемокінів (мотив C – C) (Ccl): Ccl1 і Ccl5. Крім того, нижчий рівень експресії прозапального цитокіну рецептора інтерлейкіну 1 типу 1 (Il1r1). Інші регульовані гени, що регулюються, включали виділений фосфопротеїн 1 (Spp1), гаптоглобін (Hp) та простагландин-ендопероксидсинтаза 2 (Ptgs2). Деякі з регульованих генами генів були пов'язані з розпадом позаклітинного матриксу та ремоделювання матриксної металопротеїнази (ММР), тобто., Mmp3, Mmp13 і Mmp10; кластер диференціації (Cd163) і Іл6, були відібрані для перевірки за допомогою RT-PCR в реальному часі. СППР значно регулював вирази Mmp10, Hp, Іл6, Mmp3, і Timp1. Добавки WOL значно пом'якшили це збільшення Hp, Timp1, і Mmp10 і, як правило, покращує це регулювання в Іл6, Cd163, і Mmp3 (Рис.2).
Аналіз мікрочипів печінки
У печінці 12838 генів диференційовано експресувались у DSS порівняно з контролем. У групі DSSWOL 1630 генів були регульованими, а 1793 гени були знижені в порівнянні з мишами DSS (Додаткова таблиця 2). Добавки WOL зменшили експресію генів для молекул ракових маркерів, таких як сироватковий амілоїд А1 (Saa1), c-червня (Черв), і S100, що зв’язує кальцій білок A8 (S100a8). Крім того, гени, що беруть участь у синтезі жирних кислот, тобто стеароїл-КоА десатураза-1 (Scd1), Член родини ELOVL 6, подовження довголанцюгових жирних кислот (Еловль6), синтаза жирних кислот (Фас), і НАДФ-залежний яблучний фермент (Ме1) були надрегульованими. Рівень експресії гена метіонін аденозилтрансферази II, альфа (Mat2a), який бере участь у шляху переробки метіоніну, було зменшено. На основі результатів валідації експресії генів методом RT-PCR у режимі реального часу (рис. 3) DSS суттєво регулював експресію Еловль6, Фас, Черв, Мат2, Ме1, Saa1, Scd1, і S100A8, і добавки WOL суттєво впливали на експресію цих генів - за винятком Черв і Saa1, на які WOL, як правило, справляв супресивний ефект.
Порівняльний аналіз протеоміки печінки та товстої кишки за допомогою iTRAQ
Ми визначили загальну експресію білка в трьох групах, використовуючи технологію маркування iTRAQ кількісною протеомікою. Ми включили 1,2- або 0,8-кратне обмеження кількості унікальних білків, кількісно визначене на рівні> 95% рівня достовірності, коли класифікуємо білки як сильно підвищені або знижені.
У печінці ми ідентифікували 222 білки, з яких 58 білків були знижені та 75 білків були регульованими в DSSWOL порівняно з групою DSS (Додаткова таблиця 3). Добавки WOL знизили рівень білків, які, як відомо, часто регулюються у пацієнтів із ВЗК: кальретикулін (Calr) 33, серотрансферин (Trfe) 34, анексин A5 (Anxa5) 35, бета-енолаза (Enob) 36, транстиретин (Tthy) 37, селен-зв’язуючий білок 1 (Sbp1) 38 і білок-глутамін-гамма-глутамілтрансфераза 2 (Tgm2) 39; білки, які беруть участь у фіброзі: бета-ланцюг фібриногену (Fibb) та гамма-ланцюг фібриногену (Fibg) 40; та пов’язані із запаленням білки: гістон H4 (H4), супероксиддисмутаза [Cu-Zn] (Sodc) 41, цистатин-B (Cytb) 42, білок теплового шоку 10-кДа, мітохондрії (Ch10) 43, тіоредоксин (Thio) 44 та альфа-енолаза (Еноа) 45 .
У товстій кишці ми виявили загалом 2111 білків, з яких 271 був регульований, а 217 був знижений у групі DSSWOL порівняно з групою DSS (Додаткова таблиця 4). Добавки WOL збільшили рівень кількох білків, включаючи фактор трилистя 3 (Tff3), білок, який бере участь у цілісності кишечника та захисті від слизу 46; гомолог білка 2 переднього градієнта (Agr2) 47; пов'язаний із запаленням білок карбоксипептидаза Е (Cbpe) 48; і білок, пов’язаний з відновленням ДНК, 40S рибосомний білок S3 (Rs3) 49,50 .
Порівняно з групою DSS, регульованими білками групи DSSWOL були: негативний модулятор лейкоцитарних запальних реакцій, тирозин-білкова фосфатаза, субстрат 1 нерецепторного типу (Shps1) 51; маркерний білок у хворих на ВЗК, ізоформа S-гіцерин клітинної поверхні глікопротеїну MUC18 (Muc18) 52; білок фактора ризику ВЗК, аполіпопротеїн Е (Apoe) 53; молекула адгезії нервових клітин L1 (L1cam) 54; білок, пов’язаний із запаленням та стійкістю до пошкодження тканин, церулоплазмін (Церу) 55; два білки, що беруть участь у прогресуванні пухлини, анексин a3 (Anxa3) 56,57 та комплемент C3 (Co3) 58; і асоційований з нейтрофілами желатиназа ліпокалін (Ngal) 59 .
Оцінка метаболоми плазми та печінки
Для оцінки метаболічних змін за рахунок споживання WOL ми провели аналіз метаболомів печінки та плазми груп CON, DSS та DSSWOL на основі їх м/з значення та час міграції. Кількість метаболітів, виявлених у тканині печінки та плазмі крові, становила 131 та 117 відповідно. Нормалізовані дані метаболоміки використовувались для ієрархічної кластеризації для подання теплової карти та додатково аналізувались за допомогою аналізу основних компонентів (PCA) за допомогою програмного забезпечення MeV.
Хоча в тепловій карті явних змін між групами не спостерігалось (рис. 4a, b), серед груп CON, DSS та DSSWOL (рис. 4c, d) були сформовані чіткі кластери. Десять метаболітів у печінці (додаткова таблиця 5a) та чотири метаболіти (додаткова таблиця 5b) у плазмі були суттєво регульовані введенням DSS та згодом покращені за допомогою добавок WOL. Ці метаболіти включали метаболіти печінки, що беруть участь у пентозофосфатному шляху, тобто глюкозо-6-фосфатдегідрогеназа (G6P) та фруктоза 6-фосфат (F6P); і в метаболізмі пуринів, тобто аденозинмонофосфат (AMP), інозинмонофосфат (IMP) та гуанозинмонофосфат (GMP). Іншими метаболітами були дві молекули, пов’язані із шляхом переробки метіоніну, глутатіон та S-лактоїлглутатіон, і продукт розпаду колагену, тобто гідроксипролін. Підвищення регуляції 2-гідроксиізобутирату, додеканоату та аргініну спостерігали у профілях метаболомів плазми.
Жодної різниці між трьома групами в тепловій карті не спостерігалося (a, b), але окремі кластери були сформовані серед CON, DSS та DSSWOL при аналізі даних PCA (c, d) як метаболітів плазми, так і печінки.
Обговорення
Ми всебічно вивчили вплив добавок WOL на запалені транскриптоми товстої кишки та печінки та протеоми, а також на метаболомні профілі плазми та печінки. Наші результати показали, що дієтичні добавки WOL можуть полегшити пошкодження та запалення товстої кишки, спричинені DSS, та посилити захист кишкового бар'єру, підтримуючи цілісність слизової, як описано нижче. Наші результати також виявили модульовані метаболічні шляхи та потенційні ключові регуляторні центри генів/білків, які можуть регулювати ці процеси. Наш експериментальний підхід до вигодовування WOL до виклику DSS можна розглядати як подібний до моделей споживання різних харчових продуктів пацієнтами із ВЗК у період коливання активності захворювання 60. Наскільки нам відомо, це безпрецедентний звіт про використання чистої цільної вовни при ВЗК із використанням комплексного підходу до нутрігеноміки, особливо в UC.
Наші дані про експресію гена товстої кишки показали, що втручання WOL пригнічує запалення товстої кишки. Запальні реакції при ВЗК зазвичай починаються з інфільтрації нейтрофілів та макрофагів 61, а потім суміші запальних цитокінів, в т.ч. IL6, IL1 і TNF 62, секретується. Це призводить до утворення протеаз, вільних радикалів та металопротеїназ, які відповідають за вкорочення товстої кишки, деградацію тканин та розвиток уражень 63. У цьому дослідженні глобальна експресія гена товстої кишки та перевірка RT-PCR виявили тенденцію до зниження регуляції Іл6, та фактори, що перебувають нижче за течією, Mmp10 і Hp, були значно зменшені втручанням WOL. Вираз Hp асоціюється із запаленням, також значно зменшується при запальних станах 64. Зниження регуляції білків, пов’язаних із запаленням та пошкодженням тканин (Ceru та Shps1) та генів Hp, Mmp10, Timp1 в нашій групі DSSWOL припускає, що втручання WOL зменшило ступінь запалення в товстій кишці, індуковане DSS.
Вживання ВОЛ зберігало цілісність слизового бар’єру, який є важливим компонентом здорового кишечника, оскільки являє собою першу лінію захисту між вмістом просвіту та тканинами господаря. Пошкоджений слизовий бар’єр забезпечує мікробну взаємодію зі слизовою оболонкою товстої кишки, що може стимулювати вроджену та запальну імунну реакцію господаря. У мишей DSSWOL спостерігали зниження регуляції пов'язаних з фіброзом білків, тобто Fibb та Fibg 65, та генів металопротеїназ порівняно з DSS. Значно знижений рівень вираження Mmp10 і Mmp3 плазми шляхом втручання WOL можуть допомогти запобігти деградації широкого спектра позаклітинних компонентів, включаючи протеоглікани, тип II, тип IV, тип IX і тип XI колагени, ламінін та фібронектин 63, тим самим інгібуючи деградацію стінки слизової, яка є проявляється у хворих на ВЗК 66 .
Незважаючи на відносно короткий період введення DSS, втручання WOL покращило рівень експресії ракових білків у товстій кишці (Anxa3 та Co3), а також онкогенних печінкових генів (Saa1, Черв і S100a8), як це спостерігалося у мишей DSSWOL порівняно з групою DSS. Повідомлялося, що 2% випадків ВЗК переростають у колоректальний рак (КРР) і становлять 15% смертей, пов’язаних з КРЗ. Axelrad та співавт. та Педерсен та ін. також повідомляв, що у пацієнтів із ВЗК тривалий вплив хронічного запалення є основним фактором ризику розвитку КПР, а також інших видів раку 72,73. Знижуючи експресію цих маркерів, пов’язаних із раком, та білків, які зазвичай експресуються у хворих на ВЗК (Muc18, Apoe, L1cam), втручання WOL може затримати наступ CRC, пов’язаного з ВЗК.
Вживання ШОЛ також покращило метаболічні шляхи, задіяні в гліколізі. Під час запалення численні імунні клітини активуються і мігрують до запальних уражень. Фагоцитоз, знищення бактерій та стимульоване розмноження клітин мають високі потреби в енергії 74. Нейтрофіли, макрофаги та дендритні клітини в основному використовують гліколітичні шляхи для отримання енергії, тоді як клітини В та Т в основному використовують амінокислоти, глюкозу та ліпіди для отримання енергії під час окисного фосфорилювання. Харчування та кисень швидко обмежуються або виснажуються в тканинах з високими запальними ураженнями та викликаною імунною діяльністю 75. Печінкові метаболіти, які беруть участь у гліколізі, тобто G6P та F6P, значно регулюються внаслідок добавок WOL, що вказує на те, що WOL відіграє активну роль у відновленні гліколітиків. Значна регуляція генів, що беруть участь в метаболізмі жирних кислот (Фас, Ме1, Scd1, і Еловль6) за допомогою добавок WOL, а також метаболічні зрушення в гліколізі могли сприяти поліпшенню втрати маси тіла у мишей DSSWOL, спричинених введенням DSS. Це спостереження узгоджувалось із зниженою експресією запальних білків у печінці, таких як H4, Sodc та Cytb.
Як було продемонстровано вище, ми застосували підхід нутрігеноміки, щоб отримати засноване на фактах розуміння ефекту цілісних добавок WOL на ВЗК (рис. 5). Інтегровані профілі транскриптома товстої кишки та протеомів також вказували, що добавка 2% WOL у мишей, що страждають від DSS, значно полегшує запалення в товстій кишці, що підтримує цілісність стінки слизової оболонки товстої кишки і, можливо, запобігає факторам ризику, що призводять до патогенезу до CRC. Дані печінкової транскриптоми, протеоми та метаболоми показали, що у мишей, що харчуються WOL, гени, що беруть участь в метаболізмі жирних кислот, білки, що беруть участь у запаленні, та метаболіти, пов’язані з гліколізом, покращуються, що призводить до зниження запалення та могло сприяти поліпшенню стану організму вага. У сукупності наші висновки надають інтегровану інформацію про нутрігеноміку щодо впливу WOL, традиційного китайського фрукта, на колітичну модель. Очікується, що наші результати будуть впливовими, оскільки щоденне включення ВОЛ в раціон може бути дієтичною стратегією для підтримки здоров’я кишечника та зменшення тяжкості захворювання при патологіях, пов’язаних з ураженням слизової.
Схематичний підсумок інтегрованого омічного профілювання втручання WOL у DSL-колітичній моделі миші.
- Чи безпечно їсти бензоат натрію
- ЛЕВОТІРОКСИН НАТРІЙ Побічні ефекти, відгуки пацієнтів
- Високий натрій; Затримання води Здорове харчування SF Ворота
- HITACHI 2SB656 TO-3 Силіконові PNP силові транзистори Інші інтегральні схеми Бізнес та промисловість
- Головна - Джилліан Маккіт Здорове харчування, схуднення, профілактика здоров’я