Кетонемія вагітності та розвиток центральної нервової системи плода
Агата Броніш
1 Ендокринологія та діабетологія, Медичний факультет, Collegium Medicum Ludwik Rydygier у Бидгощі, Університет Миколи Коперника в Торуні, вул. Склодовський-Кюрі 9, 85-094 Бидгощ, Польща
Матеуш Озоровський
1 Ендокринологія та діабетологія, Медичний факультет, Collegium Medicum Ludwik Rydygier у Бидгощі, Університет Миколи Коперника в Торуні, вул. Склодовський-Кюрі 9, 85-094 Бидгощ, Польща
Магдалена Хагнер-Деренговська
2 Клінічна нейропсихологія, Факультет наук про здоров'я, Людвіка Ридигера Collegium Medicum у Бидгощі, Університет Миколи Коперника в Торуні, вулиця Склодовського-Кюрі 9, 85-094 Бидгощ, Польща
Анотація
Глюкоза є основним джерелом енергії для мозку людини, який, у свою чергу, використовує кетонові тіла як доповнення для дефіциту енергії в умовах дефіциту клітин глюкози. Вагітність, ускладнена гестаційним діабетом, - це стан, пов’язаний із значно підвищеним ризиком розвитку кетонемії. Наявні дані доводять зміну впливу кетонів на центральну нервову систему протягом внутрішньоутробного життя, а також на дорослих. Кетонові тіла вільно проходять через плаценту. Вони можуть впливати на ріст плоду та розвиток пошкоджень органів, особливо центральної нервової системи. Як узгоджено в поточній рекомендації асоціацій діабетиків, не обов'язково, щоб лікуючий лікар проводив плановий огляд кетонових тіл під час лікування діабету під час вагітності. Ця стаття являє собою огляд літератури про вплив кетонів на центральну нервову систему та спробу ініціювати дискусію про те, чи варто розглядати можливість включення оцінки кетонемії до стандартного пакету допомоги вагітним діабеті та розпочати деякі дослідження щодо пояснення його впливу на плід. розвитку.
1. Кетогенез
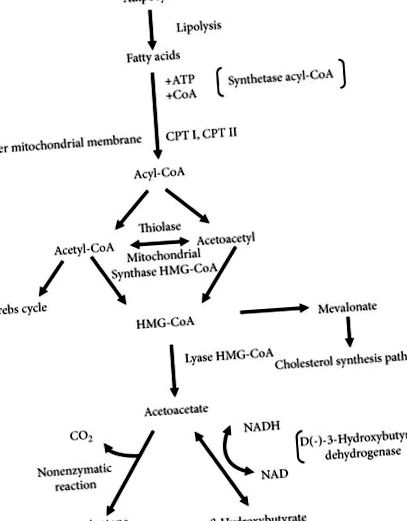
β-гідроксибутират, ацетоацетат та ацетон-кетони є проміжними метаболітами окислення, головним чином жирних кислот. Деякі амінокислоти, які називаються кетогенними амінокислотами, можуть виступати в якості іншого вихідного матеріалу для виробництва вищезазначених. Серед них можуть бути перераховані фенілаланін, ізолейцин, лейцин, лізин, триптофан та тирозин [1]. Синтез кетонів відбувається в основному в печінці, в мітохондріальному матриксі гепатоцитів і регулюється гормонально. Гормони, що стимулюють ліполіз (глюкагон, адреналін, норадреналін, адренокортикотропний гормон, тиреотропний гормон і гормон росту, вазопресин, естрадіол і тестостерон), які спричиняють підвищену концентрацію вільних жирних кислот у крові (FFA) - вихідних речовин для виробництва кетонового тіла - посилюють утворення кетонів. Глюкагон - перший гормон, що стимулює вивільнення FFA з жирової тканини, і молярне відношення його до інсуліну збільшується на початку голодування [2]. Натомість інсулін пригнічує ліполіз і зменшує синтез кетонів [3–5].
FFA, що виділяється з жирової тканини вздовж кровоносних судин, досягає печінки і переходить у цитоплазму гепатоцитів, де в свою чергу вони кон’югуються з коферментом А, що призводить до утворення ацил-коферменту А (ацил-КоА), який переходить у матрикс мітохондрій з участь транспортера карнітину. Інтенсифікація транспорту викликається впливом активації рецепторів, що активуються проліфератором ядерних пероксисом (PPAR). Активація їх альфа-ізоформ (PPARa) спричиняє, серед іншого, збільшення експресії генів, що кодують пальмітоїлтрансферази I та II, які є ферментами, відповідальними за транспорт аміноацил-КоА з цитоплазми в мітохондрію [4, 6–8]. У мітохондріях в процесі β-окислення ацил-КоА окислюється до кількох молекул ацетил-КоА, які можуть бути використані в циклі Кребса. Для доступу до циклу Кребса ацетил-КоА потребує присутності оксалоацетату, концентрація якого знижується, коли вуглеводи відсутні. Надлишок ацетил-КоА, який не метаболізувався в циклі Кребса, не може бути використаний для зворотного виробництва глюкози [2]. Він послідовно метаболізується в 3-гідрокси-3-метилглутарил-КоА, а потім в ацетоацетат (рис. 1) [9].
У мітохондріях ацетоацетат перетворюється на β-гідроксибутират під впливом D (-) - 3-гідроксибутиратдегідрогенази, яка залежить від нікотинаміду аденіндинуклеотиду (NAD). Співвідношення обох сполук є рівним у фізіологічних умовах, і вищезазначений фермент перетворює обидва сполуки один в одного, одночасно залежачи від балансу оксиредукції всередині мітохондрії [1]. У станах дефіциту глюкози, коли домінує відновлена форма нікотинаміду аденіндинуклеотиду (NADH), відбувається зсув реакції у бік утворення β-гідроксибутирату [9–11]. У цих станах співвідношення β-гідроксибутирату до ацетоацетату в крові коливається від 3: 1 до 10: 1. Крім того, ацетоацетат перетворюється в ацетон як наслідок спонтанної (неферментативної) та незворотної реакції [12]. Кетони, які діють як кислотні сполуки, зв’язують бікарбонати крові та сприяють зниженню рН сироватки крові [2].
1.1. Кетонові тіла як альтернативне джерело енергії
FFA стають основним субстратом енергії тіла в стані, що описується як внутрішньоклітинний дефіцит глюкози. Кетонові тіла, які утворюються з FFA, стають основним джерелом енергії для органів і тканин. Ацетоацетат та β-гідроксибутират як речовини, розчинні у водних розчинах, легко транспортуються з печінки до периферичних тканин, оскільки для цього процесу вони не потребують ні альбуміну, ні ліпопротеїну [2]. Кетони переходять у нейрони та гліальні клітини через конвеєр монокарбонових кислот (МСТ (транспортери монокарбонової кислоти)). Основною ізоформою цього процесу є ізоформа 1, локалізована в астроцитах, олігодендроцитах та ендотеліальних клітинах [13]. У клітинах-мішенях ацетоацетат перетворюється назад у дві молекули ацетил-КоА, які включені в цикл Кребса (рис. 2). Фермент, відповідальний за цей процес - кетоацил-кофермент-трансфераза - у мітохондріях печінки відсутній; тому кетони не можуть бути джерелом енергії в гепатоцитах [2]. З іншого боку, β-гідроксибутират діє більше як "запасна потужність", що вимагає його перетворення в ацетоацетат за участю описаної вище β-гідроксибутиратдегідрогенази [1, 12].
Утилізація тканин кетонових тіл.
Підвищений кетогенез у фізіологічних умовах спостерігається не тільки в стані голодування, але і під час енергетично збалансованої дієти, що включає багато жирів і низький рівень вуглеводів, а також після фізичних вправ, під час вагітності та в період новонародженості. У патологічних станах підвищений синтез кетонових тіл часто виникає при алкогольних захворюваннях та неконтрольованому діабеті [12, 14–16]. Кетони метаболізуються у важливих життєво важливих органах, таких як мозок, серце та нирки. Вони є енергетичним матеріалом також для скелетних м’язів. Проте, як описано вище, печінка не має можливості використовувати їх як джерело енергії [1, 17].
Кетони беруть важливу участь у центральній нервовій системі (ЦНС), де вони стають єдиним джерелом енергії у внутрішньоклітинних станах дефіциту глюкози внаслідок того, що вони вільно проходять крізь гематоенцефалічний бар'єр, тоді як FFA цього не роблять [2]. На тваринній моделі Blázquez та співавт. довели, що кетони в ЦНС походять не тільки від синтезу печінки, але й астроцити, які регулюють метаболізм глюкози в мозку, здатні виробляти кетони [18]. Згадані вище β-гідроксибутират та ацетоацетат є клітинами енергетичного субстрату. Стенерсон та співавт. довели, що β-гідроксибутират та лактат накопичуються в базальних гангліях мозку серед дітей із кетоацидозом [19]. Обмежене використання ацетону через клітину зумовлене його фізичними властивостями. Ацетон видаляється з видихуваного повітря та сечі завдяки високій летючості [1, 11, 20].
1.2. Метаболізм кетонового тіла у вагітних
Кетони вільно проходять через плаценту, і їх може використовувати плід як джерело енергії [1, 28]. Seccombe та співавт. подавали вагітним щурам мічений радіоізотопом β-гідроксибутират через стегнову вену і доводив, що цей ізотоп був виявлений у плазмі плода вже через п’ять хвилин. Вуглеці, отримані з міченого β-гідроксибутирату, були присутні в ацилогліцеринах, фосфоліпідах та холестерині [29].
2. Кетони та центральна нервова система
Спостережні та експериментальні дослідження на тваринах показали, що кетонові тіла в ЦНС не тільки є джерелом енергії, але й впливають на її функціонування. Проте діапазон і механізм впливу кетонів на ЦНС ще не повністю зрозумілі. Вплив кетонемії на збудливість ЦНС задокументовано. Перші клінічні описи використання кето дієти як ефективного лікування нападів датуються початком ХХ століття. Цей метод, знятий після введення дифенілгідантоїну для лікування епілепсії, знову застосовувався як альтернативний спосіб у випадках стійких до наркотиків судом наприкінці 90-х. Його ефективність не корелює з рівнем кетону в сироватці крові [30]. Також можна знайти деякі повідомлення про сприятливий вплив кетонових тіл при хворобі Хантінгтона [7].
Існує кілька теорій, що пояснюють механізми впливу кетонів на функціонування ЦНС. Відповідно до одного з них, метаболізм кетонів спричиняє посилений синтез анденозино-5′-трифосфату (АТФ) в мітохондріях. Збільшені запаси енергії в клітинах призводять до зменшення вироблення АТФ за допомогою гліколізу. Ферменти гліколізу пов'язані з мембранними білками. Це призводить до зниження відділів АТФ, розташованих у клітинній мембрані. Така ситуація може зменшити активність АТФ-залежних насосів у мембранних каналах, що може сприяти стабілізації клітинних мембран та впливати на активність нейронів [31].
Згідно з іншою теорією, ацетоацетат безпосередньо пригнічує активність судинного транспортувача глутамату в синаптичних везикулах гіпокампа, які відповідають за синаптичний транспорт цього важливого нейромедіатора. Ацетоацетат не має інгібуючої дії на транспорт нейромедіаторів - гама-аміномасляну кислоту (ГАМК). Однак було показано, що кето-дієта пригнічує активність substantia nigra pars reticulata, де розташовані основні GABAergic нейрони. Згідно з іншою гіпотезою, кетони стимулюють синтез ГАМК, який є гальмівним нейромедіатором збудливості мозку [31]. Повідомлялося, що β-гідроксибутират не виявляє описаних інгібуючих дій.
Інша теорія пояснює інгібування чорної субстанції білком G АТФ-залежного мембранного каналу, який пов'язаний з рецепторами GABA або аденозином А1. Аденозин зменшує активність нейронів за допомогою рецептора А1. Кетогенна дієта викликає підвищений рівень аденозину, який зникає після споживання вуглеводів. Також була врахована ідея, згідно з якою відсутність глюкози може мати більше значення для функціонування нейроцитів, ніж активність кетонів [31].
Глазер та ін. порівнював вплив гіперглікемії та кетонемії на функції шести областей кори та двох ядер стриатуму у щурів. Автори оцінили три параметри в обох станах: мозковий розподіл води, мозковий кровотік та вміст вибраних клітинних метаболітів, включаючи високоенергетичні сполуки, за допомогою магнітно-резонансної спектроскопії. Суттєво знижений мозковий кровотік, змінений розподіл води в корі головного мозку та при кетозі, а також знижений вміст високоенергетичних сполук були виявлені як при гіперглікемії, так і при кетонемії. Автори також припускають можливий вплив дефіциту інсуліну та низьких рівнів IGF-1, за винятком самих кетонів, на зменшення мозкового кровотоку [34].
2.1. Кетони та центральна нервова система плода
Існують також дослідження, які вказують на зв'язок між кетонемією вагітних жінок та розвитком психічних дітей. Дослідження на 223 вагітних (35 здорових, 89 з прегестаційним діабетом та 99 з гестаційним діабетом) було опубліковане в NEJM в 1991 році. Рівень β-гідроксибутирату та FFA у плазмі крові, а також ацетон сечі під час вагітності у матерів та коефіцієнт інтелекту потомства оцінювались у віці 2 років і знову від 3 до 5 років. Було встановлено, що діти матерів з більш високими концентраціями β-гідроксибутирату та FFA демонстрували нижчий рівень інтелекту. Такого взаємозв'язку з ацетонурією не було [36].
На тваринній моделі дотримання кетогенної дієти після народження асоціювалося з ризиком діабетичного кетоацидозу, головним чином протягом перших трьох тижнів, і це призводило до уповільнення подальшого зростання нащадків [37]. З іншого боку, як дорослі, вони характеризувалися підвищеною фізичною активністю та зниженою сприйнятливістю до тривоги та депресії. Припускають, що рівень кетонів перешкоджає метаболітам дофаміну та серотоніну, які є нейромедіаторами, що беруть участь у процесах тривоги та депресії. Не можна виключати, що ці анатомічні зміни мозку, спричинені підвищеним рівнем кетонів у внутрішньоутробному житті, можуть бути причиною проблем з поведінкою і в подальшому житті. Довготривале вивчення ефектів кетогенної дієти свідчить про можливий шкідливий вплив на пам’ять та інші когнітивні функції щурів та людей [34].
Порушення вуглеводів є найпоширенішим ускладненням вагітності в наш час. За даними Атласу Міжнародної діабетичної федерації з 2017 року, навіть 16,2% вагітних жінок стикаються з цими розладами. Переважна більшість 75–90% - це гестаційний діабет [38]. Наявні дані про вплив вуглеводних розладів на розвиток плода дають суперечливу інформацію. Перший мета-аналіз цієї проблеми був опублікований у 2015 р. - було кваліфіковано 12 досліджень (жодне з них не було рандомізованим клінічним випробуванням); 9 з них були перспективними когортними дослідженнями, а 2 з них - ретроспективними. Хоча автори підкреслюють високу неоднорідність результатів, доведено, що вуглеводні розлади матері можуть негативно впливати на розвиток потомства. Було виявлено, що діти у віці 1-2 років характеризуються на 41% меншим розумовим розвитком, на 31% гіршим психомоторним розвитком і навіть на 78% нижчим рівнем IQ у порівнянні з їх фізіологічними аналогами вагітності [39].
Незважаючи на такі спостереження, Польська, Британська або Американська Асоціація Діабету не розглядає контроль кетонів як звичайну рекомендацію для пацієнтів з гестаційним діабетом.
3. Контроль кетонів у пацієнтів з діабетом
Методи контролю кетонових тіл можна використовувати для самоконтролю. Вони визначають кетони в сечі за допомогою стрип-тестів або вимірюють концентрацію β-гідроксибутирату в капілярній крові.
Цю оцінку можна провести за допомогою так званих кетометрів. Пристрій Abbott Precision Xceed Pro® схвалено Управлінням з контролю за продуктами та ліками США (FDA) як прилад для вимірювання рівня β-гідроксибутиратів удома та в лікарні. Цей пристрій може вимірювати кількість концентрації β-гідроксибутирату в крові від 0 до 8 ммоль/л. Тест включає нанесення краплі крові на одноразову смужку, поміщену в пристрій. Смужка насичена β-гідроксибутиратдегідрогеназним ферментом. Завдяки цьому ферменту β-гідроксибутират перетворюється в ацетоацетат, який одночасно знижує NAD до NADH. Під час цієї реакції виникає потік електрики зі струмом, значення якого пропорційне концентрації β-гідроксибутирату в крові.
Неправильно відібраний зразок крові може вплинути на ці результати. Отже, не слід використовувати артеріальну кров, кров новонароджених, плазму та сироватку. Більше того, рівень гематокриту повинен коливатися від 30% до 70% для точного вимірювання. Також слід дотримуватися особливої обережності у пацієнтів із сильною дегідратацією з важкою гіпотензією, шоком або з гіперосмолярним гіперглікемічним синдромом [11, 47]. В даний час Асоціація британських клінічних діабетологів визначає визначення концентрації β-гідроксибутирату в крові як найкращий спосіб контролю реакції на лікування діабетичного кетоацидозу [48]. Проте Американська асоціація діабету та Польська асоціація діабету не виступають за жоден із цих методів [49, 50].
Повідомляється про вагітність, ускладнену діабетом до значного підвищення рівня кетонів у порівнянні зі здоровими вагітними жінками. Поточні рекомендації щодо асоціації діабетиків не рекомендують проводити рутинну оцінку кетонів у вагітних із діабетом. Ми вважаємо, що інформація, описана в статті, виправдовує початок дискусії з цієї проблеми.
Розкриття інформації
Рукопис було виконано в рамках працевлаштування в Collegium Medicum в Бидгощі, Університет Миколи Коперника в Торуні.
- Харчування та центральна нервова система SpringerLink
- Факти, функції нервової системи; Хвороби Жива наука
- Харчування та вегетативна нервова система Наукові основи Гонсалеського протоколу
- Огляд розладів нервової системи Медицина Джона Хопкінса
- Чутливість до глютену під час вагітності та розвиток мозку вашої дитини