Інфекції гельмінтів, імунна реакція типу 2 та метаболічний синдром
Апріліанто Е. Вірія
1 Кафедра паразитології медичного факультету Індонезійського університету, Джакарта, Індонезія,
2 Кафедра паразитології, Медичний центр Лейденського університету, Лейден, Нідерланди,
Ерліані Сартоно
2 Кафедра паразитології, Медичний центр Лейденського університету, Лейден, Нідерланди,
Таняваті Супалі
1 Кафедра паразитології медичного факультету Індонезійського університету, Джакарта, Індонезія,
Марія Язданбахш
2 Кафедра паразитології, Медичний центр Лейденського університету, Лейден, Нідерланди,
Асоціація між метаболічним синдромом та запаленням
Метаболічний синдром (MetS), порушення використання та накопичення енергії, проявляється як сукупність таких станів, як гіпертонія, дисліпідемія, абдомінальне ожиріння та змінений метаболізм глюкози, що збільшує ризик діабету 2 типу (T2D) та серцево-судинних захворювань ( ССЗ). Спосіб життя, який складається з переїдання, вживання висококалорійної їжі, а також відсутність або нерегулярні фізичні навантаження є фактором ризику розвитку MetS. Отже, лікування МетС включає регулярні фізичні навантаження, модифікацію дієти для зменшення ваги та/або рівня глюкози в крові та використання ліпідознижуючих препаратів.
Чи є гельмінтозні інфекції пов’язаними з метаболічним синдромом?
У країнах із високим рівнем доходу (HIC) інфекційні хвороби, такі як гельмінти (як правило, пов’язані з поганою гігієною чи санітарією), відносно добре контролюються порівняно з країнами, що розвиваються, або країнами з низьким та середнім рівнем доходу (LMIC), особливо в сільській місцевості ЛМІК. Проблеми зі здоров'ям у ЗОЗ натомість зазвичай пов'язані з MetS. З'являється все більше доказів того, що вдосконалення інфраструктури та боротьби з інфекційними захворюваннями в ЛМІК, які часто супроводжуються зменшенням кількості інфекцій (включаючи гельмінтозні інфекції), паралельно зростаючій поширеності різних запальних захворювань, таких як алергія та аутоімунність, а також T2D та CVD [10].
Численні дослідження показали зворотний зв'язок між гельмінтними інфекціями та запальними захворюваннями, такими як алергія, аутоімунітет та запальні захворювання кишечника, але важливо, що з'являються докази того, що гельмінти, схоже, також пов'язані з меншим рівнем захворюваності на MetS [10]. Дослідження в Індії показало зворотну зв'язок між лімфатичним філяріатозом і T2D [11], тоді як нещодавній звіт сільської громади Китаю, який раніше був ендеміком шистосомозу, вказує на те, що минула інфекція Schistosoma japonicum була пов'язана з меншою поширеністю MetS [12]. Глюкоза в плазмі натощак, глюкоза в крові після їжі, HbA1c та резистентність до інсуліну, а також рівень тригліцеридів та холестерину низької щільності були обернено асоційованими із самооцінками минулої інфекції S. japonicum. На підтвердження цього ми також виявили, що в Індонезії гельмінтозні інфекції пов'язані з поліпшенням чутливості до інсуліну (Wiria et al., Стаття, неопублікована).
У дослідженні в сільській Індонезії ми показали, що кишкові гельмінтозні інфекції у дорослих негативно пов'язані з факторами ризику ССЗ, такими як індекс маси тіла (ІМТ), співвідношення попереку та стегна (WHR) та рівень ліпідів [13]. . У тому ж дослідженні ми не виявили жодної зв’язку між наявними гельмінтними інфекціями та товщиною внутрішньої середовища каротидної інтими (cIMT) [13]. Це може не дивувати, оскільки cIMT осіб у цій області був дуже низьким у порівнянні з особами того ж віку, які проживають у ЗІЗ [14], що ускладнить виявлення будь-якого корисного ефекту. Наш висновок підтверджується іншим дослідженням, яке досліджувало атеросклероз у трупів [15]. Автори повідомляють, що інфекція Opistorchis felineus асоціюється із зниженням загального рівня холестерину в сироватці крові і є негативним предиктором атеросклерозу аорти.
Взяті разом, спокусливо висловити гіпотезу про те, що гельмінтозні інфекції можуть захистити від MetS, що зменшує ризик подальшого розвитку T2D та/або ССЗ.
Який можливий механізм, що стоїть за асоціацією між гельмінтами та метаболічним синдромом?
Таблиця 1
| Мишачий штам | Інфекція/екстракт гельмінтів | Висновки | Список літератури |
| (A) ApoE -/- миші або (B) випадково виведені TO миші | S. mansoni інфекція | • Знижений загальний рівень холестерину в сироватці крові (як в А, так і В) та холестерину ЛПВЩ та ЛПНЩ (В). | [26] |
| • Знижений розвиток атеросклеротичного ураження (А). | |||
| (C) ApoE -/- або (D) миші дикого типу (WT) C57BL/6 | Яйця S. mansoni, які були заморожені | • Зниження загального рівня холестерину в сироватці крові (C і D) та LDL (C). | [27] |
| • Не впливає на формування атеросклеротичного ураження (C). | |||
| • Посилені реакції Th2 на цитокіни, не впливаючи на цитокіни Th1 (C). | |||
| • Збільшення відсотка макрофагів у порожнині очеревини (С). | |||
| • Посилена здатність макрофагів поглинати ЛПНЩ, але не ацетильований ЛПНЩ (D). | |||
| (E) ApoE -/- миші або (F) TO миші | Інфекція S. mansoni, живі яйця S. mansoni, SEA та SmECS | • Патентна бісексуальна глистна інфекція знижує рівень холестерину в сироватці крові (F) і ліпідів у печінці (E і F). | [19] |
| • Одностатева глистна інфекція не суттєво знизила рівень холестерину в сироватці крові (E, F). | |||
| • Живі яйця, SEA та SmECS знижують рівень холестерину в сироватці крові (F). | |||
| • Одностатева інфекція, SEA та smECS не впливали на ліпіди печінки (F). | |||
| WT C57BL/6 миші | Інфекція N. brasiliensis | • Покращена чутливість до інсуліну та толерантність до глюкози. | [17] |
| • Зниження маси перигонадальної жирової тканини. | |||
| • Збільшення еозинофілів жирової тканини періогонади. | |||
| • Зменшення загальних макрофагів жирової тканини. | |||
| (G) WT (H) IL-10 -/- або (I) Fxr-α -/- (Nr1h4) C57BL/6J миші | МОРЕ | • Покращена чутливість до інсуліну та толерантність до глюкози залежно від IL-10 (G і H). | [21] |
| • Збільшення кількості циркулюючих ІЛ-4 та ІЛ-10 (G). | |||
| • Сприяло експресії M2 та метаболічних генів та зменшувало експресію генів M1 у жировій тканині епідидиму (G). | |||
| • Захищений від печінкового стеатозу та пригніченої експресії ліпогенних генів (г) | |||
| • Знижений ліпогенез завдяки активації Fxr-α (G, I). | |||
| (J) WT (K) STAT6 (-/-) (L) IL-13 (-/-) C57BL/6 миші | Інфекція N. brasiliensis | • Зниження набору ваги, спричиненого дієтою, та сприяння зниженню ваги у мишей із ожирінням (у J). | [28] |
| • Зниження маси епідидимальної та коричневої жирової тканини та циркулюючого лептину (J). | |||
| • Покращена толерантність до глюкози та інсулін у крові натще (J). | |||
| • Зниження всмоктування глюкози в кишечнику, пов’язане зі зниженням експресії транспортерів глюкози (J). | |||
| • Знижений стеатоз печінки та впливає на експресію генів, пов’язаних з ліпідним обміном (J). | |||
| • Регульована експресія генів цитокінів Th2 в різних органах, включаючи епідидимальний жир (J). | |||
| • Регульована експресія генів маркерів M2 Arg1 та YM1 в епідидимальному жирі (J) | |||
| • Втрата ваги та ослаблення стеатозу печінки частково або повністю залежали від ІЛ- | |||
| • 13 і STAT6 (J, K, L) | |||
| (M) LDLR -/- або WT (N) c57BL/6 мишей | МОРЕ | • Індукована регуляція генів Th2 селезінки (M) | [20] |
| • Індуковані протизапальні перитонеальні макрофаги, але не впливають на експресію гена M2 (M). | |||
| • Зниження системного запалення на мієлоїдному рівні (М). | |||
| • Знижений рівень холестерину в плазмі крові в частинках розміру ЛПНЩ і ЛПНЩ (М). | |||
| • Послаблений розвиток атеросклерозу та зменшення некрозу нальоту (М). | |||
| • In vitro макрофаги, оброблені SEA, виявляли протизапальний фенотип і були менш прихильними до активованого ендотелію (N). |
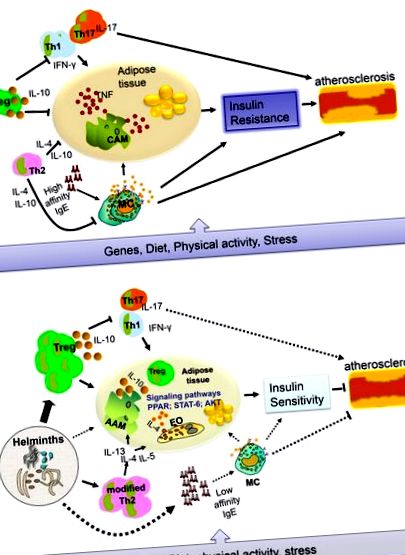
У дослідженні з використанням апоЕ -/- мишей було показано, що фактори, що виділяються з яєць S. mansoni, мають гіполіпідемічну дію [19]. Нещодавно звіт в іншій моделі (миші c57BL/6 LDLR -/-) показав, що лікування розчинним яєчним антигеном S. mansoni (SEA) викликає протизапальні макрофаги, що може зменшити системне запалення, послаблює розвиток атеросклерозу та інгібує некроз бляшок [20]. Більше того, Bhargava et al. [21] продемонстрували, що лакто-N-фукопентоза III, імуномодулюючий глікан, який можна знайти в жіночому молоці та його складі Льюїса-Х на паразитичних гельмінтах (у СЕА), може покращити чутливість до інсуліну, посилюючи сигналізацію інсуліну білої жирової тканини за рахунок індукції вироблення ІЛ-10. Чи призводять гельмінтозні інфекції до подібних змін у людей, все ще вимагає подальшого дослідження. В недавньому дослідженні ми виявили, що загальний імуноглобулін Е (IgE), який асоціюється з гельмінтними інфекціями, був пов'язаний зі зниженням рівня глюкози та ліпідів у крові натще [13]. Схема, яка показує роль запалення у розвитку Т2Д та ССЗ за відсутності та наявності гельмінтних інфекцій, наведена на рисунку 1 .
Чи є більше до IgE та ССЗ?
Зв'язок між загальним IgE та ССЗ за відсутності гельмінтів досліджували на моделях тварин. Ван та співавт. повідомили, що IgE асоціюється із ССЗ шляхом його зв'язування з FcεR1α на макрофагах для сприяння нестабільності нальоту [22]. Вони також повідомили, що рівень IgE був вищим у пацієнтів із ССЗ, особливо у пацієнтів з нестабільною стенокардією та гострими коронарними подіями. В міських районах Китаю, як повідомляється, більш високий рівень IgE та хімази, протеази тучних клітин, є потенційним фактором ризику розвитку T2D [23], [24]. Здається, ці дослідження протиставляються нашим висновкам, що високий загальний рівень IgE пов'язаний зі зниженням рівня глюкози та ліпідів натще [13]. Однак нещодавня робота припустила, що існує два типи IgE, які провокують різні реакції, коли зв’язуються з рецепторами Fcε на тучних клітинах [25]. Одним з них є IgE, який має високу спорідненість і може ініціювати дегрануляцію та анафілаксію тучних клітин, коли зв’язаний з його антигеном, тоді як інший - IgE з низькою спорідненістю, який функціонально менш активний. Дослідження того, як IgE бере участь у патогенезі MetS і як біологічна активність IgE відрізняється відсутністю або присутністю гельмінтозних інфекцій, може створити нове розуміння можливого патогенезу MetS та методів лікування.
Область розвитку гельмінтозів та MetS
Спокусливо припустити, що можливий захисний ефект проти MetS, який проживає в районах, де гельмінти є високоендемічними, базується на наявності сильних протизапальних та модифікованих реакцій (рис. 1). Щоб перевірити цю гіпотезу, необхідні достатньо потужні поздовжні дослідження у формі рандомізованого, подвійного сліпого, контрольованого проти глисти плацебо дослідження, яке може виявити, чи призводить дегельмінтизація до MetS. Іншим методом було б зараження пацієнтів з MetS гельмінтами, щоб оцінити, чи може лікування покращити MetS. Тільки тоді можна буде подолати розрив між результатами на моделях тварин і ситуацією у людей. Далі, може бути цікаво перевірити, які гельмінти або які з їх продуктів можуть бути використані для модифікації запальних реакцій як лікування Т2Д або ССЗ, як це робиться в даний час у галузі алергії, аутоімунітету та запальних захворювань кишечника [10].
Подяки
Ми вдячні Леоні Хуссартс за допомогу зі столом та Бруно Гігасу за допомогу з фігурою та критичне читання рукопису. Автори вибачаються перед колегами, статті яких неможливо цитувати через обмеження місця.
- Вплив генотипу FTO на втрату ваги та фактори ризику метаболізму у відповідь на калорії
- Інфекція цитомегаловірусом може сприяти метаболічному синдрому
- Жирові клітини можуть відчувати сонячне світло - недостатня кількість збільшує ризик метаболічного синдрому EurekAlert!
- Вплив втрати ваги на кінетику ЛПНЩ та ЛПВЩ у лікуванні діабету при метаболічному синдромі
- Вплив втрати ваги на маркери метаболізму ліпопротеїнів, багатих тригліцеридами, на метаболізм