Індукований фруктозою дисбактеріоз кишечника сприяє нейрозапаленню гіпокампа миші: користь коротколанцюгових жирних кислот
Анотація
Передумови
Дієти західного стилю викликають нейрозапалення та погіршують емоційну та когнітивну поведінку людей та тварин. Наше попереднє дослідження показало, що дієта з високим вмістом фруктози спричинила нейрозапальну реакцію гіпокампа та втрату нейронів у тварин, але основні механізми залишались невловимими. Тут зміни мікробіоти кишечника та епітеліального бар’єру кишечника досліджувались як причини нейрозапалення гіпокампа, спричиненого дієтою з високим вмістом фруктози.
Результати
Висновки
Наші висновки показують, що дисбактеріоз кишечника є критичним фактором для нейрозапалення гіпокампа гіпокампа, спричиненого дієтою з високим вмістом фруктози, у мишей C57BL/6N, можливо, опосередкованих порушенням епітеліального бар'єру кишечника. У механічному відношенні дефект запалення товстої кишки NLRP6 відповідає за порушення епітеліального бар'єру кишечника. SCFA можуть стимулювати запалення NLRP6 та покращувати порушення епітеліального бар'єру кишечника, що призводить до захисту від нейрозапалення гіпокампа гіпокампа з високим вмістом фруктози та втрати нейронів. У цьому дослідженні розглядається розрив у розумінні ураження нейронів, пов’язаного з дієтами західного типу. Наголошується на новій стратегії втручання для зменшення ризику нейродегенеративних захворювань за допомогою добавок SCFA або споживання харчових волокон.
Передумови
Нейрозапалення є відмітною ознакою нейродегенеративних захворювань, пов’язаних із дієтами західного типу, включаючи висококалорійні дієти, багаті переробленими цукрами (фруктозою або сахарозою) та жирами [1,2,3,4]. Повідомляється, що мікробіота кишечника модулює нейрогенез і неврологічну функцію гіпокампа у дорослих, контролюючи дозрівання та функцію мікроглії у мишей, що не містять мікробів та не лікували антибіотиками специфічних патогенів (SPF) [5, 6], вказуючи на те, що зміни в мікробіота кишечника (дисбактеріоз кишечника) може бути основною подією, що ініціює нейрозапалення і подальше ураження нейронів [5, 7, 8].
Дієта, багата клітковиною, покращує дефект кишкового епітеліального бар’єру та запалення індукованих декстратом сульфатом натрію (DSS) колітних мишей [28] та захищає легені миші від алергічного запалення [29]. Проковтнуті харчові волокна легко ферментуються товстими кишковими бактеріями з утворенням органічних кислот, включаючи коротколанцюгові жирні кислоти (SCFA). Лікування SCFA послаблює індуковану дієтою зміну мікробіоти кишечника та цілісності епітеліального бар’єру кишечника у мишей C57BL/6, можливо, через пригнічення системного запалення [30, 31]. SCFAs можуть мати здатність модулювати дозрівання та функцію мікроглії у мозку, припускаючи потенційні переваги SCFA, похідних мікробіоти кишечника, у захисті від нейрозапального процесу [6, 32]. Нейропротекторні ефекти SCFA також були продемонстровані на тваринних моделях нейродегенеративних розладів [32, 33], але існує потреба у більшій кількості доказів.
У цьому дослідженні ми виявили, що дисбактеріоз кишечника, керований дієтою, спричиняє порушення епітеліального бар’єру кишечника, пов’язане з виникненням нейрозапалення гіпокампа у мишей C57BL/6N. Гамма-рецептор, що активується проліфератором пероксисоми (PPAR-γ), є сенсором бутирату в просвіті товстої кишки [34]. Повідомляється, що активована мікробіотою сигналізація PPAR-γ запобігає дисбіотичному розширенню патогенних бактерій за рахунок енергетичного метаболізму клітин епітелію товстої кишки [35]. Ми також виділили ключові молекулярні механізми, за допомогою яких SCFA, а також піоглітазон (агоніст PPAR-γ) відновлювали пошкодження кишкового епітеліального бар'єру, активуючи запальний процес NLRP6, можливо, сприяючи гальмуванню нейрозапальної реакції гіпокампа та втрати нейронів у годуванні фруктозою. мишей.
Результати
Виснаження мікробіоти кишечника пригнічує нейрозапалення гіпокампа у мишей, що харчуються фруктозою
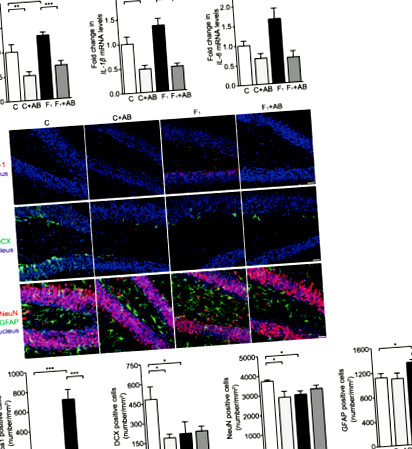
Нейрозапальна реакція гіпокампа, що характеризується значним підвищенням рівня регулювання інтерлейкіну-1 бета (IL-1β), фактору некрозу пухлини альфа (TNF-α) та рівня мРНК IL-6, спостерігалася у мишей C57BL/6N, які харчувались високофруктозною дієтою протягом восьми тижнів (рис. 1а). Імунофлуоресцентне фарбування показало, що кількість мікроглії Iba-1 + значно зросла у всьому гіпокампі мишей з високим вмістом фруктози, що харчуються дієтою, порівняно зі стандартними тваринами, що харчуються дієтою (рис. 1b та додатковий файл 1: рис. Кількість нейронів NeuN + і подвійного кортину (DCX) + новонароджених нейронів була значно зменшена, тоді як астроцитів GFAP + збільшено, в зубчастій звивині гіпокампа (DG) (рис. 1b), але не в роговій оболонці 1 (CA1) та Зони CA3 (додатковий файл 1: малюнок S1b) у мишей, які годують фруктозою. Ці результати підтверджують, що дієта з високим вмістом фруктози викликає нейрозапальну реакцію гіпокампа та втрату нейронів у мишей C57BL/6N.
Дієта з високим вмістом фруктози викликає дисбактеріоз кишечника, зменшення SCFA і порушення функції кишкового епітеліального бар’єру у мишей C57BL/6N
Для оцінки впливу дієтичної фруктози на мікробіоти кишечника у мишей аналізували фекальну мікробіоту, використовуючи послідовність ампліконів гена 16S рРНК. Дієта з високим вмістом фруктози протягом восьми тижнів змінювала структуру мікробної спільноти, але не впливала на мікробну альфа-різноманітність мишей (рис. 2а та b, додатковий файл 1: рис. S2a). Достаток Бактероїдети було значно зменшено і Протеобактерії було значно збільшено у мишей, які годували фруктозою. Більш того, ці тварини демонстрували тенденцію до зростання в Росії Фірма (Рис. 2в). Харчування фруктозою також призвело до помітного збагачення патогенних бактеріальних таксонів Deferribacteraceae (Муциспірилум) і Helicobacteraceae (Хелікобактер) у мишей (додатковий файл 1: Рисунок S2b). Хоча основні бактерії, що продукують SCFA, такі як Lachnospiraceae і Ruminococcaceae, були високо збагачені мишами, які годували фруктозою (Додатковий файл 1: Рисунок S2c), концентрація ацетату, пропіонату, бутирату та загальної кількості SCFA у фекаліях була значно нижчою у мишей, які годували фруктозою, ніж у контрольній групі (рис. 2г). Антибіотики знижували концентрацію ацетату, пропіонату, бутирату та загальної кількості СКФК у фекаліях як у контрольних, так і у тварин, які годували фруктозою (рис. 2г).
SCFA та піоглітазон частково формують дисбактеріоз кишечника та покращують порушення епітеліального бар’єру кишечника у мишей, що харчуються фруктозою
Миші, харчувані фруктозою, демонструють дефект запальної пухлини NLRP6 товстої кишки, який покращується SCFA та піоглітазоном
Примітно, що аномальна продукція гамма-інтерферону товстої кишки (IFN-γ), TNF-α та IL-10 додатково продемонструвала дисбаланс кишкового імунітету у мишей, які годували фруктозою, які покращували SCFA та піоглітазон (додатковий файл 1: Рисунок S4a) . Рівні NLRP6 і розщепленої каспази-1 P10 в товстій кишці значно зменшились, а секреція IL-18 в товстій кишці зменшилася у мишей, які годували фруктозою (рис. 4а). У контрольній групі антибіотики суттєво знижували NLRP6 і розщеплювали рівні білка каспази-1 P10, але не виявляли впливу на секрецію IL-18 товстої кишки (рис. 4а). У мишей, що годували фруктозою, антибіотики зменшували зменшення секреції товстої кишки IL-18 і додатково пригнічували експресію NLRP6 в товстій кишці (рис. 4а). SCFA або піоглітазон також запобігали зниженню рівня NLRP6 в товстій кишці та активації каспази-1 у мишей, які годували фруктозою, що призводило до відновлення продукції IL-18 (рис. 4b). Порівняно з такою у контрольних мишей, експресія NLRP3 в товстій кишці не змінювалась у мишей, які годували фруктозою SCFA та піоглітазоном, але суттєво зменшилась у контрольних мишей, які отримували антибіотики та годували фруктозою (рис. 4а, b). Більше того, експресія товстої кишки PPAR-γ та його ген-мішень (ANGPTL4) було знижено у мишей, які годували фруктозою, які були відновлені SCFA та піоглітазоном (додатковий файл 1: Рисунок S4b та c).
У товстій кишці нормальних мишей пероральне введення SCFA збільшувало експресію NLRP6 та збільшувало вироблення IL-18 (додатковий файл 1: Рисунок S4d). У системі культивованих експлантів товстої кишки мишей ex ex vivo (експлантати товстої кишки ex vivo) SCFA також збільшували експресію NLRP6 і розщеплювали рівні білка каспази-1 P10 та сприяли виробленню IL-18, і ці ефекти були придушені гістаміном (бактеріальним метаболітом) Рис. 4в). Крім того, рівень білка NLRP6 та вироблення IL-18 були підвищені SCFA, але зменшені на NLRP6 siRNA в мишачих клітинах карциноми товстої кишки CT26 (рис. 4г). Однак ні піоглітазон, ні GW9662 (антагоніст PPAR-γ) не впливали на базальну або стимульовану SCFAs активацію запалення NLRP6 у експлантатах ex vivo товстої кишки (додатковий файл 1: Рисунок S4e). Ці результати дозволяють припустити, що SCFA можуть активувати запалення NLRP6 незалежно від активації PPAR-γ.
SCFA та піоглітазон пригнічують нейрозапальну реакцію гіпокампа та втрату нейронів у мишей, що харчуються фруктозою
Обговорення
Одним з найбільш вражаючих спостережень після лікування антибіотиками широкого спектра було пригнічення нейрозапалення гіпокампа та реактивного гліозу у групі з високим вмістом фруктози, що годується дієтою, що було подібним до дії антибіотиків на мишачій моделі хвороби Альцгеймера, прогресуючої нейродегенеративної захворювання [41]. Ми також виявили, що виснаження мікробіоти кишечника спричинило втрату нейронів гіпокампа як у контрольній, так і у групі, яка годувала фруктозою, що свідчить про критичну роль мікробів кишечника та/або їх метаболітів у модуляції нейрогенезу гіпокампа. Цікаво, що SCFA або мікробіота кишечника можуть відновлювати дефектну мікроглію та посилювати цілісність гематоенцефалічного бар’єру у безмікробних мишей [6, 42]. Сприятливий вплив SCFA на нейрозапалення гіпокампа та втрату нейронів у тварин, що годуються фруктозою, додатково демонструє критичну роль коменсальних мікробів та/або їх метаболітів у модуляції неврологічної функції [7].
Висновки
Ми чітко показали, що індукована аберантною структурою мікробіоти кишечника з високим вмістом фруктози і знижений рівень SCFA в калі, демонструючи внесок дисбактеріозу кишечника в нейрозапалення гіпокампа у мишей C57BL/6N. Механічно, дисфункція запальної функції NLRP6 товстої кишки була пов’язана із порушенням функцій кишкового епітеліального бар’єру, яке покращили SCFA або піоглітазон. Ці результати дають нові докази захисних механізмів SCFA та піоглітазону проти нейрозапальної реакції гіпокампа та втрати нейронів у цій тваринній моделі. Наші висновки підкреслюють несприятливий вплив особливостей дієт західного типу на нейрозапалення гіпокампа та пропонують нову стратегію втручання при неврологічних дисфункціях. Однак у майбутньому слід отримати більш прямі докази.
Матеріали та методи
Тварини та лікування
Чотири тижневі самці мишей C57BL/6N (17-20 г), вирощені в умовах SPF, були придбані у Beijing Vital River Laboratory Animal Technology Co., Ltd. (Пекін, Китай; ліцензія на виробництво: SCXK (Su) 2016-0003 ) і дозволили акліматизуватися в середовищі тваринництва протягом тижня, перш ніж використовувати для експериментів. Вони розміщувались у специфічному середовищі з контролем температури та вологості без патогенів (22 ± 2 ° C, вологість 50 ± 5%) зі стандартним 12-годинним циклом світло/темрява. Цим мишам було надано доступ до їжі та води за власним бажанням.
Аналіз проникності in vivo
Кишкову проникність оцінювали за допомогою аналізу проникності FITC-декстран (FD4; Sigma-Aldrich) in vivo, як описано раніше [21]. Мишам, що голодували протягом 4 год, давали 0,6 мг/г маси тіла FITC-декстрану (4 кДа) у розчині 25 мг/мл, а кров збирали підщелепною кровотечею через 3 год. Інтенсивність флуоресценції в сироватці крові вимірювали за допомогою спектрофотометра флуоресценції (Synergy 2, Biotek, Winooski, VT). Концентрації FITC-декстрану визначали за стандартною кривою, сформованою послідовними розведеннями FITC-декстрану.
Збір зразків крові та тканин
В кінці експериментів мишей голодували протягом ночі та знеболювали пентобарбіталом натрію (50 мг/кг, внутрішньовенно), а кров отримували шляхом кардіопункції. Ці зразки крові центрифугували при 2500 об/хв протягом 10 хв для збору зразків сироватки, які негайно заморожували при - 80 ° C для біохімічних досліджень. Тканини гіпокампу та товстої кишки розтинали для гістопатології, аналізу просвічувальної електронної мікроскопії (ТЕМ), імунофлуоресцентного фарбування, кількісної ланцюгової реакції полімерази (qPCR) та аналізу Вестерн-блот.
Аналіз послідовності гена 16S рРНК
Свіжі зразки стільця мишей збирали в продезінфіковані пробірки, негайно заморожували у рідкому азоті після збору та зберігали при - 80 ° C до аналізу. Виділено зразки ДНК калу та проаналізовано мікробіоми в Пекінському інституті геноміки на платформі Illumina MiSeq. Були відібрані високоякісні зчитування для біоінформатичного аналізу, і всі дійсні зчитування з усіх зразків були згруповані в оперативні таксономічні одиниці (OTU) на основі 97% схожості послідовностей. α-різноманітність розраховували на основі індексу різноманітності Chao1. Варіації між експериментальними групами (β-різноманітність) оцінювали на графіках основного координатного аналізу (PCoA). Лінійний дискримінантний аналіз у поєднанні з розміром ефекту (LEfSe) проводили за допомогою програмного забезпечення LEFSE.
Визначення концентрації SCFA в калі
Система ex vivo культивованих експлантів товстої кишки миші
Система ex vivo культивованих експлантатів товстої кишки миші була побудована відповідно до методів у попередньому звіті [13] (додатковий файл 2). Товсту кишку у нормальних мишей C57BL/6N віком 8 тижнів поздовжньо розкривали і ретельно промивали, промиваючи кілька разів холодним HBSS, що містив 100 ОД/мл пеніциліну, 100 мкг/мл стрептоміцину та 50 мкг/мл метронідазолу. Тканини товстої кишки розрізали на приблизно 4-міліметрові фрагменти, помістили на попередньо змочені плоти з пінопласту і культивували в 1 мл середовища RPMI 1640, що містить 0,01% BSA, 200 од/мл пеніциліну, 200 мкг/мл стрептоміцину та 1% фунгізону. Експланти товстої кишки інкубували у присутності суміші (співвідношення 3: 1: 1) ацетату натрію, пропіонату натрію та бутирату натрію з гістаміном (H7125; Sigma-Aldrich), піоглітазоном або GW9662 (антагоніст PPAR-γ) протягом 24 год відповідно до експериментальної конструкції. Поживне середовище та експланти товстої кишки були зібрані для перевірки активації запалення NLRP6 та транскрипції PPAR-γ.
Культура клітин та лікування
Клітини карциноми товстої кишки мишачого CT26 були придбані в Шанхайському інституті біологічних наук (Шанхай, Китай) і вирощені в середовищі 1640 р. з додаванням 10% плодової бичачої сироватки у зволоженій атмосфері, що містить 5% СО2 при 37 ° C. Для експериментів клітини висівали в 6-лункові планшети на 12 год і трансфікували NLRP6 siRNA або siRNA негативного контролю (GenePharma, Шанхай, Китай) з використанням ліпофектаміну 2000 протягом 6 год. Потім ці клітини інкубували в середовищі 1640 в присутності або відсутності 12,5 мМ суміші (співвідношення 3: 1: 1) ацетату натрію, пропіонату натрію та бутирату натрію протягом 48 годин. Культуральне середовище збирали, а загальний клітинний білок екстрагували для біохімічного та Вестерн-блот-аналізу.
qPCR-аналіз
Вестерн-блот-аналіз
Гістопатологія клубової та товстої кишок
Вирізані тканини клубової кишки та товстої кишки фіксували у 4% параформальдегіді та вкладали у парафін. Блоки послідовно розрізали на зрізи товщиною 5 мкм і фарбували гематоксиліном та еозином (H&E). Гістологічні зображення отримували за допомогою мікроскопа Olympus IX53 (Токіо, Японія), цифрової камери Olympus DP73 та програмного забезпечення для зображення Olympus cellSens.
Аналіз трансмісійної електронної мікроскопії (ТЕМ)
Вирізані тканини клубової кишки та товстої кишки ретельно промивались фекальними речовинами та фіксували у 2,5% глутаральдегіді в PBS. Для ТЕМ зразки тканин обробляли за стандартними протоколами в Центрі аналізу Нанкінського медичного університету (Нанкін, Китай) та досліджували за допомогою просвічуючого електронного мікроскопа JEOL JEM-1010 (Токіо, Японія).
Імунофлуоресцентне фарбування та морфометричний аналіз
По трьом тваринам з кожної групи знеболювали і закаркально перфузували крижаний 4% параформальдегід. Мозок висікають, фіксують у 4% параформальдегіді протягом ночі, інкубують у 20% сахарозі/PBS протягом ночі при 4 ° C та інкубують у 30% сахарози/PBS протягом ночі при 4 ° C. Потім зразки мозку заморожували в суміші оптимальної температури різання (Sakura Finetek, США) і коронально розрізали кріостатом на ділянки товщиною 30 мкм. Заморожені зрізи блокували 10% фетальної бичачої сироватки в PBS протягом 1 години при кімнатній температурі. Слайди інкубували з первинними антитілами протягом ночі при 4 ° C, а потім інкубували протягом 30 хв при 37 ° C з кон'югованими Alexa Fluor вторинними антитілами (Invitrogen). До первинних антитіл належали мишачий анти-Iba1 (sc-32725, Санта-Крус), мишачий анти-NeuN (ab104224; Abcam), кролячий анти-DCX (ab77450; Abcam) та кролячий анти-GFAP (Z0334; Dako). Зрізи були забарвлені 4,6-діамідино-2-феніліндолом (DAPI) для ядерного фарбування. Зображення були зроблені за допомогою конфокального мікроскопа Leica TCS SP8. Шість випадково відібраних зрізів мозку від кожної тварини використовували для окреслення та підрахунку імунофлуоресцентно-позитивних клітин у областях гіпокампа DG, CA1 та CA3 за допомогою програмного забезпечення Image-Pro Plus (Media Cybernetics, США).
Статистичний аналіз
Дані виражаються як середнє значення ± SEM. Статистичний аналіз проводили за допомогою GraphPad Prism Software 6.01 (GraphPad Software, Сан-Дієго, США). Відмінності аналізували за допомогою одностороннього дисперсійного аналізу (ANOVA) з використанням post hoc тестів для порівняння кількох груп. стор значення
Наявність даних та матеріалів
Усі дані зчитування послідовності генів 16S рРНК були передані в Національний центр читання архіву інформації про біотехнології під номером PRJNA540110.
- Дієтичне прискорення жиру сигналізації лептину сприяє протуморогенному шлунковому середовищу у мишей
- Дієтичний марганець сприяє стафілококовій інфекції серця - ScienceDirect
- Ферментоване харчове волокно сприяє зараженню гельмінтами та посилює запальні реакції господаря
- Дієтичне обмеження доступності заліза послаблює патогенез UPEC в мишачих моделях сечових шляхів
- Дієтичні рекомендації при дисбіозі кишечника