Хронічний гепатит С та фіброз печінки
Листування: Костас Пантопулос, доктор філософії, Інститут медичних досліджень імені Леді Девіс, Єврейська загальна лікарня, 3755 Cote Ste-Catherine Road, Монреаль, Квебек H3T 1E2, Канада. [email protected]
Телефон: + 1-514-3408260-5293 Факс: + 1-514-3407502
Анотація
Основна порада: Хронічний гепатит С є основною причиною захворюваності та смертності, пов’язаної з печінкою, і схильний до фіброзу печінки, надмірного накопичення білків позаклітинного матриксу. Постановка фіброзу печінки має вирішальне значення для ведення та прогнозування стану пацієнтів. Цей огляд містить оновлену інформацію про епідеміологію вірусу гепатиту С (HCV), узагальнює основні механізми фіброгенезу печінки, що залежить від HCV, та обговорює загальні методи оцінки фіброзу печінки. Хоча біопсія печінки донедавна розглядалась як золотий стандарт, нові неінвазивні методи, включаючи сироваткові біомаркери, перехідну еластографію та комбіновані алгоритми, поступово включаються в нові настанови та стають стандартною системою лікування.
ОБРЕМЕННЯ ХРОНІЧНОГО ГЕПАТИТУ С: ЕКРАНОВА ДИЛЕМА
Хронічний гепатит С (ХГС) спричинений зараженням вірусом гепатиту С (ВГС) і становить основну проблему охорони здоров’я, вражаючи близько 200 мільйонів людей у всьому світі [1]. Це провідна причина гепатоцелюлярної карциноми (HCC) та головне показання до трансплантації печінки у західних країнах. Хоча деякі дані вказують на те, що ВГС не збільшує смертність від усіх причин [2], інші дослідження постулювали, що ХГС може зменшити тривалість життя на 8-12 років [3,4]. Таким чином, за повідомленнями, ВГС спричинив понад 86000 смертей у Європі у 2002 році [5]. Очікується, що смертність та захворюваність, пов'язані з ХГС, різко зростуть протягом наступних 50 років, враховуючи, що рівень нових інфекцій ВГС суттєво впав лише після 1989 р. [6]. Аналіз моделі Маркова припустив, що до 2030 року 30% смертей через ускладнення, пов'язані з ВГС, можна було б запобігти за рахунок збільшення 50% пацієнтів, які отримували лікування терапією інтерфероном/рибавірином [7]. З розвитком нових засобів проти ВГС, включаючи інгібітори NS3/4A, NS5A та NS5B, очікується вищий рівень успішності лікування, навіть для пацієнтів з цирозом або після трансплантації.
Гостра інфекція ВГС часто не проходить спонтанно. Приблизно 80% інфікованих людей стають хронічними носіями і можуть перерости у важкі захворювання печінки. На підставі природної історії ХГС підраховано, що у 10% -20% пацієнтів розвинеться цироз печінки, а у 1% -5% - HCC протягом 20-30 років [8]. Після встановлення цирозу печінки HCC щороку розвивається з 5% до 7% [9]. Що важливо, епідеміологічні дослідження показали, що більшість пацієнтів не знають про свій позитивний статус антитіл до ВГС [6]. У звіті, замовленому Інститутом медицини Національних академій, висвітлено недоліки у догляді за вірусними гепатитами та підраховано, що до 75% пацієнтів із ХГС залишаються не діагностованими [10]. Виходячи з цього, Центри контролю та профілактики захворювань (CDC) підрахували, що, хоча особи, народжені протягом 1945-1965 років, складають приблизно 27% населення США, вони становлять 75% усіх інфекцій від ВГС, 73% смертності від ВГС, і вони мають більший ризик розвитку HCC та термінальної стадії ускладнень печінки.
Враховуючи той факт, що рання діагностика та лікування можуть запобігти цирозу печінки та HCC, вважається, що одноразові обстеження осіб, народжених протягом 1945-1965 рр. (Бебі-бумери), запобігатимуть більш ніж 120000 смертей у США. На основі цих епідеміологічних даних та останніх досягнень у лікуванні ХГС, CDC зараз рекомендує загальну стратегію скринінгу з одноразовим тестуванням без попереднього встановлення ризику ВГС для бебі-бумерів [6]. Недавнє дослідження показало, що ширший скринінг на ВГС, ймовірно, буде економічно ефективним [11]. Тим не менше, значне зниження захворюваності та смертності від ВГС також потребуватиме покращення рівня направлення, лікування та подальшого спостереження [11]. Таким чином, як тільки пацієнти з ХГС будуть визнані в рамках більш широкого скринінгу на зараження ВГС, їм слід запропонувати відповідну клінічну допомогу та терапію. З цієї точки зору, оцінка стадії фіброзу печінки є ключовою подією в клінічному лікуванні ХГС, впливаючи як на прогноз захворювання, так і на показання лікування [12].
ВГС І ФІБРОГЕНЕЗ ПЕЧІНКИ: ОСНОВНІ ПОНЯТТЯ
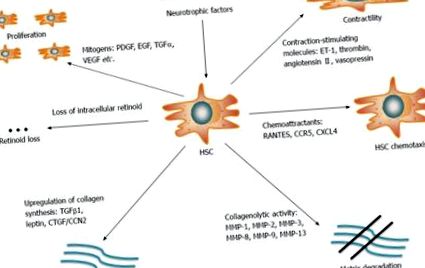
З'ясування механізмів, що лежать в основі фіброгенезу печінки, має першорядне значення для лікування та профілактики кінцевої стадії захворювання печінки. Фіброз печінки визначається надмірним накопиченням білків позаклітинного матриксу (ЕКМ), таких як колаген, ламінін, еластин, фібронектин тощо, і в даний час розглядається як реакція загоєння ран на хронічну травму печінки [13]. ВГС-інфекція безпосередньо модулює сигнальний та метаболічний шляхи вірусними білками. Більше того, він побічно викликає противірусні імунні відповіді господаря, що призводять до хронічного запалення. Разом ці події сприяють фіброгенезу печінки [14]. Ключовим фіброгенетичним елементом є клітина печінкової зірчастої клітини (HSC), клітина, що зберігає вітамін А (ретиноїд) і знаходиться в перисинусоїдальному просторі Діссе. Хоча спокійні за відсутності запальних подразників, HSC активуються у відповідь на пошкодження печінки і зазнають трансформації в проліферативні, скорочувальні міофібробласти. Активовані HSC є основним джерелом продукування ECM [15] і тим самим порушують рівновагу між відкладенням і розчиненням білків ECM, що призводить до фіброзних рубців і, зрештою, до цирозу печінки (рис.
Печінкові зірчасті клітини - це клітини, що зберігають ретиноїди, які відіграють ключову роль у фіброгенезі печінки. Під час пошкодження печінки вони переходять із стану спокою в проліферативні скорочувальні міофібробласти. Активовані HSC є основним джерелом для виробництва колагену та інших білків ECM. Кілька молекул і шляхів регулюють рівновагу між відкладенням і розкладанням білків ECM. HSC: Зірчасті клітини печінки; ECM: позаклітинний матрикс; PDGF: похідний від тромбоцитів фактор росту; EGF: епідермальний фактор росту; TGF: Трансформуючий фактор росту; VEGF: судинний фактор росту ендотелію; CCR5: С-С хемокіновий рецептор 5; ММР-2: Матриця металопротеїнази 2.
Розвиток культури клітин та тваринних моделей, що рекапітулюють основні аспекти ВГС-інфекції та пошкодження печінки, було вирішальним для розуміння патогенезу ХГС [16,17]. Це включає шляхи, які беруть участь у ініціюванні та продовженні активації HSC. Ініціювання активації HSC опосередковується паракринними подразниками з сусідніх клітин, активних форм кисню (АФК), ліпополісахаридів (LPS) або апоптотичних тіл. HSC підтримують свою активність у відповідь на фіброгенетичні, проліферативні, хемотаксичні та запальні сигнали [14].
Прямий HCV-залежний фіброгенез печінки за допомогою вірусних білків
ВГС містить позитивну одноланцюгову РНК, яка перекладається у великий попередник поліпротеїну. Останній піддається протеолітичному розщепленню ферментами вірусу та господаря з метою генерування зрілих структурних білків (ядро, E1, E2 та p7) та неструктурних білків (NS2, NS3, NS4A, NS4B, NS5A та NS5B) [18]. Ці молекули можуть націлюватись на кілька типів клітин, включаючи гепатоцити, моноцити, лімфоцити та різні секреторні клітини [19-21], і таким чином модулювати проліферацію клітин, апоптоз, окислювальний стрес та вроджений імунітет [22].
Експериментальні дані свідчать про те, що основний білок HCV, а також неструктурні білки HCV можуть безпосередньо ініціювати активацію HSC і, таким чином, ініціювання фіброгенезу. Основний білок переважно активує промітогенні внутрішньоклітинні шляхи всередині HSC, тоді як білки NS3 та NS5 спеціально стимулюють прозапальні шляхи через NF-κB та JNK [23]. Ядро і білки NS3 сприяють збільшенню рівня внутрішньоклітинного кальцію [Ca 2+] i та АФК; ефекти основного білка залежать від його зв'язування з рецептором C1q [23]. Індукція остеопонтину за допомогою сигналів кальцію та АФК сприяє переходу епітелію в мезенхіму гепатоцитів [24]. Глікопротеїн Е2 оболонки ВГС є ще одним потенційним фіброгенетичним фактором. Це сприяє активації матричної металопротеїнази 2 (MMP-2) після зв'язування з CD81 HSC, що призводить до деградації нормальної ECM в районах з високою щільністю HCV і може призвести до інфільтрації клітин запалення [25].
Слід також зазначити, що ядро, білки NS3 та NS5A індукують окислювальний стрес у гепатоцитах та моноцитах завдяки активації NADPH-оксидази [26-28] та репресії гемоксигенази 1 (HO-1) [29]. Крім того, ядро та білки NS3 активують запальні шляхи через Toll-подібний рецептор 2 (TLR2) у моноцитах, які модулюють вроджений імунітет [30]. Крім того, дослідження з моделями репліконів HCV продемонстрували індукцію окисного стресу та активацію трансформуючого фактора росту β1 (TGFβ1) та інших профібротичних сигналів у відповідь на реплікацію HCV [31,32].
Непрямий HCV-залежний фіброгенез печінки через імунні відповіді та інші шляхи
Імунна відповідь на HCV-інфекцію відіграє ключову роль у посиленні фіброгенезу печінки. Багато факторів росту, запальні цитокіни та хемокіни можуть регулювати активацію HSC та їх трансформацію в міофібробласти [33]. Зокрема, стимульована імунітетом індукція фактора росту, одержуваного тромбоцитами (PDGF), і подальша мобілізація внутрішньоклітинного кальцію викликають мітогенні ефекти до HSC [34,35]. Похідний клітин Купфера трансформаційний фактор росту α (TGFα) [36] та індукована жовчними кислотами активація рецептора епідермального фактора росту (EGF) [37] сприяють проліферації HSC. Більше того, індукція судинного фактора росту ендотелію (VEGF) сприяє активації та проліферації HSC, а також печінковому ангіогенезу, роблячи цю молекулу ключовим елементом фіброгенного процесу [38].
Поряд з проліферативними факторами, фіброгенні цитокіни, що сприяють виробленню ECM, позитивно регулюються в контексті імунної відповіді на інфекцію HCV. TGFβ1 є найпотужнішим профібротичним цитокіном, стимулюючим вироблення колагену за допомогою сигналу Smad [39,40]. Більше того, додаткові молекули, такі як фактор росту сполучної тканини (CTGF/CCN2) [41] та лептин адипокіну [42], сприяють фіброгенезу печінки через передачу сигналів TGFβ1. Фіброгенна активність лептину частково опосередковується TGFβ1 і вимагає подальших стимулів, отриманих з клітин Купфера [43]. Лептин також діє як пригнічувач активованого проліфератором пероксисоми рецептора γ (PPARγ), антифіброзного ядерного рецептора, здатного скасувати активацію HSC і зберегти його спокій [44].
Хемокіни посилюють фіброгенез завдяки хемотаксису фіброгенних клітин і посиленню запальної реакції. HSC продукують численні рецептори і секретують кілька цитокінів [45]; їх роль у патофізіології фіброгенезу в даний час є предметом дослідження. Останні дані свідчать про те, що індукція C-C хемокінового ліганду 5 (CCL5, також відомого як RANTES) за допомогою сигнального шляху NF-κB сприяє хемотаксичним та мітогенним ефектам на HSC через його рецептор C-C хемокінів 5 (CCR5) [46]. Крім того, ліганд 9 хемокінів (C-X-C-мотив), отриманий з тромбоцитів, виявляє антифібротичні властивості, які залежать від його рецептора CXCR3 [47], тоді як CXCL4 виконує профібротичну функцію [48].
Нейрохімічні та нейротрофічні фактори можуть також посилювати фіброгенетичну функцію HSC. Кілька клітинних шляхів нейроендокринної системи активуються у відповідь на хронічне ураження печінки. Індукція опіоїдної сигналізації ендогенними опіоїдами стимулює проліферацію HSC і посилює відкладення колагену [49]. Подібним чином активація рецептора CB1 канабіноїдами, похідними HSC [50], посилення передачі сигналів PDGF в HSC серотоніном [51] та активація HSC гормонами щитовидної залози [52] сприяють фіброгенетичним шляхам.
Пряма взаємодія HSC з імунними клітинами через експресію молекул адгезії призводить до двонаправленої клітинної стимуляції та посилення фіброзу. Фактор некрозу пухлини α та хемоаттрактантний білок 1 моноцитів (MCP-1) разом з іншими прозапальними цитокінами секретуються клітинами Купфера у відповідь на активацію NF-κB [53]. Це ще раз призводить до активації HSC і секреції факторів, що підсилюють запальний процес і продовжують активність макрофагів, таких як колонієстимулюючий фактор макрофагів [54], інтерлейкін 6 [55], MCP-1 [56] і RANTES [ 46]. Крім того, HSC експресують молекули адгезії клітин, включаючи молекулу адгезії 1 судинних клітин [57] та молекулу внутрішньоклітинної адгезії 1 [58]. Вони беруть участь у подальшому наборі клітин запалення в місці пошкодження, що посилює фіброгенетичний процес. Інші типи клітин, причетних до прогресування фіброзу, включають лімфоцити [59], макрофаги [60] та ендотеліальні клітини [61]. Макрофаги сприяють виживанню активованих HSC через NF-κB-залежні шляхи [62]. Навпаки, природні клітини-вбивці та Т-клітини хворих, інфікованих ВГС, сприяють апоптозу HSC і тим самим виконують антифібротичну функцію [63].
І останнє, але не менш важливе: окисний стрес є ключовим компонентом фіброзу печінки [64]. Апоптотичні клітини паренхіми фагоцитуються активованими HSC, що призводить до активації NADPH-оксидази [65]. Останній опосередковує генерацію АФК, які здатні як ініціювати, так і продовжувати фіброз шляхом активації HSC, гепатоцитів, клітин Купфера та запальних клітин [66]. Цей процес ще більше посилюється у присутності поліненасичених жирних кислот, етанолу та заліза. Крім того, ДНК апоптотичних гепатоцитів може взаємодіяти з TLR9 HSC і, таким чином, посилювати вироблення та відкладення колагену [67].
Помірне та середнє перевантаження печінкового заліза є загальним проявом пацієнтів із ХГС. Це багато в чому пов’язано з неправильною регуляцією регулюючого залізо гормону гепсидину [68,69], який транскрипційно пригнічується індукованим HCV окислювальним стресом [70]. Незважаючи на те, що залізо антагонізує реплікацію ВГС, інактивуючи вірусну полімеразу NS5B [71,72], накопичення печінки в печінці [73], підвищений рівень феритину в сироватці крові [74] або знижений рівень гепсидину в сироватці крові [75] пов’язані з прогресуванням захворювання печінки. Білок гемохроматозу HFE, атипова основна молекула комплексу гістосумісності класу I, може також сприяти фіброгенезу печінки як вищий регулятор гепсидину та/або як можливий імунологічний фактор [76,77].
ВПЛИВ ФІБРОЗУ ПЕЧЕНКИ НА ПРОГНОЗ, СТРАТЕГІЇ УПРАВЛІННЯ ТА ЕКРАНІНГУ
Накопичення фіброзу печінки є значним інцидентом з основними наслідками для розвитку патології ХГС [78]. Це вказує на початок прогресуючого захворювання, яке з часом може призвести до цирозу та термінальної стадії ускладнень печінки [79]. Пацієнти з відсутнім або легким фіброзом при постановці діагнозу мають відносно низький ризик (25% -30%) розвитку цирозу протягом наступних 20 років. Портальний та перегородковий фіброз викликають цироз, хоча і з різною швидкістю прогресування (18–20 років для пацієнтів із портальним фіброзом та 8–10 років для пацієнтів із фіброзом перегородки) [80]. Таким чином, стадія фіброзу печінки є критично важливою для клінічного ведення, особливо у світлі нової скринінгової хвилі ВГС-інфікованих пацієнтів [6].
Клінічне ведення хворих на ХГС залежить від двох різних стадій фіброзу печінки [81]: (1) значний фіброз, гістологічно класифікований як фіброз перегородки (стадія F3 за METAVIR), є остаточним вказівкою на противірусне лікування, а не на відстрочку; та (2) цироз (стадія F4 за METAVIR) вимагає специфічного та регулярного спостереження, яке повинно включати скринінг на HCC та варикоз стравоходу. Окрім показань до противірусного лікування, на більш просунутій стадії фіброзу печінки слід вимагати втручань для контролю відомих негативних кофакторів прогресування захворювання (Таблиця (Таблиця1). 1). Сюди входять модифікації способу життя (дієта, схуднення, регулярні фізичні вправи), утримання від алкоголю та наркотиків, звернення до фахівців (гепатолог, метаболічні клініки, дієтолог, психолог), конкретні ліки (статини, сенсибілізуючі агенти). Таким чином, нові стратегії скринінгу, які відкриті для великої групи людей, бебі-бумерів, повинні бути пов'язані з діагностичними та терапевтичними втручаннями для всіх нещодавно виявлених пацієнтів.
Таблиця 1
Фактори, що сприяють прогресуванню фіброзу при хронічному гепатиті С
- Зміни мікробіоти крові при ожирінні з фіброзом печінки
- FDA схвалила Zepatier для лікування хронічних генотипів 1 та 4 гепатиту С FDA
- Зміни у профілях мікробіоти крові, пов’язаних із фіброзом печінки у пацієнтів із ожирінням. Пілот
- Муковісцидоз Хвороба печінки Райлі Здоров'я дітей
- Вплив Harvoni на протеїнурію та eGFR при хронічній хворобі нирок, пов’язаній з вірусом гепатиту С