хелікобактер пілорі є інвазивним, і це може бути факультативним внутрішньоклітинним організмом
Лабораторія дослідження шлунково-кишкового тракту та печінки, Медичний факультет, USUHS, Бетесда, MD 20814‐4799, США.
* Електронна пошта [email protected]; Тел. (+1) 301 295 3607; Факс (+1) 301 295 3676 або (+1) 301 295 3557. Шукайте інші статті цього автора
Кафедра медичної біохімії та біофізики Університету Умео, SE ‐ 901 87 Умео, Швеція.
Лабораторія дослідження шлунково-кишкового тракту та печінки, Медичний факультет, USUHS, Бетесда, MD 20814‐4799, США.
* Електронна пошта [email protected]; Тел. (+1) 301 295 3607; Факс (+1) 301 295 3676 або (+1) 301 295 3557. Шукайте інші статті цього автора
Кафедра медичної біохімії та біофізики Університету Умео, SE ‐ 901 87 Умео, Швеція.
Резюме
Патогенність багатьох бактерій, що колонізують шлунково-кишковий тракт, часто залежить від їх здатності отримати доступ до клітин, які зазвичай не є фагоцитарними. хелікобактер пілорі колонізує шлунок понад половини світового населення і є основною причиною виразкової хвороби шлунка та раку шлунка. Зазвичай його вважають неінвазивним патогеном, який присутній лише в просвіті шлунка і прикріплений до клітин шлункового епітелію, хоча певна кількість в природних умовах і в пробірці дослідження показали, що H. pylori насправді є інвазивним. В додаток, H. pylori може заселити позаклітинне середовище після повної елімінації позаклітинних бактерій гентаміцином, припускаючи, що її можна вважати факультативною внутрішньоклітинною бактерією. Цей огляд вивчає обґрунтованість цих спостережень та описує докази, що свідчать про наявність внутрішньоклітинної присутності H. pylori відіграє роль у викликанні захворювань, ухиленні від імунітету та життєздатності бактерії в шлунку більшості людей.
Вступ
Просвіт шлунка здавна вважався стерильним середовищем, хоча зараз встановлено, що в шлунку можна виявити наявність багатьох бактерій. З початку 20 століття багато авторів спостерігали наявність спіральних організмів у шлунку і припускали, що ці бактерії викликають шлункові захворювання. Їх спостереження здебільшого ігнорували до 1985 року, коли Уоррен і Маршалл переконливо продемонстрували це хелікобактер пілорі викликає гастрит (Маршалл та ін., 1985а), відкриття, за яке вони отримали в 2005 році Нобелівську премію з фізіології та медицини. Крім того, наявність H. pylori сильно пов'язаний з виразковою хворобою шлунка (Маршалл та ін., 1985b; Anonymous, 1994a) та рак шлунка (Anonymous, 1994b). Сьогодні ми це знаємо H. pylori колонізує шлунок більше половини населення слова і що він постійно асоціюється з хронічним активним гастритом, хоча лише 15–20% H. pylori позитивні суб'єкти мають шлункові захворювання, і деякі пацієнти з виразковою хворобою шлунка або раком шлунка, здається, є H. pylori негативний.
Цей очевидний парадокс свідчить про те, що H. pylori присутності в шлунку недостатньо, щоб викликати шлункові захворювання, і що необхідно виконати одну або кілька додаткових умов. Наприклад, H. pylori повинен нести специфічні гени вірулентності (наприклад cag патогенність острова і vacA і babA гени) (Peek and Blaser, 2002) та господаря, можливо, доведеться схильні до розвитку розладів під час інфекції [наприклад, Поліморфізм гена IL ‐ 1β або NOD у певних популяціях (El ‐ Omar та ін., 2000; Розенстіель та ін., 2006)]. Крім того, можуть бути присутні невизначені фактори навколишнього середовища, які прискорюють появу захворювання, і вважається, що захисні фактори, такі як вітаміни, є захисними. Нарешті, інші фактори можуть зіграти свою роль у H. pylori патогенність, стійкість до життя та стійкість до лікування антибіотиками.
Оскільки вважається, що інвазивність багатьох патогенних мікроорганізмів відіграє певну роль у їх вірулентності та патогенності, можливо, що інвазивність відіграє роль у H. pylori патогенність, як було розглянуто у 2003 р. (Petersen та Krogfelt, 2003). Цей огляд оновлює наявну на той час інформацію та узагальнює в природних умовах і в пробірці дані, що демонструють це H. pylori може вторгнутися на слизову оболонку шлунка і бути присутнім у клітинах шлункового епітелію та імуноцитах. Огляд також обговорює, чи H. pylori інвазивність відіграє роль у стійкості та патогенності бактерії.
Спостереження в H. pylori- заражені люди та тварини
Відсутність визнання цього H. pylori може бути внутрішньоклітинним може бути пов'язано з тим, що електронна мікроскопія менш пристосована для скринінгу великої кількості зразків, важко застосовується до архівованого матеріалу, а також вимагає чудового збереження зразків. Навпаки, використання потужної гістохімії, IHC та FISH ефективно для скринінгу великої кількості біопсій (включаючи архівовані тканини) та для характеристики малих організмів (Makristathis та ін., 2004). Коли застосовуються такі методи, H. pylori виявляється у власній пластинці та в епітеліальних клітинах шлунка та імуноцитах пацієнтів із шлунковими захворюваннями (Andersen and Holck, 1990; Genta та ін., 1996; Енгстранд та ін., 1997; Семіно ‐ Мора та ін., 2003; Неккі та ін., 2007).
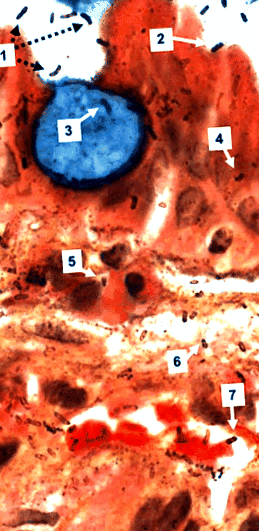
Спостереження за великим збільшенням забруднених Гента біопсій легко візуалізує спіральні організми, пофарбовані сріблом, не тільки в просвіті шлунка, але і в межах нормальних та метапластичних клітин шлункового епітелію, в власній пластинці та в поственозних капілярах, де вони дотримуються еритроцитів (рис. 1). Крім того, розміри та зовнішній вигляд забруднених сріблом організмів у власній пластинці вражаюче схожі на такі у внутрішньосвітлових H. pylori. Однак срібло може забарвити тканинні мембрани господаря і не є специфічним для H. pylori і багато патологоанатомів не роблять таких спостережень. Навпаки, спостереження конфокальної мікроскопії препаратів IHC та FISH та ультраструктурні дослідження з імунозолотою виявили специфічну ідентичність організмів та їх внутрішньоклітинну локалізацію (Semino-Mora та ін., 2003; Неккі та ін., 2007), а також підтверджено H. pylori наявність у власних капілярах шлункової пластинки (Aspholm та ін., 2006; Неккі та ін., 2007).
Біопсія шлунка пацієнта з метаплазією кишечника (пляма Гента, оригінальне збільшення × 1000). Келихоподібна клітина, зафарбована синім кольором, оточена більш-менш нормальними епітеліальними клітинами. Внутрішньопросвітній H. pylori або вільно плаваючі (1), або прикріплені до епітеліальних клітин (2), але не до келихоподібної клітини. Паличка, кома та спіраль H. pylori видно в келихоподібній клітині (3), в епітеліальних клітинах (4), у запальних клітинах (5), у власній пластинці (6) та в посткапілярній венулі, де вони тісно пов’язані з еритроцитами (7) . Цікаво, що срібне напруження внутрішньосвітлеве H. pylori виявляється сильнішим, ніж для внутрішньоклітинних та інтерстиціальних бактерій.
В пробірці спостереження в культурах клітин епітеліальних клітин та імуноцитів
На сьогодні, однак, прямого підтвердження цього немає H. pylori може розмножуватися внутрішньоклітинно, оскільки жодне дослідження з часом не показало H. pylori поділ у клітинах і кількість колонієутворюючих одиниць (cfu) не збільшувався в клітинах AGS, оброблених гентаміцином (Amieva та ін., 2002). Це останнє спостереження вказує на те, що ці специфічні в пробірці експериментальні умови не забезпечують самоокупності середовища, але не повністю виключають внутрішньоклітинну реплікацію H. pylori. Дійсно, кількість внутрішньоклітинних КОЕ являє собою складний баланс між входом, внутрішньоклітинним ростом, внутрішньоклітинною смертю та виходом з клітин, і цей делікатний баланс може порушитися позаклітинним гентаміцином. В природних умовах, не виключено, що H. pylori тимчасово ховається внутрішньоклітинно, а потім виходить, як тільки небезпека проходить, подібно до того, що може трапитися Campylobacter jejuni, ще один факультативний внутрішньоклітинний організм.
Складні взаємозв'язки між H. pylori а імуноцити, яким доручена їх елімінація, можуть допомогти пояснити, чому інфекція зазвичай зберігається протягом життя людини. В пробірці, фагоцитований H. pylori залишалися ультраструктурно неушкодженими при інкубації з поліморфноядерними лейкоцитами та моноцитами за відсутності комплементу або сироватки, тоді як додавання комплементу або сироватки до середовища інкубації призвело до знищення бактерій (Андерсен та ін., 1993; Кіст та ін., 1993). Так само додавання імунної сироватки плюс надлишок моноцитів зменшило кількість H. pylori, тоді як надлишок ПМН призвів до повного вбивства H. pylori (Андерсен та ін., 1993). Однак деякі фагоцитовані бактерії не зазнали впливу після інкубації з моноцитами та сироваткою, і часто були оточені великими агрегатами тромбоцитів (Андерсен та ін., 1993). Це останнє спостереження може мати значення для нормалізації кількості тромбоцитів, що спостерігається майже у половини пацієнтів з імунною тромбоцитопенічною пурпурою після H. pylori викорінення (Кувана та Ікеда, 2006).
хелікобактер пілоріІндукована неопсонова активація нейтрофілів людини відбувається шляхом лектинофагоцитозу, тобто приєднання адгезину SabA сиалової кислоти до поверхневих гангліозидів нейтрофілів (сіалізовані гліколіпіди), що активують фагоцитоз (Unemo та ін., 2005). Нещодавно SabA був визначений як давно затребуваний сиалової кислоти H. pylori гемаглютинін, який агрегує клітини бактерій з еритроцитами в пробірці. В додаток, H. pylori приєднується до еритроцитів у дрібних судинах слизової оболонки шлунка, що припускає, що гемаглютинація може мати пряме біологічне значення та механічно активна в природних умовах (Аспхольм та ін., 2006). У слизовій оболонці шлунка, H. pylori часто перевищує порівняно з фагоцитами. Якщо в пробірці результати відображають в природних умовах ситуація, фагоцити можуть бути неефективними в H. pylori вбивство, яке може зіграти певну роль у наполегливості H. pylori в шлунковому епітелії.
Подібні події спостерігались і в макрофагах. Імунофлуоресценція та електронна мікроскопія продемонстрували вірулентність H. pylori, що містять cag Острови патогенності швидко інтерналізувались у багаті актином фагосоми (Аллен та ін., 2000). Тоді гомотипічне злиття фагосом призвело до утворення «мегасом», що містять множину H. pylori які життєздатні протягом ≥ 24 год (Аллен та ін., 2000). У контрасті, H. pylori штами, які не експресували CagA або VacA, легко фагоцитували і вбивали, а мегасом не спостерігали (Аллен та ін., 2000). Утворення мегасом і H. pylori Було показано, що виживання залежить від уреази та аміаку, одержуваного уреазою, та закислення фагосом (Schwartz and Allen, 2006). Внутрішньоклітинна присутність H. pylori всередині імуноцитів було пов'язано з виробленням апоптозу в Т- і В-клітинних лініях (Singh та ін., 2006) та в природних умовах (Семіно-Мора та ін., 2005), що може зіграти роль у збереженні інфекції (Singh та ін., 2006).
Механізм і часовий хід H. pylori інвазивність
Уповільнена скануюча електронна мікроскопія (SEM) та TEM задокументували час початкового зчеплення та подальшого введення H. pylori в клітини HEp2 (рис. 2) (Лофман та ін., 1997). Вхід, як видається, залучає інший механізм в клітинах AGS з інтимною адгезією H. pylori до псевдоподів, що виходять з клітин AGS, що призводить до поступового поглинання H. pylori на блискавку (рис. 3) (Kwok та ін., 2002).
А. СЕМ-малюнок H. pylori запис у клітинку HEp2 (з дозволу М. Блока, за Енгстрандом та Грем, 1997). B і C. Спостереження за двома часом H. pylori виділено червоним кольором, що показує поступовий вхід у клітину HEp2 протягом 49 с. Адаптовано з дозволу Macmillan Publishers Ltd. Природна медицина3: 930–931, авторське право 1997.
SEM та TEM аналіз H. pylori 26695 дотримання клітин AGS та вхід до них. Клітини AGS, заражені H. pylori 26695 при кратності зараження 100 протягом 12 год при 37 ° С. Зразки, отримані в різний час, аналізували за допомогою SEM та TEM. H. pylori прикріплюється до клітин AGS шляхом інтимного контакту з мікроворсинками клітини хазяїна (30 хв, стрілки). Особливості схоплення на блискавці спостерігаються через 1 год, 90 хв та 3 год після зараження. Батончики, 1,5 мкм. З дозволу Квока та ін. (2002).
Молекулярні дослідження показали, що потрапляння в клітини епітелію було досягнуто за допомогою рецептор-опосередкованого ендоцитозу (Еванс та ін., 1992) та через активний процес рухливості бактерій та проникнення в клітинні мембрани (Bjorkholm та ін., 2000). Потім бактерії зв’язувались у щільних вакуолях у тісному зв’язку з конденсованими ниткоподібними актиновими та тирозиновими сигналами фосфорилювання. Ці події залежно від дози інгібуються TNF-α та інгібіторами фосфатидилінозитол 3-кінази та протеїнкінази С, а посилюються інгібітором тирозинфосфатаз та АТФаз (Квок та ін., 2002).
Диференціальне інтерференційне контрастне відео та імунофлуоресцентна мікроскопія (рис. 4) ілюструють це H. pylori може потрапляти у великі цитоплазматичні вакуолі з безлічі клітинних ліній епітелію, включаючи аденокарциному шлунка та товстої кишки, а також клітинну лінію нирок (Amieva та ін., 2002). Лікування цитохалазином D не впливало на утворення вакуолі, але пригнічувало надходження в клітини, що свідчить про те, що актиновий цитоскелет відіграє певну роль у введенні клітин (Амієва та ін., 2002). Потрапивши всередину клітин, H. pylori залишався рухливим у вакуолях протягом декількох годин, як продемонструвала сповільнена мікроскопія. Імпульсне лікування гентаміцином продемонструвало, що період напіввиведення інтравакуолярних бактерій становив приблизно 24 год, і що деякі інтравакуолярні бактерії залишались життєздатними, були звільнені і вселили позаклітинне середовище після видалення гентаміцину.
Ілюстрація диференціального імунофарбування клітин AGS, культивованих з H. pylori. Як ілюструє жовта стрілка, більшість H. pylori забарвлені в жовтий колір і розташовані поза клітинами. Один з H. pylori внутрішньоклітинний (червона стрілка) і забарвлений в червоний колір (за Амієвою та ін., 2002 з дозволу).
Одним з них може бути білок інвазину (InvA), подібний до білка, що продукується ентеропатогенним Єрсінія що зв’язується з кишковими М-клітинами рецепторами інтегрину і дозволяє потрапляти в ці клітини (Isberg та ін., 2000). У випадку H. pylori, штам J99 має гомологічний інвазиновий білок InvA та an invA ген, тоді як подібні послідовності були названі NudA і nudA у штамі 26695, а також присутні в нещодавно опублікованих повноцінних геномах HPAG1 (номери доступу CP000241 та NC_008086), хоча ім'я не вказано (Oh та ін., 2006).
Актуальність H. pylori інвазивність
Нарешті, внутрішньоклітинна H. pylori більш стійкі до лікування антибіотиками, і лише високі концентрації антибіотиків з внутрішньоклітинною активністю можуть вивести бактерію з клітин HEp2. В природних умовах, IHC продемонстрував, що інфекція не виліковується антибіотиками у пацієнтів зі стійкою внутрішньоклітинною H. pylori інфекція, навіть якщо елімінація позаклітинних бактерій була завершена через 14 днів після лікування (Engstrand та ін., 1997). Таким чином, антибіотики з внутрішньоклітинною активністю (наприклад, макроліди) слід переважно використовувати для лікування H. pylori інфекція (Hulten та ін., 1996; Печере, 2001).
Висновки
Чверть століття після відкриття H. pylori і демонстрація того, що бактерія викликає аденокарциному шлунка, MALT-лімфому та виразкову хворобу, переконливо в природних умовах дані свідчать про те, що бактерія може потрапляти та експресувати мРНК та антигени всередині власних пластин шлунка. В додаток, в пробірці Дослідження показали, що це життєздатне H. pylori виживають в епітеліальних клітинах та імуноцитах, виявляють спрямовані рухи всередині внутрішньоклітинних вакуолей та заселяють позаклітинний простір після того, як позаклітинна бактеріальна популяція була знищена гентаміцином протягом 3 днів. Однак прямі спостереження за часом не дали прямих доказів внутрішньоклітинної реплікації H. pylori шляхом візуалізації бактерій, що діляться в епітеліальних клітинах, і не спостерігається збільшення кількості клітин у клітинах. Крім того, ні H. pylori Фактор, як відомо, є важливим для інвазії або внутрішньоклітинного виживання. Нарешті, частка внутрішньоклітинної проти внутрішньосвітлової H. pylori повідомлялося, що він становить приблизно 1% у шлунково-кишкових епітеліальних клітинах і незначний у клітинах HeLa, і спокусливо вважати, що інвазивність бактерії не є клінічно важливою.
Тим не менше, невелика кількість бактерій, розташованих у цитоплазмі кількох швидко поділяються та стратегічно розташованих клітин, може мати потенціал для модифікації ряду цитоплазматичних та ядерних процесів і може спричинити метилювання CpG та мутації ДНК, особливо тому, що, як відомо, гени вірулентності експресується в епітеліальних клітинах (Semino-Mora та ін., 2003; Неккі та ін., 2007). Таким чином, як вважається, багато раків еволюціонували з однієї єдиної клітини, кількох внутрішньоклітинних H. pylori може викликати імунні, канцерогенні або інші шляхи реакції розвитку, особливо коли вони присутні в епітеліальних клітинах-попередниках, які швидко діляться (Oh та ін., 2005 рік; Семіно ‐ Мора та ін., 2007). Цей процес інтуїтивно привабливий для пояснення неопластичної трансформації епітеліальних клітин, що веде до аденокарциноми, та імуноцитів, що ведуть до MALT-лімфоми. Крім того, складні взаємодії між H. pylori а імуноцити можуть пом'якшувати імунітет хазяїна і відігравати важливу роль у стійкості бактерії.
Незважаючи на вже досягнутий прогрес, очевидно, що додатковий в пробірці і дослідження на тваринах повинні бути проведені, і спостереження повинні бути інтегровані з новими клінічними спостереженнями, перш ніж ми зможемо це встановити H. pylori інвазивність відіграє роль у патогенності бактерії, стійкості та стійкості до антибіотиків.
Подяка
Ми вдячні доктору В. Сімко за надання біоптатів шлунка від людей та доктору Семіно-Мора за надання Рис. 1. Ми також дякуємо докторам Енгстранду, Мейєру та Амієвій за те, що вони надали та дозволили нам використовувати високоякісні знімки, використані для побудови Рис. 2– 4 відповідно. Частково підтримується Національним інститутом охорони здоров’я (CA82312/AD).
- Helicobacter pylori Чи запобігає гастрит запобігання коліту
- Реактивність антитіл до хелікобактер пілорі та ризик колоректального раку в дослідженні "контроль за випадками" в
- Інфекція хелікобактер пілорі, рефлюкс-езофагіт та атрофічний гастрит Недосліджений трикутник -
- Інфекція хелікобактер пілорі та низький вміст заліза в їжі змінюють поведінку, викликають залізодефіцитну анемію,
- Інфекція хелікобактер пілорі посилює індуковану дієтою стійкість до інсуліну в поєднанні з кишечником