Глютатіон S-трансфераза P1, що регулює мікроРНК, при раку простати
Анотація
Глутатіон S-трансфераза P1 (GSTP1), фермент, що бере участь у процесі детоксикації, часто інактивується при раку передміхурової залози внаслідок епігенетичних модифікацій. За допомогою силіко-аналізу ми виявили підмножину мікроРНК (miРНК), які є передбачуваними мішенями в регуляції GSTP1. miРНК - це невеликі ендогенні некодуючі РНК, які є критичними регуляторами різних фізіологічних та патологічних процесів, і рівень їх експресії може відігравати точну роль у ранній діагностиці та прогнозуванні раку. Ці малі молекули були виявлені в широкому спектрі біологічних зразків людини, включаючи кров, сироватку, сечу, еякулят та тканини, які можуть бути використані як клінічно корисний біомаркер для раннього виявлення та прогнозування раку передміхурової залози. У цій главі узагальнено сучасні знання про мікроРНК, яка бере участь у регуляції GSTP1 при раку передміхурової залози, та їхній потенціал як корисних біомаркерів захворювання для раннього виявлення та прогнозування, а також виклики та обмеження у цьому розвитку.
Вступ
Рак передміхурової залози залишається найпоширенішою формою раку серед чоловіків у США [1]. За підрахунками Американського онкологічного товариства, у 2014 році буде діагностовано приблизно 233 000 нових випадків раку передміхурової залози, і близько 29 480 чоловіків помруть від цієї хвороби [1, 2]. Рання діагностика пухлини та своєчасне виявлення прогресування раку передміхурової залози після операції або променевої терапії мають вирішальне значення для його ефективного та корисного клінічного результату. Широке використання загального простатоспецифічного антигену (ПСА) на основі сироватки крові призвело до виявлення раку простати на потенційно виліковній стадії; однак його використання як скринінгового інструменту залишається суперечливим через відсутність справжньої точки зрізу tPSA для виявлення ризику раку передміхурової залози [3, 4]. По-перше, приблизно одна третина раку передміхурової залози, виявленого на рівні ПСА з рівнем 4 нг/мл або вище, вже поширилася на капсулу простати або більше, і приблизно 15% чоловіків з рівнем ПСА
Глутатіон S-трансферази
Глутатіон S-трансфераза пі та рак простати
Епігенетика та регуляція генів
Експресія генів складним чином регулюється за допомогою епігенетичних модифікацій, таких як метилювання ДНК, посттрансляційні модифікації білків гістонів та транскрипційна регуляція експресії генів за допомогою некодуючої регуляторної мікроРНК [42, 43]. Численні дослідження продемонстрували, що регуляторні послідовності поблизу гена GSTP1 зазвичай інактивуються гіперметилюванням ДНК на ранніх стадіях канцерогенезу простати [44, 45]. Широке метилювання нуклеотидів дезоксицитидину, розподілених по острівній області 5′CpG GSTP1, не виявляється у доброякісних тканинах передміхурової залози, але виявляється при високоякісній інтраепітеліальній неоплазії (HGPIN) та аденокарциномі простати в тканині та рідинах, включаючи плазму, сироваткові простатичні еякуляти, зразки сечі [46–48].
Модифікація гістону тісно пов’язана з метилуванням ДНК при раку передміхурової залози [49]. Дослідження продемонстрували, що гістоген-деацетилази класу I (HDAC) часто надмірно експресуються при раку передміхурової залози [50]. Дослідження демонструють, що HDAC1 сприяє агресивній поведінці пухлини та поганому прогнозу, тоді як експресія HDAC2 асоціюється із скороченим часом безрецидивного виживання у хворих на рак простати [51]. HDAC1–3 високо експресуються при раку передміхурової залози, а відповідні ураження HGPIN збігаються із втратою експресії GSTP1 у зразках пухлини [51, 52]. Лі та ін. продемонстрував, що інгібування HDAC1 маспіном, пригнічуючим пухлину серпіном, збільшує експресію GSTP1 у клітинах раку передміхурової залози, підтверджуючи, що HDAC1 відіграє вирішальну роль у опосередкованій маспіном реекспресії GSTP1 [53].
Некодуючі РНК з’явилися як новий клас ключових регуляторів генів [54, 55]. МікроРНК (miРНК) - це короткі (~ 20–24 нуклеотиди) некодуючі РНК, які регулюють експресію генів, здебільшого сприяючи розщепленню цільової мРНК у рослин [56]. Цікаво, що miРНК впливають на експресію гена-мішені переважно шляхом поступальної репресії у тварин. МіРНК націлюються на мРНК за допомогою недосконалого додаткового сполучення підстав до 3 ′ неперекладеної області (3′UTR), щоб знизити регуляцію синтезу білка цілі або шляхом деденілювання цільового повідомлення, або шляхом придушення трансляції в активно перекладаються рибосомах [57, 58]. В даний час miRBase має комбінацію з 2588 зрілих людських міРНК від геномного збору людини (GRCh 38) до GenBank [59]. За прогнозами, ці багато мікроРНК націлені на> 45 000 сайтів, на які припадає> 60% людських генів.
Потенційне регулювання GSTP1 мікроРНК
Декілька обчислювальних та експериментальних підходів були використані для ідентифікації міРНК та їх генів націлення [70 ••, 71]. Для цього дослідження ми використовували обчислювальні підходи для ідентифікації міРНК, потенційно націлених та регулюючих експресію GSTP1 (Таблиця 1). Ці мікроРНК включають miR-133a/b, miR-144/144 *, miR-153-1/2 та miR-590-3p/5p. У цій главі висвітлено короткий опис цих міРНК та їх участь у раку та регуляції GSTP1.
miR-133a/b
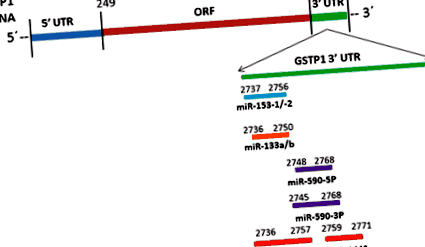
Схематичне зображення цільових місць miR-133-a/b, miR-153-1/2, miR-590-3P/5P та miR-144/144 * на GSTP1 3′UTR
miR-144/miR-144 *
miR153-1/2
miR-590-3p/5p
Бази даних мікроРНК-мішеней, такі як TargetScan та miRanda, передбачали, що miR-590-3p/5p може регулювати мРНК GSTP1 та/або експресія білка miR-590-3p утворює 7 м у положеннях 57–63 GSTP1 3′UTR. Дослідження послідовності мРНК GSTP1 показало, що потенційні мішені мішені miR-590-3p/5p виявляються у нуклеотидів 2748–2748 в області 3′UTR (рис. 1). Показано, що miR-590-3p/5p підвищує регуляцію при деяких видах раку людини, включаючи гепатоцелюлярну карциному, прозороклітинну нирково-клітинну карциному, мієлоїдний лейкоз та рак шийки матки [102–105]. Показано, що регуляція miR-590-5p сприяє проліферації та інвазії прозорих клітин нирково-клітинних клітин карциноми шляхом зниження регуляції експресії p21 (Waf1/Cip1) [103]. Також показано, що вона різницево виражається при резистентному до кастрації раку передміхурової залози порівняно з доброякісною гіперплазією передміхурової залози [106]. TargetScan передбачав PTEN як потенційні цільові гени miR-590-3p/5p, і було виявлено, що він активує сигнальний шлях PI3K-AKT шляхом зниження регулювання PTEN для сприяння фосфорилюванню AKT1-S473 [107], що може відігравати важливу роль у регуляції GSTP1 при раку простати.
Висновок, обмеження та подальший напрямок
Вимірювання рівня PSA в сироватці крові не дозволяє належним чином виявити рак передміхурової залози або передбачити прогноз після остаточної терапії. Тому існує значна проблема у розробці нових неінвазивних стратегій ідентифікації біомаркерів для точного виявлення та прогнозування прогресування раку передміхурової залози. МіРНК є важливими регуляторами генів онкогену та супресорів пухлини, які перехоплюють різні сигнальні шляхи та патологічні процеси, пов'язані з пухлиною. Численні публікації повідомляють про потенціал miRNA як класу нових біомаркерів у діагностиці та прогнозі захворювання [63–68, 69 ••]. Наш in silico аналіз припускає, що міРНК можуть виконувати свої функції, потенційно регулюючи експресію GSTP1 і відігравати важливу роль у канцерогенезі передміхурової залози (табл. 1; рис. 1). Ідентифікуючи перераховані передбачувані мікроРНК, які регулюють GSTP1, може бути розшифрована більш детальна регуляторна роль, яка може бути застосована для раннього виявлення та прогнозування раку передміхурової залози.
Однак залишаються певні обмеження щодо їх розробки та заміни звичайними біомаркерами. Сюди входить відсутність встановленого ендогенного контролю міРНК для нормалізації рівня міРНК у рідинах організму. У зв'язку з цим малу ядерну РНК U6 часто використовують для нормалізації рівня міРНК; однак його нестабільна природа та розпад у сироватці крові не кваліфікують її як ідеальний стандартний контроль. Іншим обмеженням є вивільнення мікроРНК у рідини організму, а її функціональна роль та наслідки залишаються невідомими та/або обмеженими невідповідностями в аналізі функції мікроРНК при раку передміхурової залози. Крім того, точний механізм (и) наслідків не був встановлений для багатьох мікроРНК при раку передміхурової залози, незважаючи на значні зусилля у таких дослідженнях. Тому необхідні подальші дослідження, щоб зрозуміти роль і наслідки мікроРНК при раку передміхурової залози за допомогою нових високопродуктивних методів. Ще одним застереженням, яке слід врахувати, є те, що посттранскрипційна генна регуляція міРНК, а також її цільової мРНК додатково модулюється РНК-зв’язуючими білками (RBP). Нещодавно були охарактеризовані численні RBP, і багато хто відіграє важливу роль як в стабільності мікроРНК, так і в мРНК.
На закінчення, технічний прогрес у виявленні міРНК, що регулюють експресію та функцію GSTP1, може мати великі перспективи як молекулярні біомаркери для раку простати. Подальший розвиток та застосування цих аналізів GSTP1, що регулюють міРНК, до клінічних зразків, включаючи кров, сечу, еякулят та біопсію простати для скринінгу та раннього виявлення раку, може мати великі перспективи як клінічні тести. Потрібна нова серія досліджень, що критично оцінюють прогнозні значення міРНК при раку передміхурової залози.
- Глютатіон S-трансфераза P1, що регулює мікроРНК, при раку простати
- Профілактика раку простати Медицина Джона Хопкінса
- Фактори ризику раку простати Медицина Джона Хопкінса
- Рівень простати у японців тут у 3 рази менше; s Чому
- Рак простати Керівництво для людей у віці