Гепатопротекторна дія грибів
Андрія Ассунсао Соарес
1 кафедра біохімії Державного університету м. Марінга, м. Марінга 87015-900, Бразилія; Електронні листи: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Анахаріс Бабето де Са-Наканіші
1 кафедра біохімії Державного університету м. Марінга, м. Марінга 87015-900, Бразилія; Електронні листи: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Аделар Брахт
1 кафедра біохімії Державного університету м. Марінга, м. Марінга 87015-900, Бразилія; Електронні листи: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Сандра Марія Гомес да Коста
2 Департамент біології, Державний університет м. Марінга, м. Марінга 87015-900, Бразилія; Електронна пошта: moc.liamg@15ignufardnas
Eloá Angélica Koehnlein
3 кафедра харчування, Федеральний університет Південної Кордону, Реалеза 85770-000, Бразилія; Електронна пошта: moc.liamtoh@acilegna-aole
Крістіна Джатті Марк де Суза
1 кафедра біохімії Державного університету м. Марінга, м. Марінга 87015-900, Бразилія; Електронні листи: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Розане Марина Перальта
1 кафедра біохімії Державного університету м. Марінга, м. Марінга 87015-900, Бразилія; Електронні листи: moc.liamg@7seraosadna (A.S.S.); rb.moc.lob@sirahcana (A.B.S.-N.); rb.moc.lou@thcarbeda (A.B.); rb.meu@azuosmgc (C.G.M.S.)
Анотація
Особливі особливості росту та розвитку грибів у природі призводять до накопичення різноманітних вторинних метаболітів, таких як фенольні сполуки, терпени та стероїди, та необхідних компонентів клітинної стінки, таких як полісахариди, β-глюкани та білки, деякі з яких мають біологічну активність. . У цій статті викладається та обговорюється наявна інформація про захисну дію екстрактів грибів проти пошкодження печінки, спричиненого екзогенними сполуками. Серед грибів Ganoderma lucidum є, безперечно, найбільш вивченим видом. У цьому огляді, однак, акцент був зроблений на дослідженнях з використанням інших грибів, особливо тих, які представляють зусилля, пов’язуючи гепатопротекторну активність з певними хімічними компонентами, зазвичай присутніми в екстрактах грибів.
1. Вступ
Гриби - це макрогриби з відмітними базидіоматами або аскоматами, які можуть бути як гіпогенними, так і епігеозними, досить великими, щоб їх можна було побачити неозброєним оком і взяти руками. Кількість різних видів грибів у землі, за оцінками, становить близько 140 000. За оцінками, вже описано лише 10% видів, і близько 2000 з них є їстівними. Менш ніж 25 видів в основному використовуються як продукти харчування, що виробляються в комерційних масштабах. Як їжа гриби в усьому світі цінуються за їх смак та аромат і вживаються як у свіжому, так і в обробленому вигляді. Вони бідні калоріями та багаті білками, клітковинами, вуглеводами та важливими вітамінами, такими як тіамін, рибофлавін, аскорбінова кислота та мінерали [1,2,3,4,5]. Дослідження показали, що регулярне вживання грибів або споживання ізольованих біоактивних компонентів, що містяться в грибах, є корисними для здоров'я. Зазвичай їх вважають функціональними продуктами харчування або нутрицевтичними продуктами [6,7].
Термін нутрицевтики зазвичай використовується для опису тих речовин або комбінацій речовин, які мають значний потенціал як дієтичні добавки, а також для профілактики та лікування різних захворювань людини без побічних ефектів, які часто супроводжують лікування синтетичними наркотиками. Зокрема, грибний нутрицевтик - це рафінований/частково рафінований екстрактивний речовина або з міцелію, або з базидіоми та аскоми, який споживається у формі капсули або таблетки як харчова добавка (а не як звичайна їжа) з можливим терапевтичним застосуванням [8,9, 10].
Лікарські гриби мають давню історію використання в традиційних східних терапіях, а грибкові метаболіти все частіше використовуються для лікування широкого кола захворювань [11,12]. Більше того, їстівні гриби не слід розглядати просто як їжу, оскільки було доведено, що деякі з них багаті біоактивними сполуками [13]. Гриби містять багато речовин, і деякі з них можуть мати певну біологічну активність. Довгий список включає полісахариди, фенольні речовини, білки (грибкові імуномодулюючі білки - FIP, лектини, глікопротеїни та неглікозильовані білки та пептиди), полісахаридно-білкові комплекси, ліпідні компоненти (ергостерол), а також терпеноїди, алкалоїди, малі пептиди та аміно кислоти, нуклеотиди та нуклеозиди. Цей довгий список представляє великий асортимент біологічних властивостей, які включають антиоксидант [9,14,15], протипухлинний/протираковий [16], протимікробну [13], імуномодулюючу [17], протизапальну [18,19], антиатерогенну [20 ] та гіпоглікемічні дії [21]. Крім того, повідомлялося також про гепатопротекторні властивості екстрактів грибів та молекул, отриманих з грибів [22,23]. Остання властивість - саме основна увага в цій доповіді, яка представляє та обговорює сучасні знання про гепатопротекторні властивості грибів та молекул, отриманих з грибів.
2. Печінка та біомаркери гепатоксичності
Печінка - великий, складний орган, який добре розроблений для своєї центральної ролі у вуглеводному, білковому та жировому обміні. Тут відбувається детоксикація відходів метаболізму, таких як аміак. У поєднанні з селезінкою він бере участь у руйнуванні залишків еритроцитів та у переробці їх складових. Він відповідає за синтез і секрецію жовчі, а також за синтез ліпопротеїнів і білків плазми, включаючи фактори згортання крові. Він підтримує стабільний рівень глюкози в крові, приймаючи і зберігаючи глюкозу у вигляді глікогену (глікогенез), розщеплюючи її до глюкози, коли це потрібно (глікогеноліз) і утворюючи глюкозу з невуглеводних джерел, таких як амінокислоти (глюконеогенез). Печінка також відіграє важливу роль у виведенні та детоксикації наркотиків, і пошкодження печінки може бути спричинене багатьма ксенобіотиками, такими як алкоголь та багато ліків, недоїдання, інфекції та анемія [24,25]. Пошкодження печінки - широко розповсюджене захворювання, яке в більшості випадків включає окислювальний стрес і характеризується поступовою еволюцією від стеатозу до хронічного гепатиту, фіброзу, цирозу та гепатоцелюлярної карциноми [26].
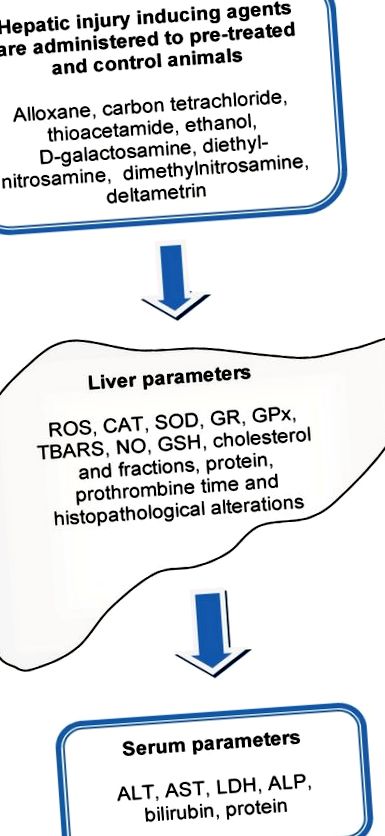
Загальна схема, що використовується для оцінки гепатопротекторної здатності природного екстракту або виділеної молекули, показана на малюнку 1. Гепатотоксичність визначається як пошкодження печінки, яке пов’язане з порушенням функції печінки, спричиненим впливом лікарського засобу чи іншого неінфекційного агента [27]. Гепатотоксичні агенти можуть реагувати з основними клітинними компонентами і, отже, спричиняти майже всі типи уражень печінки. Травма печінки, гостра чи хронічна, врешті-решт призводить до збільшення концентрації амінотрансфераз у сироватці крові: аспартатамінотрансферази (AST) та аланінамінотрансферази (ALT). AST та ALT - це ферменти, які каталізують перенесення α-аміногруп з аспартату та аланіну в α-кето групу кетоглутарової кислоти для утворення відповідно оксалооцтової та піровиноградної кислот, які є важливими компонентами циклу лимонної кислоти.
Загальна схема, що використовується для оцінки гепатозахисних ефектів сирих або напівочищених екстрактів та ізольованих молекул. Тварин обробляють протягом певного періоду з можливим гепатозахисним агентом. Поразка індукується введенням агента, що викликає пошкодження печінки. Кілька біомаркерів гепатотоксичності оцінюють у печінці та сироватці оброблених та необроблених тварин. TBARS: речовини, що реагують на тіобарбітурову кислоту; АФК: реактивні форми кисню; КАТ: каталаза, СОД: супероксиддисмутаза; GR: глутатіонредуктаза; GPx: пероксидаза глутаціону; НІ: оксид азоту; GSH: глутатіон; АЛТ: аланінамінотрансфераза; AST: аспартатамінотрансфераза; ЛДГ: лактатдегідрогеназа; AP: лужна фосфатаза.
Обидві амінотрансферази сильно концентруються в печінці. АСТ також дифузно представлений у серці, скелетних м’язах, нирках, мозку та еритроцитах. АЛТ присутній лише у низьких концентраціях у скелетних м’язах та нирках. Отже, підвищення рівня АЛТ у сироватці крові є більш конкретним показником ураження печінки. У печінці АЛТ локалізується виключно в клітинній цитоплазмі, тоді як АСТ становить 20% цитозольної та 80% мітохондріальної [28]. В даний час доклінічні аналізи включають деяку комбінацію активності AST, ALT, лужної фосфатази (ALP) та лактатдегідрогенази (LDH) у плазмі на додаток до рівня білірубіну та альбуміну. Гістологічний аналіз печінкової тканини також зазвичай використовується для оцінки гепатопротекторної дії екстрактів та ізольованих сполук. Серед цих аналізів деякі є більш специфічними та/або чутливими, ніж інші для виявлення токсичності печінки [29].
Залучення вільних радикалів до патогенезу пошкодження печінки досліджувалося протягом багатьох років [30]. Різні експериментальні дослідження показали, що токсини та наркотики викликають накопичення активних форм кисню (АФК), таких як супероксид, гідроксильний радикал та перекис водню в гепатоцитах. Це накопичення АФК є основною причиною окисного стресу, дисбалансу між підвищеним впливом вільних радикалів та антиоксидантним захистом. Останні містять як антиоксиданти з невеликою молекулярною масою, такі як глутатіон, так і антиоксидантні ферменти. Антиоксидантними ферментами є каталаза (CAT), супероксиддисмутаза (SOD), глутатіонредуктаза (GR) та глутатіонпероксидаза (GPx) (рисунок 1). Вільні радикали завдають безпосередньої шкоди критичним біомолекулам, включаючи ДНК, ліпіди та білки, отже, травмуючи гепатоцити [31]. Коли АФК розкладають поліненасичені ліпіди, відбувається підвищення клітинного малонового діальдегіду (МДА). Виробництво цього альдегіду, який в цілому визначається як реакційноздатні речовини тіобарбітурової кислоти (TBARS), часто використовується як біомаркер для вимірювання перекисного окислення ліпідів та рівня окисного стресу в організмі [32].
Наявність окисного стресу можна перевірити одним із трьох способів: (1) пряме вимірювання АФК; (2) вимірювання ступеня пошкодження біомолекул; та (3) кількісне визначення природних молекул антиоксидантів. Пряме вимірювання АФК може здатися кращим методом, але багато активних форм кисню надзвичайно нестабільні і їх важко виміряти безпосередньо. Через це багато дослідників воліють вимірювати пошкодження білків, ДНК, РНК, ліпідів або інших біомолекул. Хоча це непрямий підхід, багато маркерів пошкодження є значно стабільними, а отже, забезпечують більш надійний метод вимірювання окисного стресу. Інший підхід полягає у вимірюванні рівня антиоксидантних ферментів та інших окисно-відновних молекул, які можуть врівноважити АФК, що утворюються в клітині. Доступні аналізи для вимірювання активності специфічних антиоксидантних ферментів, таких як каталаза та супероксиддисмутаза. Крім того, існують аналізи, які можуть перевірити антиоксидантну здатність певних біомолекул та харчових екстрактів.
3. Основні гепатотоксичні засоби, що застосовуються в гепатопротекторних дослідженнях
Токсини та наркотики є одними з основних етіопатогенетичних агентів гострої печінкової недостатності в західних країнах [33]. Тим не менше, хімічні токсини (включаючи ацетамінофен, тетрахлорид вуглецю, тіоацетамід, етанол, d -галактозамін, діетилітрозамін та диметилнітрозамін) часто використовуються як модельні речовини, що викликають експериментальне пошкодження гепатоцитів як в умовах in vivo, так і in vitro [10,34,35,36, 37,38,39,40,41,42,43,44,45,46,47].
У печінці CCl4 метаболічно активується під дією цитохрому P450-залежних змішаних оксидаз в ендоплазматичному ретикулумі, утворюючи радикал CCl3, який поєднується з клітинними ліпідами та білками в присутності кисню, викликаючи перекисне окислення ліпідів шляхом абстракції водню [48,49]. Це призводить до структурних змін в ендоплазматичному ретикулумі та інших мембранах і втрат в активації метаболічних ферментів з подальшим порушенням функцій печінки.
Етанол, жиророзчинний неелектроліт, який легко всмоктується, швидко дифундує в циркуляцію і рівномірно розподіляється по тілу. Етанол майже виключно метаболізується в організмі за допомогою окисних процесів, що каталізуються ферментами. Утворений на першій стадії ацетальдегід далі окислюється до ацетату, який потім перетворюється в діоксид вуглецю за допомогою циклу лимонної кислоти. Етанол або його метаболіти також можуть спричинити автоокислення печінкових клітин, діючи як прооксидант, або зменшуючи рівень антиоксидантів, що призводить до помітної гепатотоксичності [50]. Перекисне окислення ліпідів та пов'язане з цим пошкодження мембрани є ключовою особливістю алкогольної травми печінки, що спричиняє фіброз печінки, що призводить до розвитку незворотного цирозу.
N-галактозамін (d -GalN) є одним з найкорисніших експериментальних гепатотоксинів для скринінгу та дослідження гепатопротекторних препаратів. Гепатотоксичність d -GalN пояснюється його метаболізмом у печінці, що спричинює зменшення кількох нуклеотидів урацилу. В результаті він пригнічує синтез РНК і білків і порушує біосинтез глікопротеїнів, що погіршує клітинні мембрани [62,63]. Останнє, в свою чергу, порушує гомеостаз кальцію та дихання мітохондрій [64] і призводить до надмірного утворення АФК. Один з найважливіших антиоксидантних ферментів у гепатоцитах, СОД, вичерпується, і накопичення АФК посилює пошкодження гепатоцитів та мітохондрій, що призведе до витоку АСТ та АЛТ [65,66].
Тіоацетамід, селективний гепатотоксин, добре відомий як індуктор печінкової недостатності протягом короткого періоду часу після введення препарату [67]. Він зазнає значного метаболізму до ацетаміду та тіоацетаміду S-діоксиду за допомогою оксидазної системи зі змішаною функцією [68]. S-діоксид тіоацетаміду є високореакційною сполукою [69,70]. Його зв'язування з тканинними макромолекулами викликає некроз печінки [70].
4. Отримання екстрактів грибів: Базидіома або аскома проти біомаси міцелії
- Гепатопротекторні ефекти Erythrina abyssinica Lam Ex Dc проти безалкогольної жирної печінки
- Гіпохолестеринемічні та гепатопротекторні ефекти олії авокадо незайманої сировини в раціоні харчування
- Гепатопротекторні та метаболічні ефекти дієтичних соєвих фітоестрогенів проти гіперкалорійної дієти у
- Гепатопротекторна та протизапальна дія загальних флавоноїдів Qu Zhi Ke (шкірка цитрусових
- Діаграма глікемічного індексу та ефекти їжі з низьким та високим вмістом страв dLife