Електроакупунктура пригнічує збільшення ваги у щурів із ожирінням, спричинених дієтою, активуючи передачу сигналів гіпоталамусу LKB1-AMPK
Анотація
Передумови
Повідомляється, що електроакупунктура (ЕА) є ефективним засобом лікування ожиріння, проте її механізм незрозумілий. Це дослідження мало на меті дослідити взаємозв'язок між сигналами гіпоталамусу LKB1-AMPK-ACC та ЕА.
Методи
П'ятдесят самців щурів Спраг-Доулі були розділені на дві групи, яких годували або чау (група, що годувала чау), або дієта з високим вмістом жиру (група ВЧ). Після 4 тижнів годування щурів із ожирінням у групі із СН (визначено як вага 20% або більше, ніж щури в групі, що годували чау) випадковим чином розподіляли в групу ожиріння, спричинену ЕА або дієтою (DIO). Група EA отримувала EA на двосторонньому рівні ST25 – ST36 протягом 4 тижнів, тоді як група DIO не отримувала подальшого втручання. Масу тіла груп, що годували чау, DIO та EA, вимірювали щотижня. Рівні мРНК та білка в сигнальному шляху гіпоталамусу LKB1-AMPK-ACC були виявлені за допомогою реального часу (RT) -PCR та вестерн-блот відповідно.
Результати
Через 4 тижні лікування ЕА тенденція зростання ваги щурів у групі ЕА була загальмована порівняно з такою в групі ДІО. RT-PCR та вестерн-блоттінг показали, що ЕА підвищує транскрипцію аденозин 5'-монофосфат-активованої протеїнкінази α2 (AMPKα2), сприяє експресії білка печінкової кінази B1 (LKB1) та AMPKα1 та інгібує білок ацетил-КоА карбоксилази (ACC) експресія в гіпоталамусі.
Висновки
Це дослідження припускає, що передача сигналів гіпоталамусу LKB1-AMPK-ACC відіграє важливу роль у лікуванні ожиріння ЕА при ожирінні.
Передумови
Ожиріння є світовою проблемою охорони здоров'я і може призвести до таких захворювань, як ішемічна хвороба серця, діабет та деякі види раку [1]. Було проведено кілька досліджень щодо стримування зростаючої кількості ожиріння, але ефективних фармакологічних методів лікування небагато. Тільки три препарати схвалено Управлінням з контролю за продуктами та ліками США для тривалого лікування ожиріння, а саме лоркасерин (Belviq), фентермін плюс топірамат (Qsymia) та орлістат (Xenical, Alli) [2].
Акупунктура є однією з найпопулярніших альтернативних методів лікування, і вона використовується для лікування ожиріння протягом тисячоліть. Електроакупунктура (ЕА) - це поширена форма акупунктури, при якій електричний струм проходить через голки для акупунктури. Параметри ЕА можна точно охарактеризувати, тому він відтворюваний, і дані свідчать про те, що ЕА може бути ефективнішим, ніж акупунктура вручну [3]. Недавні систематичні огляди вказують на те, що ЕА є ефективним засобом лікування ожиріння [4]. Однак механізм ЕА щодо ожиріння потребує подальшого дослідження. Є дані, що вказують на те, що ЕА може пригнічувати апетит для контролю ваги. Можливі механізми, що лежать в основі впливу ЕА, спрямовані на гіпоталамус [5, 6].
Гіпоталамус регулює споживання їжі та енергетичний баланс. Гіпоталамічна аденозин 5 ′ монофосфат-активована протеїнкіназа (АМФК) визнана датчиком поживних речовин та глюкози в центральній нервовій системі та регулятором апетиту [7, 8]. Кіназа печінки B1 (LKB1) є основною кіназою вгору за течією каскаду AMPK. LKB1 є конститутивно активним і фосфорилює AMPK у Thr172 α-субодиниці [9–11]. Активація AMPK скасовується в клітинах, у яких відсутня експресія LKB1, або у гризунів після делеції LKB1 [12, 13]. Одним із механізмів, за допомогою якого AMPK регулює метаболізм ліпідів, є фосфорилювання та інактивація ацетил-КоА-карбоксилази (АСС), важливого ферменту, що обмежує швидкість синтезу малоніл-КоА [14]. АСС є одночасно попередником біосинтезу жирних кислот та інгібітором довголанцюгового транспорту жирного ацил-КоА до мітохондрій для β-окислення [15]. Повідомлялося, що нокдаун/нокаут ACC1 та ACC2 спричиняє постійне окиснення жирних кислот, збільшує витрати енергії та зменшує масу жиру [16, 17].
Кілька досліджень вивчали взаємозв'язок між EA та AMPK. Томінага та ін. [18] припустив, що повторна терапія ЕА може покращити індуковану дієтою інсулінорезистентність, можливо, через активацію сигналу AMPK в скелетних м'язах. Відразу після стимуляції ЕА фосфо-AMPKα (Thr172) був значно вищим у тварин, які отримували ЕА, ніж у контрольних тварин. Кім та ін. [19] показали, що рівні експресії гена AMPK в гіпоталамусі щурів визначають індивідуальні відмінності в чутливості до знеболюючої дії, спричиненої ЕА. Однак ретельних досліджень ЕА та AMPK в гіпоталамусі не проводилось.
На основі моделі, спричиненої ожирінням (DIO) на щурах, ми спостерігали, чи може ЕА пригнічувати набір ваги у щурів, отримуючи ВЧ-дієту. Ми також дослідили роль сигналізації гіпоталамусу LKB1-AMPK-ACC у патології ожиріння та механізмі лікування ЕА.
Методи
Тварини та експериментальний протокол
54-тижневі самці щурів Sprague – Dawley (80–100 г) були отримані компанією Dossy Experimental Animals Company (Ченду, Китай). Тварин утримували в приміщенні з температурою навколишнього середовища (22 ± 2 ° C) і витримували протягом 12/12 годин циклів світло-темно (світло вмикалося з 07:00 до 19:00). Для адаптації до нового середовища всіх щурів годували стандартною лабораторною чау і доступною водою ad libitum протягом першого тижня експерименту. Тварин випадковим чином поділяли на дві групи: групу, яку годували чау, та групу з високим вмістом жиру (СН). Групі, яку годували чау (n = 13), давали стандартну лабораторну чау (Dossy Experimental Animals Company, 3,80 ккал/г), що складається з 5% жиру, 55% вуглеводів, 22% білка, 7% золи та 5% клітковини. Групі з ВЧ (n = 35) була призначена ВЧ дієта (4,72 ккал/г), що складається з 22% жиру, 39% вуглеводів, 23,7% білка, 4% золи та 3% клітковини. ВЧ-їжу виготовляли в лабораторії авторів. Кожні 100 г HF їжі складалися з основних кормів (57,5 г), яєчного порошку (11,79 г), свинячого жиру (10 г), солі свинячої жовчі (0,2 г), казеїну (7 г), потужності молока (13 г), сіль (0,085 г) та дріжджовий порошок (0,425 г). Вагу тіла контролювали один раз на тиждень о 09:00.
Після годування протягом 4 тижнів 24 щури, які харчувались ВЧ-дієтою, набирали вагу на 20% і більше вище середньої ваги щурів у групі, яку годували чау, і визначали як ожиріння. Потім цих щурів випадковим чином розподіляли в групу ЕА, яка отримувала стимуляцію ЕА протягом чотирьох тижнів, і в групу ДІО, яка не отримувала подальшого лікування, по 12 щурів у кожній групі. Групи, що годували ЕА, ДІО та чау, розміщувались індивідуально та годували їх відповідними дієтами. Споживання їжі та вага тіла вимірювали щодня протягом 4 тижнів. Гіпоталамі збирали в кінці дослідження. Дослідження було схвалено Інституційним комітетом з догляду та використання тварин Університету традиційної китайської медицини Ченду, і всі процедури проводились відповідно до Рекомендацій з експериментів на тваринах та догляду за тваринами Китайської академії наук.
Лікування ЕА
Щурів у трьох групах свідомо утримували у пластиковому тримачі. Групу ЕА лікували ЕА двосторонніми акупунктурами Тяньшу (ST25) та Зусанлі (ST36) протягом 20 хв з 8:00 до 12:00 ранку, один раз на день, 6 днів на тиждень, протягом чотирьох тижнів. Голками були одноразові стерильні голки з нержавіючої сталі діаметром 0,30 мм і довжиною 25 мм (Suzhou Hua Tuo Medical Instruments Co. Ltd, Сучжоу, Китай). Очки вибирали на основі стандартів для щурів, як зафіксовано в експериментальній акупунктурі та прижиганні [20]. Тяньшу (ST25) знаходиться на 5 мм поперек від пупка (5 мм поперек перетину між верхніми 2/3 і нижніми 1/3 на лінії між мечоподібним відростком і верхньою межею лобкового симфізу). Зусанлі (ST36) знаходиться між гомілкою і малогомілковою кісткою приблизно на 5 мм збоку і на 5 мм нижче від переднього горбка гомілки. Точкові точки стимулювались безперервно-хвильовим електричним стимулом з інтенсивністю 2 мА та частотою 3 Гц протягом 20 хв, щоб викликати легкі посмикування в кінцівках. Використовували прилад E6 G6805-II (№ 20101 014, Циндао Сіньшен, ТОВ, Циндао, Китай). Щурів у групах, що годували чау і ДІО, стримували протягом 20 хв без стимуляції ЕА. Під час лікування щури не виявляли болю та дискомфорту.
Усі експериментальні щури голодували протягом 10 год після останнього втручання та реєстрували масу їх тіла (г). Під 20% уретановою анестезією (0,8 г/кг) щурів евтаназували. Потім тканини гіпоталамусу розтинали для подальших досліджень.
Вестерн-блот-аналіз
Гіпоталами розтинали, використовуючи оптичний хіазм як ростральний орієнтир, а тіла ссавців каудально на глибину 2 мм. Розсічені гіпоталами негайно заморожували в рідкому азоті. Тканини гомогенізували в крижаному буфері для лізису, що містив 0,1% SDS, 10 мМ Tris – HCl (pH 7,4), 1% Triton X-100, 1 мМ MgCl2 і 1% NP-40. Гомогенати центрифугували при 10000 g протягом 10 хв при 4 ° C супернатанти видаляли і аликвоти швидко заморожували в рідкому азоті. Лізат гіпоталамуса (40 мкл) піддавали електрофорезу додецилсульфату натрію - електрофорезу в поліакриламідному гелі (SDS-PAGE) на 6% поліакриламідних гелях та електротрансформували на нітроцелюлозній мембрані (Millipore, Massachusetts, USA).
Мембрани блокували на 1,5 год у розчині для оптимізатора оптимізатора техніки перенесення бичачого лакто (50 мМ Трис [рН 8,0], 2 мМ CaCl2, 0,01% Піногасник А, 0,02% NaN3 і 0,05% Твін 20), що містить 5% знежиреного молока. Потім мембрани досліджували при температурі 4 ° C у буферному сольовому розчині Tris 20 і Tween 20 (TBST) протягом ночі з відповідним розведенням зазначених антитіл проти LKB1 (Abcam, Кембридж, Великобританія), ACC (Abcam, Cambridge, UK), p-AMPKα1 (Abcam, Кембридж, Великобританія), AMPKα1 (Saierbio, Тяньцзінь, Китай), p-AMPKα2 (Abcam, Cambridge, Великобританія), AMPKα2 (Saierbio, Тяньцзінь, Китай) та GAPDH (Saierbio, Тяньцзінь, Китай).
Виявлення білків проводили за допомогою пероксидази хрону - кон'югованих вторинних антитіл (козячі анти-кролячі антитіла, Саєрбіо, Тяньцзінь, Китай) та посиленого хемілюмінесцентного реагенту (Western Lightning-ECL; Perkin Elmer, Waltham, MA, USA), потім піддавали дії плівки . Інтенсивність білкових смуг визначали за допомогою програмного забезпечення Lab Works 4.0 (UVP Inc., Upland, CA, USA).
Вилучення РНК та ПЛР у режимі реального часу
Статистичний аналіз
Усі експериментальні дані виражаються як середні значення ± стандартні відхилення. Статистичний аналіз проводили SPSS Statistics для Windows, версія 20.0 (IBM, Armonk, NY, USA) та односторонній ANOVA для порівняння між групами. Для всіх аналізів, P
Результати
ЕА пригнічує збільшення ваги за допомогою ВЧ-дієти
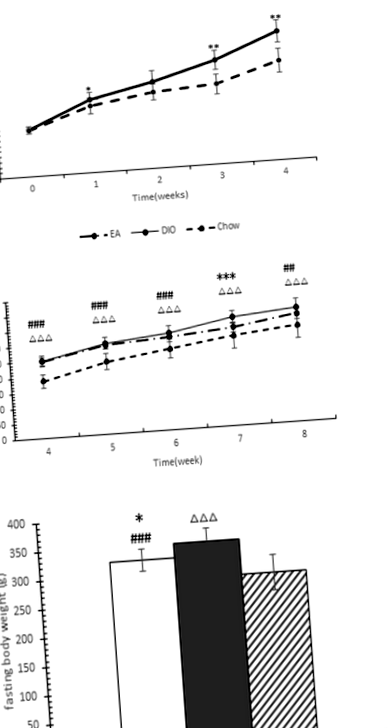
Малюнок 1а показує, що щури в групі, що годувались ВЧ, набирали більше маси тіла, ніж у щурів, яких годували чау протягом 4 тижнів. Відмінності у масі тіла були помітні з 1 тижня, але були значними через 4 тижні. 24 щури, які харчувались ВЧ-дієтою, ожиріли (набрали на 20% і більше ваги вище середньої ваги щурів у групі, що годували чау), і наприкінці 4 тижнів їх розділили на дві групи. У групі DIO було 12 щурів, а в групі EA - 12 щурів.
Малюнок 1b показує, що лікування ЕА пригнічує збільшення маси тіла щурів, які харчуються ВЧ-дієтою. Найбільш суттєві відмінності між групами ЕА та ДІО спостерігались на сьомому тижні (Р = 0,001), хоча вага тіла між цими двома групами суттєво не відрізнявся (на 5,49% нижче у групі ЕА, Р = 0,129) наприкінці експерименту. Малюнок 1c показує, що щури групи EA мали значно нижчу масу тіла порівняно з групами DIO після голодування протягом 10 годин (P = 0,027).
Вплив ЕА на сигналізацію гіпоталамусного AMPK
Малюнок 2а показує, що щури, які харчувались ВЧ-дієтою, мали нижчу експресію LKB1 (P = 0,000), AMPKα1 (P = 0,020) та AMPKα2 (P = 0,000), і значно вищу транскрипцію ACC (P = 0,024), ніж щури в група, що годується чау. Група EA мала приблизно на 48,03% більше AMPKα2 (P = 0,000) і на 13,59% менше транскриптів AMPKα1 іРНК (P = 0,000), ніж у групі DIO.
Малюнок 2b показує, що високочастотна дієта може пригнічувати вміст білка LKB1 (P = 0,000), AMPKα1 (P = 0,019), pAMPKα1 (P = 0,000) та pAMPKα2 (P = 0,000), а також збільшувати вміст ACC (P = 0,005). Група EA мала на 182,89% вищий рівень LKB1 (P = 0,000), 135,42% вищий pAMPKα1 (P = 0,002) та 84,27% нижчий рівень АСС (P = 0,003), 19,72% нижчий рівень білка AMPKα2 (P = 0,007), ніж у Група DIO.
Обговорення
Ми спостерігали, що після 4 тижнів ВЧ дієти майже 50% щурів страждали ожирінням. Під час 4-тижневого лікування ЕА щури в групі ЕА набирали вагу повільніше, ніж у групі ДІО, починаючи з третього тижня. RT-PCR та вестерн-блот показали, що передача сигналу LKB1-AMPK у гіпоталамусі інгібується ВЧ-дієтою, а АСС значно регулюється. ЕА може підвищувати транскрипцію AMPKα2, сприяти експресії білка LKB1 та AMPKα1 та інгібувати експресію білка АСС для контролю над збільшенням ваги.
AMPK широко експресується в нейронах та астроцитах гіпоталамуса та заднього мозку, які є сферами, що беруть участь у споживанні їжі [21]. За нормальних фізіологічних умов гіпоталамусний АМФК може активуватися шляхом вливання 5-аміноімідазол-4-карбоксаміду 1-β-D-рибофуранозиду (AICAR) у третій шлуночок, що значно збільшує споживання їжі [22]. Експресія домінуючого негативного AMPK в гіпоталамусі може зменшити споживання їжі та масу тіла [23].
Годування мишей ВЧ-дієтою призведе до порушення регуляції сигнального шляху AMPK, що пов’язано з порушенням фосфорилювання AMPK та зниженою регуляцією експресії білка в скелетних м’язах, печінці та гіпоталамусі [24–27].
У патологічних умовах на різних моделях гризунів встановлено сильну кореляцію між низьким станом активації АМФК та порушеннями обміну речовин, такими як ожиріння, резистентність до інсуліну та сидяча активність [28, 29]. Тому миші, у яких відсутній AMPK, можуть бути більш чутливими до шкідливих наслідків надмірного харчування [30]. Відповідно до цієї гіпотези, абляція активності AMPKα2 у всьому тілі посилює ожиріння, спричинене ВЧ-дієтою, тоді як рівень утилізації глюкози подібний до рівня мишей дикого типу [31].
Як один з найважливіших регуляторів енергетичного балансу, АМФК має тісний взаємозв'язок з багатьма гормонами, пов'язаними з метаболізмом, особливо адипоцитокінами, такими як лептин, адипонектин та апелін. За фізіологічних обставин лептин [32] чинить інгібуючу дію на AMPK в гіпоталамусі, стимулюючи АСС і згодом пригнічуючи споживання їжі, тим часом конститутивна активація гіпоталамусного AMPK порушує анорексигенний ефект лептину. Крім того, пригнічення гіпоталамусового АСС послаблює опосередковане лептином пригнічення споживання їжі та збільшення маси тіла [33]. Пізніше було показано, що mTOR/S6K регулює прийом їжі через опосередковане лептином інгібування AMPK у гіпоталамусі [34]. Сигналізація AMPK [35] також регулювала вироблення адипонектину, модулюючи експресію його рецепторів і самого себе. Апелін [36] є адипоцитокіном, відомим своїми властивостями проти ожиріння та протидіабетичними властивостями. Апелін сприяє експресії антиоксидантних ферментів та пригнічує експресію прооксидантного ферменту шляхом AMPK.
Таким чином, AMPK став новою перспективною метою для лікування метаболічних розладів, включаючи ожиріння, діабет 2 типу та серцево-судинні захворювання. Активація AMPK за допомогою AICAR може збільшити поглинання глюкози та окислення жирних кислот у гризунів із діабетом із ожирінням [37, 38] та людей [39–43], що підтверджує терапевтичний потенціал активатора AMPK.
pAMPK - це активований стан AMPK, який фосфорилюється на залишку треоніну 172 (Thr-172) в α-субодиниці висхідними кіназами, такими як LKB1 [44]. Поєднання алостеричного та фосфорилюючого ефектів спричинює більш ніж у 1000 разів збільшення активності кінази (порівняно з менш ніж у 5 разів лише для алостеричної активації). Ця реакція забезпечує високу чутливість у відповідях на незначні зміни клітинного енергетичного стану [45]. Активований АМФК каталізує дефосфорилювання АСС, потім підвищує рівень гіпоталамусу малоніл-КоА, що призводить до придушення споживання їжі та, можливо, збільшення витрат енергії [46].
Наші результати демонструють, що щури ЕА мали значно вищий рівень білка LKB1 та pAMPKα1 порівняно з щурами DIO. Отже, ЕА може сприяти активності гіпоталамусового АМФК, збільшуючи рівень його фосфорилювання, і цей ефект може індукуватися збільшенням його вищої кінази, LKB1. Тим часом зниження рівня білка АСС може бути результатом активації AMPK. Зміни в сигнальному шляху гіпоталамуса LKB1-AMPK-ACC можуть сприяти впливу ЕА на уповільнення збільшення ваги у щурів, що отримують ВЧ-дієту. Однак цю гіпотезу слід дослідити далі, можливо, на моделях щурів-гіпоталамусів LKB1 та AMPK.
Ми вибрали ST36 і ST25 як точкові точки в цьому дослідженні з кількох причин. По-перше, попереднє дослідження показало, що лікування ЕА на цих точкових точках суттєво зменшило споживання їжі та масу тіла [60, 61]. По-друге, ці дві акупунктури найбільш часто використовуються іншими для лікування ожиріння або в дослідженнях на тваринах, або в клінічних дослідженнях [62]. По-третє, повідомлялося, що стимуляція цих акупунктур посилювала експресію AMPK в деяких тканинах [18, 19]. Однак кілька звітів показали, що EA ST36 може певною мірою посилити апетит [63], але більше досліджень свідчить, що EA ST36 суттєво пригнічує годування та збільшення маси тіла [64–69]. Можливими механізмами є регульовані вниз орексигенні пептиди, такі як нейропептид Y (NPY) [64], підвищений рівень регуляції анорексигенних гормонів, включаючи проопіомеланокортин (POMC) [65], α-меланоцит-стимулюючий гормон (α-MSH) [66], і холецистокінін (CCK) [67–69]. Тим не менше, існують інші акупунктури, що використовуються для лікування ожиріння, подальші дослідження повинні перевірити, чи стимулювання інших акупунктур діє за подібним механізмом, як стимуляція ST36 і ST25.
Висновки
Дисрегуляція сигналізації гіпоталамусу LKB1-AMPK-ACC була виявлена у щурів DIO. Лікування ЕА може пригнічувати збільшення ваги у щурів DIO, які харчуються ВЧ дієтою. RT-PCR та вестерн-блоттінг показали, що ЕА може діяти шляхом регуляції транскрипції AMPKα2, стимулювання експресії білка LKB1 та AMPKα1 та інгібування експресії білка ACC для контролю енергетичного балансу. Це дослідження припускає, що передача сигналів гіпоталамусу LKB1-AMPK-ACC відіграє важливу роль у лікуванні ожиріння ЕА при ожирінні.
- Депомедроксипрогестерон ацетат, збільшення ваги та аменорея серед підлітків із ожирінням та дорослих жінок
- Зміни в експресії гена жирової тканини людини під час схуднення, спричиненого дієтою - FullText -
- Характеристика режимів харчування у дорослих з нормальною вагою, що страждають метаболізмом, (Корейська національна
- Дієта, харчування та профілактика надмірної ваги та ожиріння - PubMed
- Від анорексичної до ожиріння до здорової Неймовірні фотографії відображають надзвичайні коливання ваги жінки