Екологія годівлі
Пов’язані терміни:
- Ракоподібні
- Екологія
- Прісноводна біологія
- Підземні води
- Безхребетні
- Карст
- Мікробіологія
Завантажити у форматі PDF
Про цю сторінку
Малі фізичні процеси та біологія планктону *
Турбулентність та репродуктивна екологія
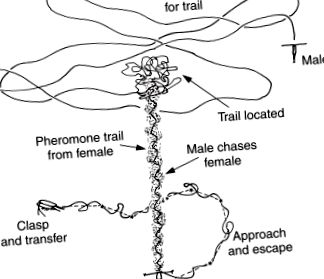
На додаток до впливу на екологію харчування, турбулентність також, як видається, відіграє роль у розмноженні зоопланктону. Недавня робота показала, що самці деяких видів копепод знаходять собі партнерів, слідуючи хімічним «слідам запаху», залишеним самками. Відеографічні спостереження з високою роздільною здатністю показують, як самець плаває туди-сюди, поки він не перетне сліди запаху, після чого він негайно змінює напрямок, щоб знову взяти слід. Зачепившись на слід, самець слідує ним назад до самки (рис. 3). Якщо самець спочатку йде неправильним шляхом по стежці, він швидко змінює напрямок і йде правильним шляхом, поки не дійде до самки.
Малюнок 3. Концептуальна інтерпретація поведінки залучення та пошуку партнера у копеподів Calanus marshallae. Послідовність подій спочатку включає самку, що виробляє феромоновий слід, який попереджає самця про те, що самка знаходиться в цьому районі. Спочатку самець плаває плавними горизонтальними петлями, поки не перетне слід. У цей момент самець йде слідом назад до самки. (Перемальовано від Цуди та Міллера (1998) та використано з ласкавого дозволу авторів.).
Турбулентність вступає в дію, оскільки запашні сліди зберігаються лише кілька секунд, перш ніж розсіюватись дрібними турбулентними рухами, що ускладнює пошук самками самців. Хоча це ще не підтверджено в лабораторії, це може частково пояснити, чому багато зоопланктону утворюють щільні рої під час спарювання. Якщо самці бажають успішно знайти самок по запашних слідах, можна передбачити, що шлюбні рої повинні бути досить щільними, щоб час, необхідний для випадкового зустрічі запашних слідів, був меншим, ніж час, необхідний для розвіювання слідів. Також відомо, що види копепод, які зазвичай населяють приповерхневі шари океану, часто опускаються на глибину до сотень метрів для розмноження. Чи можливо, що така поведінка частково є відповіддю на потребу у відносно спокійних водах, щоб дозволити самцям відстежувати самок до того, як сліди запаху розсіюються дрібними турбулентними рухами?
Припливні риби *
Екологія годівлі та вплив хижацтва
Припливні риби не є більш спеціалізованими чи узагальненими за своїм харчуванням та екологією живлення, ніж риби, що припливають. Більшість з них - м’ясоїдні або всеїдні, а деякі - рослиноїдні. Здається, що рослиноїдні тварини рідше зустрічаються у вищих широтах, але все ще чекають задовільного пояснення цього явища. У деяких випадках раціон змінюється залежно від розміру, так що наймолодші стадії є хижими, але більша кількість водоростей включається в раціон у міру зростання риби. Невеликий розмір більшості риб, що постійно мешкають, також означає, що їх раціон складається з дрібних предметів, таких як копеподи та амфіподи. Як і у багатьох інших дрібних риб, вони також можуть харчуватися частинами більших тварин, такими як кругообіг або сифон двостулкових молюсків - форма перегляду, яка не знищує здобич. Неясно, якою мірою припливні риби впливають на чисельність своєї здобичі та на структуру припливних спільнот. В деяких районах не виявлено впливу, тоді як в інших риба може мати помітний вплив, особливо на розмір та видовий склад проміжних водоростей. Ті види, які лише потрапляють у припливну зону, щоб прогодувати свій внесок, сприяють експорту енергії з цієї області у глибші води.
Plecoptera (кам'яні мухи)
Екологія
Харчування та трофічні взаємодії: Більшість відомостей про екологію харчування кам’яних мух походить від німфальних досліджень у Північній півкулі та розпорошених робіт в інших місцях. На даний момент достатньо відомо, що більшість сімейств кам’янистих є нежиттєздатними, живлячись грубим і дрібним відмерлим рослинним матеріалом та пов’язаними з ними біоплівками. Ці фільми, мабуть, є найбільш поживним компонентом дієти для детритиворів. До підтверджених детритоядних належать сімейства Capniidae, Nemouridae, Leuctridae, Notonemouridae, Scopuridae, Taeniopterygidae, Austroperlidae і Diamphipnoidae (дерев’яні рубильники), Gripopterygidae (деякі винятки), Pteronarcyidae та Peltoperlidae. До хижаків належать хлороперліди, евстенії, перліди, перлодії та стилоперліди. Деякі Isoperla (Perlodidae) мають ротовий апарат, але деякі їдять детрит протягом усього свого розвитку. Інші переживають онтогенні зміни в дієті, переходячи через детрітиви, всеїдні та м’ясоїдні.
Харчування дорослих рідко вивчається детально. Годування відоме значною кількістю шкідливих видів. Відомо, що Leuctridae, Nemouridae та Capniidae їдять ціанолічени, синьо-зелені водорості, а також гіфи та спори аскоміцетів. Taeniopterygidae, здається, єдина сім'я, дорослі особини якої харчуються живою судинною рослинною тканиною, причетні до пошкодження квітів та листя плодових дерев. Харчування в сімействах хижих, очевидно, обмежене хлороперлідами та перлодідами, які переважно поглинають пилок різних типів, дрібнодисперсні та грубі тверді органічні речовини, а також спори та гіфи аскоміцетів. Не дивно було б стверджувати, що набагато більше дорослих у кількох сім'ях певною мірою годують. Здається, годування відповідає тривалому довголіття у дорослих, що дає їм час дозріти і розійтися.
Використання аналізу кишечника для визначення дієти має деякі недоліки, включаючи труднощі в кількісному визначенні предметів. Нові методи, такі як стабільний ізотопний аналіз, обіцяють більш повно висвітлити харчові мережі, особливо у дитячих та всеїдних видів, де вміст кишечнику часто важко класифікувати, крім різного детриту.
Розподіл ніш: Більшість досліджень комплексів видів кам'янистих мух проводилися в Північній півкулі, де 30 або більше видів можуть вийти з прохолодної води або гірських потоків. Роди складаються з декількох видів, а щільність кожного виду веде до потенціалу космічної та харчової конкуренції. Кожне дослідження цілої сукупності кам'яних мух демонструє, що види поділяються шляхом послідовного розвитку та появи. Малюнок 9 зображує таку послідовність видів для гіпотетичного скупчення з помірно великого потоку на Середньому Заході, США. Зимові кам’яні мухи з’являються з січня по березень. У квітні з’являється невеликий контингент немуридів, лейктридів, капніїдів та перлодидів, за яким настає коротке затишшя. Наприкінці квітня з'являється Pteronarcys, а також ряди Perlid та кілька видів Isoperla. В кінці травня настає ще одне затишшя, перш ніж на початку червня з’являться кілька великих видів, що живуть. Невеликі віки слідують у середині-кінці червня, липні та на початку серпня. Останній вид, що з’явився, - Leuctra tenuis. Більше видів не з’являється до наступного січня. Цей вид сукцесії видів дозволяє співіснувати види зі схожими стратегіями годівлі та потребами середовища існування.
Малюнок 9. Гіпотетичне співтовариство кам’яниць із помірно великого потоку на Середньому Заході, США. Список видів та терміни на основі музейних екземплярів під час опитування природознавства штату Іллінойс.
Кам'яні мухи як показники якості води: Кам'яні мухи дуже чутливі до органічного забруднення та гіпоксії, що виникає разом з ним. Біотичні індекси були розроблені у всьому світі, що постійно оцінює кам'яних мух як найбільш нетерпимі до забруднення. Хоча кілька з цих рейтингових систем були розроблені на основі професійного судження, інші емпірично сформували значення допуску. Навіть вони оцінили кам'яних мух як найбільш чутливий порядок водних комах. У всьому світі кількість видів Ephemeroptera (наплечники), Plecoptera та Trichoptera (ряби) (таксони EPT) використовується як показник якості потоку. На жаль, у наш час багато біологів із забруднення води все частіше знаходять лише мух і каддісфілів для підрахунку.
В даний час розгортаються дані, які свідчать про те, що глобальні зміни клімату впливають на розподіл кам’яниць. У Національному парку Великих задимлених гір, США, виявляється, що принаймні одна велика вічна кам'яниця, Acroneuria abnormis, значно збільшила свій верхній висотний поріг. Цей вид має широке поширення на нижчих висотах і не виявляє жодних ознак звуження. Однак деякі інші види мають більш вузький висотний розподіл в регіоні, і якщо нижня та вища межі зміщуються вгору, ці види можуть натрапити на стелю, за якою вони не можуть колонізуватися. Обмеження включають висоту місцевих гір або висоту, на якій підкислення потоків стає проблематичним - те, що вже відбувається в горах східних частин США та Європи.
Faрунтова фауна
2 Біологія та екологія
Біологія, екологія та соціальне значення морських паразитів
Біологічні показники
Паразити риб використовувались як біологічні індикатори для надання інформації про аспекти екології та поведінки харчувань господарів, у тому числі у віддалених районах, таких як Антарктида (Palm et al., 2007). Оскільки більшість паразитів риб зі складними життєвими циклами передаються через харчовий ланцюг, вони можуть надати інформацію про взаємодію харчових мереж, яку неможливо побачити під час традиційного аналізу вмісту шлунку (Lafferty et al., 2008). Наприклад, дослідники, створюючи харчову мережу в Балтійському морі, виявили, що використання відомих паразитарних інфекцій через харчову мережу надає більше інформації про структуру харчової мережі, ніж розгляд лише спостережуваної дієти (Valtonen et al., 2010). Вторинною перевагою цього дослідження є виявлення проміжних господарів видів паразитів і, як результат, уточнення життєвих циклів паразитів (Marcogliese, 2002). Це дослідження було розширене з метою надання інформації керівникам рибних господарств щодо структури популяції риби під час оцінки запасів (Timi and Mackenzie, 2015).
Оцінки рибних запасів проводяться для оцінки біологічного стану рибного господарства та інформування керівників про стан цього промислу (Catalano et al., 2014). Наприклад, Reed et al. (2012) виявили, що метацеркарія типу "тетракотиль" (дигенетична трематода), що інфікує очі сардин, була корисною біологічною міткою через специфічність її місця, простоту виявлення та ймовірний тривалий термін життя у господаря-сардини. Збираючи, аналізуючи та моделюючи понад 5000 сардин, що переважають паразитів, інтенсивності та чисельності інфекції, Weston et al. (2015) встановили, що існували два окремі запаси сардини. Ця інформація дозволила південноафриканським менеджерам рибного господарства краще управляти цим рибальством.
Оскільки паразити можуть бути характерними для сімейства господаря, роду та/або виду, вони також можуть використовуватися для ідентифікації господаря. Наприклад, дифілідові цестоди допомагають підтвердити ідентифікацію видів променів навколо Британії (Williams, 1964). Інші паразити використовувались для з’ясування філогенезу, особливо для визначення таксономічного положення господаря та паразитів. Олсон та співавт. (2010) виявили, що трипаноринхові цестоди утворювали дві основні лінії і були монофілетичними. Цей розкол забезпечив незалежну підтримку відхилення уявлення про те, що промені походять від акул, і підтримав найновішу молекулярну філогенетику Неоселахій, в якій сучасні акули вважаються рідною групою ковзанів, променів і пил.
Вступ
Уейнрайт і Беллвуд, у главі 2, переходять від філогенезу до функціональної морфології, розвиваючи картину екології живлення рифових риб, зумовлену морфологічними можливостями та обмеженнями. Для тих читачів, які виховують класичну іхтіологію, цей розділ буде освіжаючим оновленням, але не сюрпризом. Але занадто багатьом студентам екології зараз вдається обійти «старомодні» курси, і для них цей розділ може відкрити нові двері для розуміння того, що екологія є результатом взаємодії реальних організмів, що мають фізичні обмеження та можливості.
Моделі екологічної ієрархії
Айялю Уонді,. Тадессе Фетахі, у Розробки в екологічному моделюванні, 2012
14.2.3.13 Склад дієти (DC)
Середній склад їжі кожної групи споживачів був зібраний з літературних даних, а деякі дані були отримані з цього дослідження. 15 великих Labeobarbus добре урізноманітнені за своїм розподілом та екологією живлення (de Graaf, 2003). На основі даних про вміст кишечника Нагелькерке (1997) описав різні (приблизно п’ять) трофічні групи. Вісім з них (B. acutirostris, B. dainelli, B. gorguari, B. longissimus, B. macrophthalmus, B. megastoma, B. platydorsus та B truttiformis) харчуються переважно рибою (малі колючки, Garra sp. Та ювенільні) барбуси та тилапія) і мало на бентосні організми (личинки комах та детрит). Три види (B. crassibarbus, B. nedgia та B. tsanensis) харчуються донними безхребетними (личинками комах та черевоногих молюсків) та детритом. Два види (B. gorgorensis і B. surkis) харчуються сумішшю макрофітів і молюсків. Один вид (B. brevicephalus) харчується переважно зоопланктоном, а інший вид (B. intermedius) має різноманітне харчування. У озері Тана було виявлено три невеликих види колючок (B. pleurogramma, B. tanapelagius та B. humilis) (Dejen, 2003). Однак B. tanapelagius та B. humilis - найпоширеніші маленькі колючки в озері. Зоопланктон був основним компонентом раціону B. tanapelagius, B humilis та неповнолітніх великих колючок.
КОПЕПОДА
IV. ПОТУЖНІ ТА МАЙБУТНІ ПРОБЛЕМИ ДОСЛІДЖЕННЯ
Одне з найбільш вражаючих моментів у прісноводних копеподів - це те, наскільки мало відомо про них у порівнянні з кладоцеранами або морськими копеподами. Для більшості видів бракує базової інформації про такі елементарні речі, як морфологічна характеристика, життєві цикли, репродуктивна біологія, екологія харчування, фізіологія та генетика. Особливо це стосується гарпактикоїдів. За межами Європи таксономічні знання є недостатніми для багатьох видів, особливо для непланктонних видів. Інформація такого роду підвищить наше розуміння копепод як переносників таких захворювань, як холера та дракункульоз, а також допоможе нам реалізувати їх повний потенціал у біологічному боротьбі з комахами-шкідниками, такими як комарі (обговорено вище).
На додаток до розширення наших знань про самі копеподи, дослідження копепод можуть сприяти нашим знанням більш загальних екологічних питань. Невеликі розміри, придатність до культури, дискретні випадки, існування стадій діапаузи та мінливість у структурі життєвої історії дозволяють вирішувати багато цікавих питань в популяційній біології. Інтенсивне та вибіркове годування копепод, а також їх значення як їжі для більш високих трофічних рівнів відкривають шлях для досліджень поведінки кормів, екології громади та екології систем.
Хоча ми усвідомлюємо, що їжа може обмежувати популяцію копепод, ми дуже мало знаємо про відносну важливість їжі для контролю присутності чи чисельності різних видів копеподів у природі. Ми особливо наївно ставимося до інтерактивного впливу таких змінних середовища, як температура, рН, сонячне ультрафіолетове випромінювання, наявність альтернативної їжі, рівень голоду хижака, ризик хижацтва та різні форми забруднення та маніпуляції з навколишнім середовищем на копепод. Оскільки порушення екосистем є нормою, а не винятком у всьому світі (Vitousek, 1994), критично важливо, щоб ми краще зрозуміли, скільки цих абіотичних та біотичних змінних, пов'язаних з порушеннями, впливає на такі ключові організми, як копеподи.
Інший цікавий напрям досліджень, який слід продовжити, стосується відносної чисельності циклопоїдних та кальяноїдних копепод в озерах з різним трофічним статусом (обговорено в Розділі III. F.1). Щільність циклопоїдних копепод та більшості інших груп зоопланктону (інфузорій, коловерток, кладоцеранів) позитивно корелює з первинною продуктивністю озер. Однак це, здається, не є універсальним для іконоподібних копепод (Pace, 1986). Які характеристики калоноїдів дозволяють їм реагувати по-різному від більшості інших груп на коливання первинної продуктивності?
Екологічна генетика - ще одна сфера, яка швидко прогресує і дозріла для подальших досліджень. Наявність або відсутність та терміни зменшення хроматину різняться у різних видів і можуть бути корисними для розшифровки філогенетичних та еволюційних зв'язків між таксонами (Einsle, 1996; Leech and Wyngaard, 1996; Dorward and Wyngaard, 1997). Мало що відомо про ендогенний та екзогенний контроль широкого діапазону змін характеристик історії життя, що спостерігаються для копепод в різних системах або в різні сезони. Багато цікавих еволюційних питань можна задати щодо часу та контролю подій життєвої історії копепод через генетичну ізоляцію популяцій та мінливість селективного тиску, що діє на ці популяції серед озер. Особливий інтерес представляє нещодавня висновок, що яйця, що перебувають у стані спокою, можуть суттєво сприяти еволюції та збереженню популяцій копепод протягом тривалих періодів часу (Hairston et al., 1995; Hairston, 1996), таким чином потенційно дозволяючи копеподам переживати періоди вузьких місць, пов'язаних антропогенні та природні порушення.
Недавні знахідки у Північній Америці видів копепод, пов’язаних з підземними водами, які тісно пов’язані з євразійськими формами (наприклад, Reid, 1998; Reid et al., 1999), проливають нове світло на біогеографічні взаємозв’язки та характер еволюції у копепод. Хоча деякі групи, здається, надзвичайно консервативні, мабуть, мало розходяться з часів передтетянського континентального відокремлення, інші види еволюціонували швидше, використовуючи нові ніші, такі як ценоти півострова Юкатан (Fiers et al., 1996) .
Екотоксикологія: Біоакумуляція ☆
Специфічні для тварин - біологічні фактори
На додаток до хімічних специфічних властивостей, що впливають на накопичення біологічних речовин, самі тварини відрізняються за ступенем накопичення хімічної речовини. Одними з найважливіших факторів, які відрізняються серед тварин, що призводить до відмінностей у біоакумуляції (та БАФ), є вміст ліпідів, екологія харчування, використання середовища існування, розмноження, вік, здатність до біотрансформації, потреба в енергії.
- Демпінг-синдром - огляд тем ScienceDirect
- Збереження їжі - огляд тем ScienceDirect
- Катехін - огляд тем ScienceDirect
- Позалегеневий туберкульоз - огляд тем ScienceDirect
- Дієта на основі зернових - огляд тем ScienceDirect