Дієтична олійна композиція диференційовано модулює транспорт кишкових ендотоксинів та ендотоксемію після їжі
Анотація
Передумови
Ендотоксин, отриманий з кишечника, та подальша ендотоксемія можуть розглядатися як основні фактори, що схильні до таких захворювань, як атеросклероз, сепсис, ожиріння та діабет. Встановлено, що дієтичний жир збільшує постпрандіальну ендотоксемію. Тому метою цього дослідження було оцінити вплив різних дієтичних масел на транспорт кишкових ендотоксинів та постпрандіальну ендотоксемію, використовуючи свиней як модель. Ми висунули гіпотезу, що олії, багаті насиченими жирними кислотами (SFA), збільшуватимуться, тоді як олії, багаті n-3 поліненасиченими жирними кислотами (PUFA), послаблюватимуть транспорт кишкових ендотоксинів та концентрацію в циркуляції.
Методи
Ендотоксемію після їжі вимірювали у двадцяти чотирьох свиней після їжі з каш, виготовленої або з водою (Control), риб'ячим жиром (FO), рослинною олією (VO) або кокосовою олією (CO). Кров збирали через 0, 1, 2, 3 та 5 годин після їжі та вимірювали ендотоксин. Крім того, транспорт ex vivo ендотоксину клубової кишки оцінювали за допомогою модифікованих камер Уссінга, а кишечник обробляли або без олії, або 12,5% (об/об) VO, FO, олії печінки тріски (CLO), CO або оливкової олії (OO). Потім вимірювали проникність транспорту слизової до серозального ендотоксину (Papp) шляхом додавання флуоресцентного міченого ліпополісахариду.
Результати
Після їжі концентрації ендотоксину в сироватці крові збільшувались після їжі, багатої насиченими жирними кислотами, і зменшувались при вищому споживанні n-3 PUFA. Порівняно з контролем відсутність олії, риб'ячий жир та CLO, які багаті жирними кислотами n-3, знижують ex vivo ендотоксин Papp на 50% (P
Передумови
Зв’язок між жировим жиром та ендогенним ендотоксином крові викликає підвищений медичний та біомедичний інтерес протягом останніх кількох років. Крім того, гіперфагія, посилене ожиріння та метаболічні зміни, пов’язані з годуванням з високим вмістом жиру, можуть бути рекапітульовані у мишей, яким хронічно вводили ЛПС протягом чотирьох тижнів [1]. Повідомлялося, що структура споживаного жиру (емульсія проти вільної олії) змінює ступінь ендотоксемії і що зміна складу, структури та якості харчових жирів може покращити стан здоров'я [2]. У здорових людей концентрація ендотоксину після їжі в плазмі збільшується в середньому на 18% після прийому їжі з високим вмістом жиру (приблизно 380 ккал від жиру, 42% від загальної енергії) порівняно із станом голодування [3]. Ці автори дійшли висновку, що збільшення ЛПС після їжі може сприяти розвитку постпрандіального запалення та захворювань. Ганім та ін. [4, 5] також показали, що у здорових дорослих їжа з високим вмістом жиру та вуглеводами (
900 ккал) збільшив концентрацію ЛПС після їжі на 70%. Однак Laugerette et al. [6] нещодавно повідомляв, що дієтична олійна композиція диференційовано модулює мишаче запалення та транспорт ендотоксинів. Ці автори також показали, що склад жиру, а не кількість у раціоні (22 проти 3%) є критичним для модуляції ендотоксемії плазми. У сукупності ці дані показують, що споживання та склади жиру в їжі здатні модулювати ендотоксин крові і що це пов'язано з гострим запаленням та метаболічними захворюваннями ожиріння та діабету.
Отже, метою цього дослідження було оцінити вплив різних харчових жирів на in vivo та ex vivo транспорт кишкових ендотоксинів та концентрації циркулюючих речовин, використовуючи свиню як біомедичну модель. Ми припускаємо, що олії, багаті насиченими жирними кислотами (SFA), збільшуватимуться, тоді як масла, що містять n-3 PUFA (докозагексаєнова кислота [DHA] та ейкозапентаенова кислота [EPA]), послаблюватимуть транспорт кишкового ендотоксину та постпрандіальну ендотоксемію.
Методи
Матеріали та тварини
Всі хімічні речовини, використані для цього дослідження, були придбані у Sigma-Aldrich (Сент-Луїс, Міссурі), якщо не зазначено інше. Усі способи використання тварин та процедури були затверджені Інституційним комітетом з догляду та використання тварин Університету штату Айова.
Вплив дієтичної олії на концентрацію ендотоксину в сироватці крові після їжі
Двадцять чотири свині (49 ± 7 кг т. Д.) Були вирощені на типовому кукурудзяно-соєвому раціоні, який відповідав або перевищував їхні потреби у поживних речовинах [21], і випадковим чином розподілялись на одну з чотирьох обробок. Процедури складалися з 500 г меленого кукурудзяно-соєвого борошняного тіста (2145 ккал ME), що складається з 1) 50 мл води (Control); 2) 50 мл риб’ячого жиру (FO) (Spring Valley Inc., UT); 3) 50 мл рослинного масла (VO) (Hy-Vee Inc., IA); або 4) 50 мл кокосової олії (CO) (Spectrum Naturals Inc., NY). Після нічного голодування шість свиней годували по одній каші. Свині добровільно споживали всю їжу з каші через десять хвилин після їжі. Кров відбирали через 0, 1, 2, 3 та 5 годин після їжі шляхом венепункції за допомогою безпірогенних вакуумних пробірок та стерильних голок. Були вжиті належні запобіжні заходи для запобігання зовнішньому зараженню крові ендотоксинами. Сироватку відокремлювали центрифугуванням при 2000 × g та 4 ° C. Потім сироватку зберігали у пробірках, що не містять пірогену, при −80 ° C до подальшого аналізу.
Концентрацію циркулюючого сироваткового ендотоксину вимірювали за допомогою флуоресцентного аналізу кінцевої точки, використовуючи систему рекомбінантного фактора C (rFC) (Lonza ™, Швейцарія). Коротко, зразки сироватки розбавляли 1000 разів і 100 мкл зразків або стандартів додавали в планшет із 96 лунками та інкубували при 37 ° С протягом 10 хв. Потім до планшета додавали 100 мкл ферменту rFC, буфера для аналізу rFC та субстрату rFC у співвідношенні 1: 4: 5 і проводили початкове зчитування з наступною інкубацією 1 год при 37 ° C. Визначено відносну одиницю флуоресценції (RFU) для кожної лунки (збудження 380 нм та випромінювання 440 нм). Для підтвердження достовірності аналізу використовували стандарт позитивного контролю з набору для аналізу, а концентрацію ендотоксину інтерполювали із стандартної кривої, побудованої за стандартами, та коригували для розведення зразка.
Цілісність кишечника ex vivo та транспорт ендотоксинів
Свіжоізольовані сегменти клубової кишки від одинадцяти свиней (віком 21–28 днів) поміщали в охолоджений буфер Кребса-Генселейта (що складається, в ммоль/л: 25 NaHCO3, 120 NaCl, 1 MgSO4, 6,3 KCl, 2 CaCl2, 0,32 NaH2PO4; pH 7.4) для транспортування до лабораторії під постійною аерацією. Потім кишкові тканини позбавляли зовнішнього серозального шару і негайно встановлювали їх у модифіковані камери Уссінга (Physiologic Instruments Inc., Сан-Дієго, Каліфорнія та World Precision Instruments Inc., Нью-Хейвен, штат Коннектикут). Кожну камеру та сегмент кишечника (0,71 см 2) купали на його слизовій та серозальній сторонах 5 мл буфера Кребса-Генселейта та постійно газували 95% сумішшю O2-5% CO2. Камери з'єднували з парою двоканальних електродів струму та напруги, що містять 3% містків з благородного агару, і заповнювали 3 М хлоридом калію для вимірювання електрофізіологічних параметрів кишкових мембран або для вимірювання транспорту ендотоксину слизової оболонки до серозного. Трансепітеліальна резистентність (TER) не відрізнялася у свиней, не вказуючи на відсутність відмінностей у парацелюлярній проникності або негерметичній кишці (дані не наведені).
Щоб виключити будь-який вплив жовчних кислот на цілісність кишечника, спочатку тестували проникність TER та макромолекули на ізольованих зразках клубової кишки, які інкубували зі свинячою жовчною кислотою (0, 3, 6 та 9 мг/мл) протягом тридцяти хвилин. Потім вимірювали FITC-мічений декстран (FITC-Dextran, 4,4 кДа) транспорт слизової оболонки до серозалу, як описано раніше [22]. Коротко кажучи, камери слизової викликали 2,2 мг/мл FITC-декстрану, а зразки камер з обох сторін збирали кожні 10–15 хв протягом вісімдесяти хвилин. Потім відносну флуоресценцію визначали за допомогою флуоресцентного зчитувача пластин (Bio-Tek, США) з довжинами хвиль збудження та випромінювання 485 і 520 нм відповідно. Потім для кожної обробки розраховували очевидний коефіцієнт проникності (Папп):
Де: dQ/dt = швидкість транспортування (мкг/хв); С0 = початкова концентрація в донорській камері (мкг/мл); A = площа мембрани (см 2).
Вплив харчового жиру на транспорт ендотоксинів вивчали з використанням проникності ex vivo флуоресцеїну ізотіоціанату (FITC) з міткою LPS (Escherichia coli 055: B5), встановленої у модифікованих камерах Уссінга. Коротко кажучи, сегменти кишкових тканин свиней обробляли або 12,5% (об./Об.) Забуференним сольовим розчином (CON), риб'ячим жиром або олією печінки тріски (CLO) виробництва Spring Valley Inc., UT) або рослинною олією, кокосовою олією або оливкова олія (ОО), придбана у Hy-Vee Supermarkets Inc., IA). Всі олії продавались у комерційному роздріб, а потім змішувались з 20 мМ тауродеоксихолатом натрію (жовчною кислотою) для утворення міцел для імітації кишкового середовища. Потім кожну слизову камеру піддавали 20 мкг/мл FITC-LPS, і зразки камери збирали кожні 10–15 хв протягом вісімдесяти хвилин. Потім відносну флуоресценцію кожного зразка визначали за допомогою флуоресцентного зчитувача пластин (Bio-Tek, США) з довжинами хвиль збудження та випромінювання 485 і 520 нм відповідно. Потім коефіцієнт видимої проникності розраховували подібно до описаного вище для FITC-Dextran.
Ліпідні плоти, дієтична олія та транспорт кишкових ендотоксинів ex vivo
Для вивчення ролі ліпідних плотів у транспорті кишкових ендотоксинів, сегменти клубової кишки від 16 свиней (віком 56 ± 4 дні) були встановлені в камерах Уссінга, як описано вище. Сегменти попередньо обробляли 25 мМ метил-β-циклодекстрину або без нього (MβCD, модифікатор синтетичного ліпідного плоту) протягом 30 хв. Після цього в слизову камеру додавали або сольово-жовчну кислоту (CON), або кокосове масло-жовчна кислота (12,5% об./Об.), І розраховували коефіцієнт проникності FITC-LPS для кожної тканини.
Аналіз жирних кислот
Профілі жирних кислот дієтичних масел, що використовувались для приготування каші, визначали та аналізували за допомогою ГХ-МС [23, 24]. Один мл олії змішували з 0,5 мл гексану 4: 1 і 125 мкг/л гептадеканової кислоти додавали до кожної проби як внутрішній стандарт. FAME аналізували за допомогою GC на моделі Hewlett-Packard 6890, оснащеній капілярною колоною Omegawax 320 (30 м × 0,32 мм, тобто 0,25 мкм). Водом був газ-носій. Температурна програма становила від 80 до 250 ° C з підвищенням температури 5 ° C/хв. Температура інжектора та детектора становила 250 ° C, а 1 мкл зразка впорскували та розподіляли. Метилові ефіри жирних кислот ідентифікували за їх відносним часом утримування на колонці щодо відповідних стандартів та гептадеканової кислоти.
Аналіз даних
Результати представлені у вигляді середніх значень ± S.E.M та проаналізовані за допомогою змішаної процедури Proc SAS (Cary, NC). У моделі повторення або день пробігу камери Уссінга використовували як випадковий ефект. Статистичну значимість різниці аналізували за допомогою дисперсійного аналізу (ANOVA) з подальшим тестом діапазону Тукі для парного порівняння всіх засобів лікування. Відмінності вважали значними при P ≤ 0,05, а тенденції при P ≤ 0,10.
Результати
Дієтичні олійні профілі жирних кислот
Склад жирних кислот олій, що використовуються для приготування кашового борошна та/або у дослідженні ex vivo щодо транспортування, наведено в таблиці 1. Кокосова олія містила високі концентрації насичених жирних кислот (89%), особливо лауринової, міристинової, пальмітинової кислот . Оливкова олія містила дуже високий вміст мононенасиченої олеїнової кислоти та помірну кількість пальмітинової кислоти із вмістом насичених жирів 29%. Рослинна олія, використана в цьому дослідженні, містила велику кількість (50%) арахідонової кислоти (20: 4n6), 32% олеїнової кислоти та 13% пальмітинової кислоти. Використовуваний риб’ячий жир складався з 35% докозагексаєнової кислоти (DHA) та 19% ейкозапентаенової кислоти (EPA), тоді як олія печінки тріски містила 32% пальмітинової кислоти, 25% арахідонової кислоти, 8,6% EPA та 4,3% DHA. Співвідношення n6: n3 було найвищим у оливковій олії> рослинна олія> олія печінки тріски> риб'ячий жир> кокосова олія.
Вплив дієтичної олії на концентрацію ендотоксину в сироватці крові після їжі
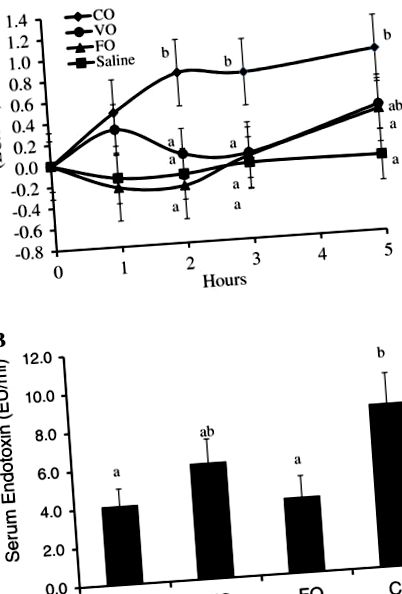
Для оцінки впливу харчових ліпідів на концентрацію ендотоксину в сироватці крові після їжі свині отримували кашову їжу, що містила або 50 мл сольового розчину, CO, VO або FO. Концентрація ендотоксину в різних використовуваних оліях не відрізнялася (дані не наведені). Зміна концентрації ендотоксину в сироватці після прийому їжі внаслідок різних способів прийому їжі представлена на малюнку 1А. Загальна концентрація ендотоксину в сироватці після прийому їжі була значно нижчою в їжі, що становить фізіологічний розчин або FO, при цьому середня загальна концентрація ендотоксину в сироватці зросла вдвічі за обробку насиченого кокосового масла (P Рисунок 1
Вплив екзогенної свинячої жовчної кислоти на цілісність кишечника ex vivo
Було показано, що жовчні кислоти підвищують кишкову проникність у культивованих клітинних лініях Сако-2 [25]. Щоб виключити вплив того, що екзогенна жовчна кислота може знизити цілісність кишечника, для вимірювання TER (рис. 2А) та проникності FITC-Dextran (рис. 2B) використовували свіжоізольовані сегменти клубової кишки свині. Оскільки ці сегменти піддавалися зростанню концентрацій свинячої жовчі ex vivo, ніяких відмінностей у цілісності кишечника не спостерігалося (P> 0,10, малюнок 2). Це може бути пов’язано з толерантністю кишкових тканин до жовчних кислот через попередній вплив in vivo на противагу клітинним культурам, де клітини раніше не зазнавали впливу жовчних кислот.
Вплив дієтичної олії на транспорт кишкових ендотоксинів ex vivo
Транспорт слизової оболонки ex vivo до ендотоксину серозальної клубової кишки оцінювали за допомогою модифікованих камер Уссінга та аналізу проникності FITC-LPS (рис. 3). Порівняно з фізіологічним розчином без контролю за вмістом олії, ендотоксин Papp був значно нижчим як при FO, так і при CLO (P 0,05), але все ще послаблював ендотоксин Papp у порівнянні з лікуванням кокосовою олією (P Рисунок 3
Вплив модифікації ліпідного плота на індукований насиченими жирами транспорт ендотоксину
Для перевірки гіпотези про те, що дестабілізація кишкових ліпідних пліт зменшить проникність ендотоксину, спричинену насиченими жирами, зразки клубової кишки попередньо обробили модифікатором ліпідного пліт метил-β-циклодекстрином (MβCD) та кокосовою олією ex vivo. Потім вимірювали проникність транспорту ендотоксинів FITC-LPS (рис. 4А). Як і очікувалось, лікування СО значно збільшило ендотоксин клубової кишки Papp порівняно з контролем сольового розчину (P Рисунок 4
Обговорення
Ми висунули гіпотезу, що вживання в їжу масел, багатих на ДГК та ЕРА, послаблює транспорт кишкового ендотоксину та циркулюючий ендотоксин після їжі. Ми виявили, що дієтична печінка тріски та риб’ячий жир послаблювали концентрацію ендотоксину в сироватці порівняно з кокосовим маслом, а рівень ендотоксину у цих свиней був подібним до контрольної групи (рис. 1). Наскільки нам відомо, не існує жодних інших досліджень, які б демонстрували цей ефект DHA та EPA на транспорт ендотоксинів та ендотоксемію крові.
Під час кишкового стресу, ішемії, запалення та захворювань парацелюлярний транспорт відбувається через тісне з'єднання, відоме як "негерметична кишка" [39]. Як варіант, може відбуватися трансклітинний або внутрішньоклітинний транспорт, особливо у здорових людей [40]. Встановлено, що трансклітинний ендотоксин, що транспортується через клітинну мембрану, відбувається через TLR4 та розчинний GPI-закріплений рецептор CD14 у механізмі, опосередкованому ліпідним плотом [41, 42]. Крім того, припускається, що асоційований з хіломікроном транспорт ЛПС також відіграє ключову роль у транспорті ЛПС кишечника з епітеліальної клітини кишечника [11, 43, 44]. Важливо, що ми не спостерігали зниження цілісності кишечника, що могло б посилити парацелюлярну проникність, як оцінювали за трансепітеліальною резистентністю або проникністю FITC-декстрану внаслідок лікування або короткочасної дестабілізації плоту (Малюнок 4B). Ці дані свідчать про те, що в умовах здорового кишкового епітелію ендотоксин, швидше за все, транспортується через ендоцитоз, опосередкований ліпідним плотом.
Експерименти in vitro чітко показують, що n-3 PUFA порушують передачу сигналів TLR4 та активацію NFκB LPS у моноцитарній клітинній лінії миші [50]. Більше того, DHA модулює передачу сигналів TLR4 in vitro у RAW 264,7 макрофагах та 293 Т-клітинах [49], моноцитах та дендритних клітинах людини [51] та жировій тканині. Раніше ми показали на свинях, що дієтичні ЕРА та DHA є ефективними засобами впливу на запальний статус та шляхи, на які впливає сигналізація TLR4, індукована LPS [52], та на зміну функції кишечника [24, 53]. Отже, можна постулювати, що протидія вербуванню TLR4 на ліпідні плоти, і це сигналізація DHA та EPA, або стимулювання цих процесів насиченими жирними кислотами, може змінити транспорт ендотоксину та циркулюючий постпрандіальний ендотоксин.
Інший механізм, через який ендотоксин може потрапляти в кровообіг, - це міцели. Оскільки бічні ланцюги ендотоксинів складаються з жирних кислот, ендотоксини можуть вбудовуватися в міцели та транспортуватися в епітеліальну клітину кишечника [54]. В епітеліальних клітинах кишечника хіломікрони транспортують поглинені ліпіди в різні частини тіла. Було показано, що введення високого вмісту жиру пропорційно збільшує вміст ендотоксину в хіломікроні, що вказує на те, що велике споживання жиру дійсно посилює транспорт ендотоксину в клітині епітелію кишечника та включення його в хіломікрон [11, 28]. Більше того, незважаючи на те, що механізм незрозумілий, показано, що велике споживання жиру спричиняє інтерналізацію білків із щільним з'єднанням та збільшення проникності парацелюлярних речовин до макромолекул, включаючи ендотоксин [30]. Незважаючи на те, що цей спосіб транспортування ендотоксинів не можна виключати, ми припускаємо, що швидкість включення жирних кислот у міцели не буде змінюватися через склад олії. Отже, ми припускаємо, що різниця в транспорті ендотоксину кишечника, яку ми спостерігали, полягає в першу чергу в міжклітинному транспорті, який включає ліпідні плоти та опосередкований рецептором ендоцитоз [42].
На закінчення ці дані свідчать про те, що дієтичні олії можуть по-різному змінювати транспорт кишкових ендотоксинів. Масла, багаті DHA та EPA, послаблюють транспорт ендотоксинів, тоді як масла з високим вмістом насичених жирних кислот посилюють транспорт ендотоксинів. Крім того, транспорт кишкового ендотоксину у здорових осіб може регулюватися за допомогою механізму, опосередкованого ліпідним плотом. Насичені жирні кислоти можуть стабілізувати ліпідний пліт, забезпечуючи більший транспорт ендотоксину.
- Дієтичні звички 2–9-річних американських дітей пов’язані зі складом мікробіомів кишечника
- Дієтичні схеми, пов’язані з чітким складом мікробіоти у дітей, кафедра харчових наук
- Дієтична фруктоза та глюкоза диференціально впливають на гомеостаз ліпідів та глюкози
- Порівняння чотирьох популярних дієтичних тенденцій Paleo проти Keto проти 5 2 проти Dukan - Мій блог
- Дієта та первинна профілактика інсульту Систематичний огляд та дієтичні рекомендації спеціальною