Дієта з низьким вмістом білка сприятливо впливає на статус діабету та запобігає діабетичній нефропатії у жирних щурів Wistar, тваринного типу діабету 2 типу та ожиріння
Анотація
Передумови
Мета цього дослідження - дослідити вплив дієти з низьким вмістом білка (ЛПД), починаючи з молодого віку, на діабетичний статус та пошкодження нирок у моделі щурів діабету 2 типу та ожиріння.
Методи
Діабет чоловічий Wistar жирний (фа/фа) щурів (WFR) годували стандартною дієтою (23,84% білка) або LPD (5,77% білка) протягом 24 тижнів, починаючи з 6-тижневого віку. Ми досліджували вплив LPD на загальну масу тіла (BW); вага жиру (FW); вага м’язів нижньої кінцівки (МВ); кілька показників діабетичного статусу, включаючи рівень глюкози натще/випадково, HOMA-IR та IPITT; та пошкодження нирок, включаючи гіпертрофію нирок, альбумінурію та гістологічні зміни. Додатково оцінювали аутофагію та активацію mTORC1 у діабеті кори нирок. Крім того, оцінювали рівні плазмового FGF21 та високомолекулярних (HMW) адипонектину, а також рівні експресії UCP1 у коричневій жировій тканині (BAT).
Результати
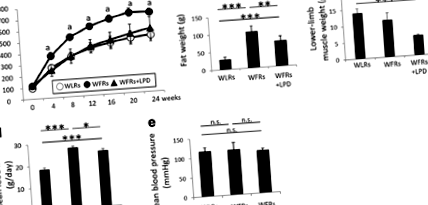
Збільшення BW та FW у WFR було значно зменшене LPD, і LPD призвело до значного зменшення MW нижньої кінцівки в WFR. LPD пригнічував підвищення рівня глюкози в WFR за рахунок поліпшення резистентності до інсуліну. LPD також підвищував адипонектин FGF21 та HMW у плазмі WFR, а також експресію UCP1 у НДТ тварин. Гіпертрофія нирок, альбумінурія, ниркові гістологічні зміни та підвищена експресія р62 та фосфо-S6 рибосомного білка (p-S6RP) спостерігались у WFR порівняно зі значеннями WLR. LPD чітко запобігав пошкодженню нирок діабету.
Висновки
LPD запобігав прогресуванню діабетичного статусу; цей ефект міг бути пов'язаний зі зменшенням FW та підвищенням рівня адипонектину FGF21 та HMW у плазмі крові, а також експресією UCP1 у НДТ, що призводить до придушення діабетичної нефропатії. Однак у пацюків знизився МВт через споживання LPD з молодого віку; тому необхідні подальші дослідження для вирішення харчової проблеми LPD щодо зменшення в МВ.
Передумови
Кількість пацієнтів, які страждають на діабет 2 типу, у всьому світі збільшується. Діабет 2 типу тісно пов’язаний з ожирінням, і нещодавнє збільшення поширеності діабету 2 типу у всьому світі в значній мірі відображає зростання ожиріння. До діабетичних судинних ускладнень належать мікроангіопатії, такі як ретинопатія, нейропатія та нефропатія, а також макроангіопатія на основі атеросклерозу. Серед цих діабетичних судинних ускладнень діабетична нефропатія розвивається у 40% хворих на цукровий діабет і залишається провідною причиною термінальної стадії ниркової хвороби (ШОЕ) [1]. Крім того, рівень захворюваності на серцево-судинні захворювання (ССЗ) у пацієнтів з діабетичною нефропатією високий, що сприяє смертності. Існує порочний цикл між хронічною хворобою нирок (ХХН), включаючи діабетичну нефропатію та ССЗ [2], оскільки такі пацієнти страждають не тільки на діабет, але й на ожиріння, дисліпідемію, гіпертонію та інші стани, які визнані загальними факторами ризику, пов’язаними з прогресування ХХН та ССЗ. Тому для профілактики діабетичної нефропатії та ССЗ рекомендується багатофакторне лікування для контролю множинних факторів ризику та підтримання метаболічного стану серцево-ниркових органів [3,4,5].
Методи
Дослідні тварини
Біохімічні вимірювання
Наприкінці експерименту рівні HbA1c вимірювали за допомогою аналізатора DCA 2000 (Siemens Medical Solutions Diagnostics, Токіо, Японія). Альбумін у сечі, інсулін у плазмі, FGF21 та високомолекулярний (HMW) адипонектин вимірювали за допомогою наборів ІФА (сечовий альбумін: NEPHRAT II, Exocell, Inc., Філадельфія, Пенсільванія; інсулін у плазмі крові: Інститут біологічних наук Morinaga, Inc ., Канагава, Японія; адипонектин плазми: SHIBAYAGI Co., Ltd., Gunma, Японія). Загальний холестерин у плазмі (T-CHO) та тригліцериди (TG) вимірювали за допомогою набору Pureauto S TG-N (Sekisui Medical, Токіо, Японія) та набору для тесту H на холестерин типу L (Wako Pure Chemical Industries, Осака, Японія). ). Креатинін у сечі (Cr) вимірювали ферментативними методами. Формула для оцінки моделі гомеостазу HOMA-IR була (глюкоза в плазмі натще × інсулін у плазмі натще)/405.
IPGTT та IPITT
IPGTT та IPITT проводили через 24 тижні втручання, як описано раніше [16]. Коротше кажучи, для тестів на толерантність до глюкози щури голодували протягом ночі протягом 16 год з подальшою внутрішньочеревною ін’єкцією глюкози (1 г/кг ТБ). Глюкозу в крові вимірювали за допомогою хвоста крові, зібраного через 0, 15, 30, 60 та 120 хв після ін’єкції. Для тестів на толерантність до інсуліну щурам внутрішньочеревно вводили звичайний людський інсулін (Novolin R; Novo Nordisk, Clayton, NC) при 0,75 ОД/кг маси тіла після 6-годинного голодування, а глюкозу в крові вимірювали 0, 15, 30 і 60 хв пізніше.
Морфологічний аналіз
Зрізи нирок фарбували трихромом Массона (МТ). Для напівкількісної оцінки фіброзу нирок за допомогою фарбування МТ у 10 випадково відібраних клубочках або тубуло-інтерстиціальних ділянках на щура відсотки ділянок, пофарбованих від фіброзу, оцінювались так: 0, 0 - 5% фарбування; Від 1,5 до 25%; Від 2, 25 до 50%; 3, 50 - 75%; і 4,> 75% [16].
ПЛР у режимі реального часу
Виділення загальної РНК з кори нирок або коричневої жирової тканини (BAT), синтез кДНК та кількісну ПЛР у реальному часі проводили, як описано раніше [16]. Зонди TaqMan для колагену типу 3 (Col3) (Ідентифікатор продукту: Rn01437681), Cd68 (Rn01495634), інтерлейкіну-6 (Il6) (Rn01410330), CC мотиву хемокінового ліганду 2 (Ccl2) (Rn00580555), Toll-подібного рецептора 4 (Tlr) ) (Rn00569848), молекула пошкодження нирок-1 (Kim-1) (RN00597703) та роз’єднуючий білок1 (Ucp1) (Rn00562126) були придбані у Thermo Fisher Scientific (Waltham, MA, USA) [16]. Аналітичні дані нормалізували до рівнів експресії мРНК 18 с (Rn03928990) як внутрішній контроль.
Вестерн-блот
Вестерн-блотинг проводили з використанням антитіл проти p62 (1: 1000), β-актину (1: 1000), фосфо-S6 рибосомного білка (S6RP) (1: 1000) та S6RP (1: 1000), як описано раніше [16 ]. Антитіло проти p62 було отримано з медичної та біологічної лабораторій (Нагоя, Японія). Анти-β-актин, анти-фосфо-S6RP та анти-S6RP антитіла були отримані від Cell Signaling Technology (Danvers, MA, USA). Антитіло проти UCP1 було придбано у Abcam (Кембридж, Массачусетс, США).
Статистичний аналіз
Дані виражаються як середнє значення ± стандартне відхилення (SD). Для визначення значущості відмінностей між трьома або більше групами використовували ANOVA, за яким проводився багаторазовий тест порівняння Тукі, т-тест використовувався для неспарених порівнянь. A стор значення
Результати
LPD зменшує метаболічні порушення у щурів із діабетом та ожирінням
Рівні адипонектину FGF21 і HMW у плазмі крові та експресія мРНК UCP1 у НДТ підвищені у WFR, що харчуються LPD
Концентрації адипонектину FGF21 та HMW вимірювали після 16-годинного голодування та у довільно вибраний час після їжі (починаючи з 10 години ранку) після 24-тижневого дієтичного втручання. Жодних відмінностей у рівнях FGF21 натощак не спостерігалося серед трьох груп щурів (рис. 3а). Хоча рівні FGF21 у плазмі крові були помітно знижені після прийому їжі в WLR та WFR, що харчуються STD, цих змін у FGF21 після прийому їжі не спостерігалось у WFR, що харчувались LPD (рис. 3а). Крім того, рівні адипонектину HMW у плазмі крові після 16-годинного голодування були значно нижчими у WFR, ніж у WLR. У WFR, що харчуються LPD, рівні адипонектину HMW у плазмі показали значно більший приріст, ніж у WLR або WFR, що харчуються STD (рис. 3b). На відміну від цього, ніяких відмінностей у рівнях адипонектину HMW у плазмі крові у довільно обраний час між 3 групами щурів (рис. 3b) не спостерігалось. Ці дані свідчать про те, що LPD сприяє підвищенню рівня плазмового FGF21 та адипонектину HMW. Крім того, як експресія мРНК Ucp1, так і експресія білка UCP1 були значно підвищені в НДН WFR, оброблених LPD, порівняно з експресією WFR, що харчуються STD (рис. 3c-e).
Зміни морфології нирок, виведення альбуміну з сечею та пошкодження нирок
Обговорення
У цьому дослідженні ми продемонстрували, що LPD, застосований з юних років, запобігав підвищенню рівня глюкози та покращував резистентність до інсуліну та дисліпідемію на тваринній моделі діабету 2 типу та ожиріння у жирних щурів Wistar. Ці поліпшення діабетичного статусу можуть бути пов’язані із збільшенням експресії FGF21 у плазмі крові, адипонектину HMW та експресії UCP1 в НДТ WFR. Крім того, застосування ЛПД з молодих років запобігало прогресуванню діабетичних травм нирок, включаючи пошкодження клубочків та тубуло-інтерстиціальних тканин. Більше того, LPD призвів до зменшення як жирової, так і м’язової ваги в WFR.
На додаток до поліпшення системних метаболічних змін, включаючи метаболізм глюкози, попередні звіти продемонстрували, що FGF21 захищає від індукованих цукровим діабетом пошкоджень нирок за допомогою антифіброзного, протизапального та антиоксидантного стресового ефекту у мишей db/db та у мишей з дієтою. індуковане ожиріння та діабет 2 типу [43, 44]. Отже, наші дані також вказують, що LPD може захищати від діабетичної нефропатії як опосередковано, так і безпосередньо через індукцію FGF21.
Висновки
LPD, застосований з молодих років, запобігав прогресуванню діабетичного статусу та збільшенню маси жиру, що, можливо, було пов'язано зі збільшенням плазми FGF21 та адипонектину HMW, а також надмірною експресією UCP1 в НДТ, що призвело до придушення діабетичних травм нирок. в WFR. Однак механізм, за допомогою якого LPD пригнічує частоту діабету, до кінця не з’ясований. Крім того, можуть бути також деякі проблеми, пов'язані з довгостроковим ЗЗЗ, включаючи недоїдання або саркопенію. Тому необхідні подальші дослідження для вирішення цих питань та розробки більш корисних дієтичних протоколів або замінників ЛНД для метаболічного здоров'я та відновлення захисту.
- Сприятливий вплив елементарної дієтичної терапії з низьким вмістом жиру на біль при хронічному панкреатиті
- Асоціація між соціально-економічним статусом та якістю харчування у мексиканських чоловіків та жінок
- 12 основ для створення діабетичної дієти для повсякденного здоров’я
- Корисні бактерії Як додати квашену капусту у свій раціон
- Анальна евакуація газів та мікробіота товстої кишки у пацієнтів з ефектом метеоризму дієтичного кишечника